
工程化学试卷D参考答案 一.填空题:(每题2分,共20分) 1.H2PO4的共轭酸是HPO4。 2.难挥发的非电解质稀溶液的沸点上升。 3.采用惰性电极电解KOH溶液,得到的电解产物为H2O2 4.原子核外电子分布的三个原理是泡利不相容原理、最低 能量原理和洪德规则。 5.四个量子数是主量子数、角量子数、磁量子数和自旋量子 数。 6.极化包括浓差极化和电化学极化两个方面。 7阴极保护法包括牺牲阳极阴极保护法和外加电流法。 8.在无非体积功的条件下,定压反应热等于焓变 9在电解池中,与直流电源正极相连的极,进行氧化反应,是 阳极。 10.根据溶度积规则,当Q=Ksp,是饱和溶液。 二、选择题:(每小题2分,共30分) 1.AgC1在下列哪种溶液中的溶解度最小 (D) (A)纯水 (B)0.01mol/L的CaClz溶液 (C)0.01mol/L的NaC1溶液(D)0.05mol/L的AgNO溶液 2.在等温下,若化学平衡发生移动,其标准平衡常数(B) (A)增大(B)不变(C)减小D)不确定 3.某温度时,反应H2(g)+Bn(g)=2HBr(g)的平衡常数 K0,则反应HBr(g)=12H2(g)+12Bn(g)的平衡常数 为 (B) (A)1/K0 (B)(1/K0) (C)K0 (D)(1/K0)3 4.在恒温恒压无非体积功的条件下当时,是自发过程
工程化学试卷 D 参考答案 一. 填空题:(每题 2 分,共 20 分) 1. H2PO4 -的共轭酸是 H3PO4 。 2.难挥发的非电解质稀溶液的沸点 上升 。 3.采用惰性电极电解 KOH 溶液,得到的电解产物为 H2 O2 。 4. 原子核外电子分布的三个原理是泡利不相容原理、 最低 能量原理 和洪德规则。 5.四个量子数是主量子数、角量子数、 磁量子数 和自旋量子 数。 6.极化包括 浓差极化 和电化学极化两个方面。 7.阴极保护法包括 牺牲阳极阴极保护法 和外加电流法。 8.在无非体积功的条件下,定压反应热等于 焓变 。 9.在电解池中,与直流电源正极相连的极,进行 氧化 反应,是 阳极。 10.根据溶度积规则,当 Q = Ksp,是饱和溶液。 二、选择题:(每小题 2 分,共 30 分) 1. AgCl 在下列哪种溶液中的溶解度最小 ( D) (A)纯水 (B)0.01mol/L 的 CaCl2 溶液 (C)0.01mol/L 的 NaCl 溶液 (D)0.05mol/L 的 AgNO3溶液 2. 在等温下,若化学平衡发生移动,其标准平衡常数( B ) (A)增大 (B)不变 (C)减小 (D)不确定 3. 某温度时,反应 H2(g)+Br2(g)=2HBr(g)的平衡常数 为 Kθ,则反应 HBr(g)=1/2 H2(g)+1/2Br2(g)的平衡常数 为 ( B) (A)1/Kθ (B)(1/ Kθ )1/2 (C)Kθ (D)(1/Kθ)2 4. 在恒温恒压无非体积功的条件下当______时,是自发过程

过程能向正方向进行 (B) (A)AG>0 (B)QKK 0 (C)Q=K 0 (D)Q>K 0 5.已知反应2A(g)+B(g)→2C(g)是元反应,将A的浓 度增加到原来的3倍,其余条件不变,反应速率变为原来的 倍。 (D) (A)1/3 (B)3 (C)6 (D)9 6.下列哪一种说法是错误的 (C) (A)任何指定单质的标准摩尔生成焓等于零。 (B)水合氢离子的标准熵值为零。 (C)任何指定单质的标准熵值为零。 (D)任何指定单质的标准摩尔生成吉布斯函数为零。 7.下列哪一种说法是正确的 (B) (A)对于反应Fe0(s)+C(s)=CO(g)+Fe(s),由于化 学方程式两边物质的化学计量系数之和相等,故改变总压力对平 衡无影响。 (B)对于一个反应,当温度发生改变,通常对△S0和△H 0影响较小,而对△G0的值影响较大。 (C)己知反应2A(g)+B(g)=2C(g)的△H<0,升高温 度使v(逆)增大,v(正)减小,将导致平衡向左移动: (D)反应的△H就是反应的热效应。 8.下列哪一种说法是正确的 (A (A)弱酸和弱碱的解离常数只与溶液温度有关,而与其浓度 无关。 (B)两种分子酸HX和HY溶液有同样的pH值,则两种酸 的浓度相同。 (C)根据稀释定律,弱酸溶液越稀,其解离度越大,故溶液 中氢离子浓度也越大。 (D)在相同浓度的一元酸溶液中,C(H)都相等,因为中和同 体积同浓度的醋酸溶液和盐酸溶液所需的碱是等量的。 9.下列哪一种说法是正确的 (B) (A)负极发生还原反应,正极发生氧化反应。 (B)任何温度下,标准氢电极的(平衡)电极电势为0。 (C)电极电势的大小反映了氧化还原电对中的氧化态物质和 还原态物质在水溶液中氧化还原能力的相对强弱。若氧化还原电 对的电极电势代数值越大,则该电对中的还原态物质是越强的还
过程能向正方向进行 ( B ) (A) △G>0 (B) QKθ 5. 已知反应 2A(g)+B(g)→2C(g)是元反应,将 A 的浓 度增加到原来的 3 倍,其余条件不变,反应速率变为原来的____ 倍。 ( D ) (A)1/3 (B)3 (C)6 (D)9 6.下列哪一种说法是错误的 ( C ) (A)任何指定单质的标准摩尔生成焓等于零。 (B)水合氢离子的标准熵值为零。 (C)任何指定单质的标准熵值为零。 (D)任何指定单质的标准摩尔生成吉布斯函数为零。 7. 下列哪一种说法是正确的 ( B ) (A)对于反应 FeO(s)+C(s)=CO(g)+Fe(s),由于化 学方程式两边物质的化学计量系数之和相等,故改变总压力对平 衡无影响。 (B)对于一个反应,当温度发生改变,通常对ΔSθ和ΔH θ影响较小,而对ΔGθ的值影响较大。 (C)已知反应 2A(g)+B(g)=2C(g)的ΔH < 0,升高温 度使 v(逆)增大,v(正)减小,将导致平衡向左移动。 (D)反应的△H 就是反应的热效应。 8. 下列哪一种说法是正确的 ( A ) (A) 弱酸和弱碱的解离常数只与溶液温度有关,而与其浓度 无关。 (B) 两种分子酸 HX 和 HY 溶液有同样的 pH 值,则两种酸 的浓度相同。 (C) 根据稀释定律,弱酸溶液越稀,其解离度越大,故溶液 中氢离子浓度也越大。 (D) 在相同浓度的一元酸溶液中,C(H+ )都相等,因为中和同 体积同浓度的醋酸溶液和盐酸溶液所需的碱是等量的。 9. 下列哪一种说法是正确的 ( B ) (A) 负极发生还原反应,正极发生氧化反应。 (B) 任何温度下,标准氢电极的(平衡)电极电势为 0。 (C) 电极电势的大小反映了氧化还原电对中的氧化态物质和 还原态物质在水溶液中氧化还原能力的相对强弱。若氧化还原电 对的电极电势代数值越大,则该电对中的还原态物质是越强的还

原剂。 (D)某化学反应的△G>0,此反应是不能发生的: 10.下列哪一种说法是正确的 (A) (A)己知常温下Ksp(Ag:Cr04)=112×10-12,Ksp(AgC1)=1.77 ×10-,所以,AgC1溶解度小于Ag,CrO,的溶解度。 (B)Pb2和CaCO3的浓度积均近似为109,从而可知两者的饱和溶 液中Pb2+的浓度与Ca2+的浓度近似相等。 (C)MgCO3的溶度积为6.82×10,这意味着所有含MgCO3的溶液 中CMg2*=C(C032-),而且CMg2+)×C(C032=6.82×10-6 mol2.dm-6。 (D)在多电子原子中,轨道能量只决定于主量子数。 11、下列物理量中,属于状态函数的是(A) (A)H (B)Q (C)△HD)△U 12、当反应A2+B2 →2AB的速率方程式D=kA2B2]时,则此 反应(C) (A)一定是基元反应 (B)一定是非基元反应 (C)不能肯定是否基元反应 D)反应是一级反应 13、催化剂是通过改变反应进行的历程来加速反应速率。这一历 程影响(B) (A)增大碰撞频率 (B)降低活化能 (C)减小速率常数 (D)增大平衡常数值 14、下列物质中,既是质子酸,又是质子碱的是(C) (A)OH-(B)NH4 (C)HS-(D)PO43 15、下列物理量中,属于强度性质的是(D) (A)H (B)G (C)S (D)T
原剂。 (D) 某化学反应的ΔG>0,此反应是不能发生的。 10. 下列哪一种说法是正确的 ( A ) (A)已知常温下 Ksp(Ag2CrO4 )=1.12×10—12,Ksp(AgCl)=1.77 ×10—10,所以,AgCl 溶解度小于 Ag2CrO4 的溶解度。 (B)PbI2 和 CaCO3 的浓度积均近似为 10-9,从而可知两者的饱和溶 液中 Pb2+的浓度与 Ca2+的浓度近似相等。 (C)MgCO3 的溶度积为 6.82×10-6,这意味着所有含 MgCO3 的溶液 中 C(Mg2+)=C(CO3 2- ),而且 C(Mg2+)×C(CO3 2- )=6.82×10-6 mol2·dm-6。 (D)在多电子原子中,轨道能量只决定于主量子数。 11、下列物理量中,属于状态函数的是( A ) (A) H (B) Q (C) △H (D) △U 12、当反应 A2+B2——→2AB 的速率方程式 D=k[A2][B2]时,则此 反应( C ) (A) 一定是基元反应 (B) 一定是非基元反应 (C) 不能肯定是否基元反应 (D) 反应是一级反应 13、催化剂是通过改变反应进行的历程来加速反应速率。这一历 程影响( B ) (A) 增大碰撞频率 (B) 降低活化能 (C) 减小速率常数 (D) 增大平衡常数值 14、下列物质中,既是质子酸,又是质子碱的是( C ) (A) OH- (B) NH4 + (C) HS- (D) PO4 3- 15、下列物理量中,属于强度性质的是( D ) (A) H (B) G (C) S (D) T
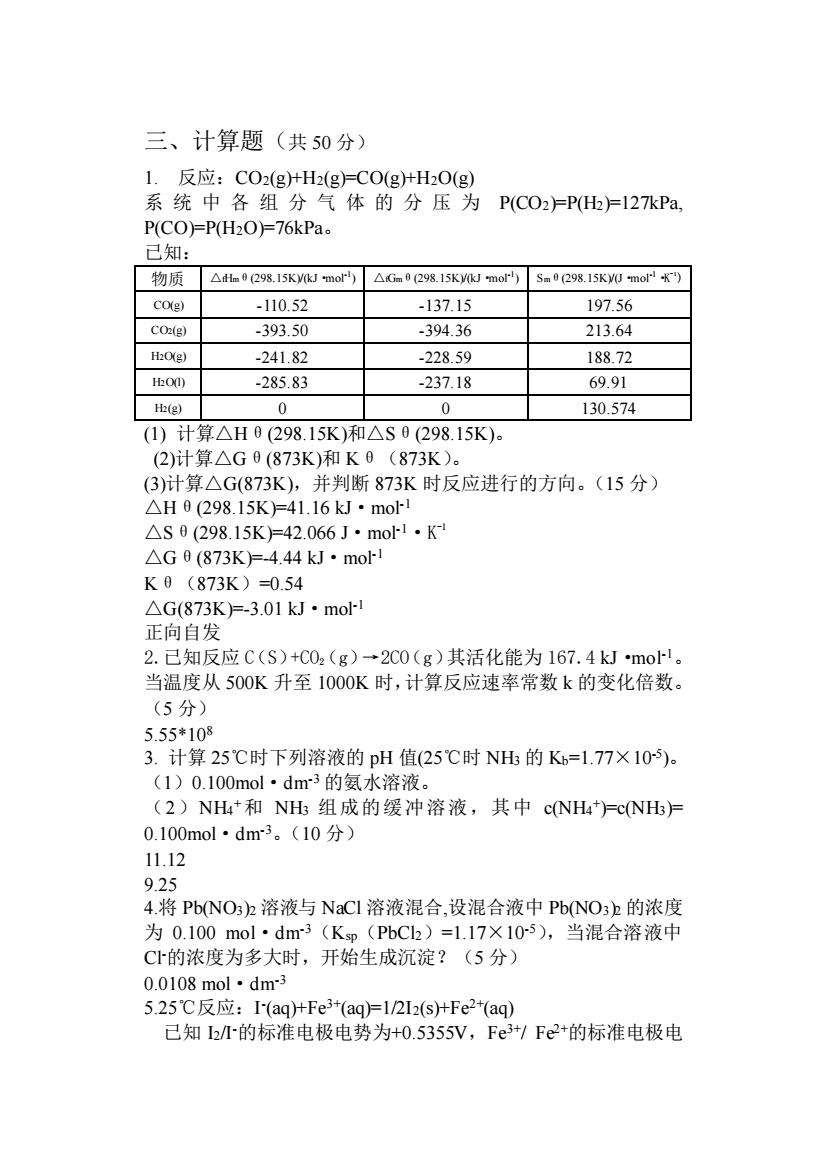
三、计算题(共50分) 1.反应:CO2(g+H2(g)=CO(g十HO(g) 系统中各组分气体的分压为PC02广P)=127kPa P(CO)=P(H2O)=76kPa 已知: 物质△h0(298.15 Ky(kJ mor)△Gm0298.15Kmor50298.15 Ky0 mo9 CO(g) -110.52 -137.15 197.56 CO(g) -393.50 -394.36 213.64 H:O(e) -241.82 .22859 188.72 O -285.83 -237.18 69.91 H(g) 0 0 130.574 (1)计算△H0(298.15K)和△S0(298.15K). (2)计算△G0(873K)和K0(873K). (3)计算△G(873K),并判断873K时反应进行的方向。(15分) △H0(298.15K)=41.16kJ·mo △S0(298.15K)=42.066J·mo1·K △G0(873K)=-4.44kJ·mol K0(873K)=054 △G(873K)=-3.01kJ·mo 正向自发 2.已知反应C(S)+C02(g)→2C0(g)其活化能为167.4kJmo1。 当温度从500K升至1000K时,计算反应速率常数k的变化倍数。 (5分) 5.55*108 3.计算25℃时下列溶液的pH值(25℃时NH的K=1.77×10)。 (1)0.100mol·dm3的氨水溶液。 (2)NH4+和NH组成的缓冲溶液,其中cNH4=cNH尸 0.100mol·dm3。(10分) 11.12 9.25 4.将Pb(NO3)2溶液与NaCI溶液混合,设混合液中PbNO3b的浓度 为0.100mol·dm3(Kp(PbC2)=1.17×10-5),当混合溶液中 C1的浓度为多大时,开始生成沉淀?(5分) 0.0108mol·dm3 5.25℃反应:I(aq)+Fe3+(aqFl2I2(stFe2+(aq) 已知h的标准电极电势为+0.5355V,Fe3/Fe2+的标准电极电
三、计算题(共 50 分) 1. 反应:CO2(g)+H2(g)=CO(g)+H2O(g) 系统中各组分气体的分压为 P(CO2)=P(H2)=127kPa, P(CO)=P(H2O)=76kPa。 已知: 物质 △fHmθ(298.15K)/(kJ·mol-1 ) △fGmθ(298.15K)/(kJ·mol-1 ) Smθ(298.15K)/(J·mol-1·K -1 ) CO(g) -110.52 -137.15 197.56 CO2(g) -393.50 -394.36 213.64 H2O(g) -241.82 -228.59 188.72 H2O(l) -285.83 -237.18 69.91 H2(g) 0 0 130.574 (1) 计算△Hθ(298.15K)和△Sθ(298.15K)。 (2)计算△Gθ(873K)和 Kθ(873K)。 (3)计算△G(873K),并判断 873K 时反应进行的方向。(15 分) △Hθ(298.15K)=41.16 kJ·mol-1 △Sθ(298.15K)=42.066 J·mol-1·K -1 △Gθ(873K)=-4.44 kJ·mol-1 Kθ(873K)=0.54 △G(873K)=-3.01 kJ·mol-1 正向自发 2.已知反应 C(S)+CO2(g)→2CO(g)其活化能为 167.4 kJ·mol-1。 当温度从 500K 升至 1000K 时,计算反应速率常数 k 的变化倍数。 (5 分) 5.55*108 3. 计算 25℃时下列溶液的 pH 值(25℃时 NH3 的 Kb=1.77×10-5 )。 (1)0.100mol·dm-3 的氨水溶液。 (2)NH4 +和 NH3 组成的缓冲溶液,其中 c(NH4 + )=c(NH3)= 0.100mol·dm-3。(10 分) 11.12 9.25 4.将 Pb(NO3)2 溶液与 NaCl 溶液混合,设混合液中 Pb(NO3)2 的浓度 为 0.100 mol·dm-3(Ksp(PbCl2)=1.17×10-5),当混合溶液中 Cl-的浓度为多大时,开始生成沉淀?(5 分) 0.0108 mol·dm-3 5.25℃反应:I - (aq)+Fe3+(aq)=1/2I2(s)+Fe2+(aq) 已知 I2/I-的标准电极电势为+0.5355V,Fe3+/ Fe2+的标准电极电

势为+0.771V,F=96485C·mol1。 (1)计算反应的标准摩尔吉布斯函数变。 (2)计算K0。 (3)当c(I)=1.0×102mol·dm3以及c(Fe3+)=c(Fe2+/10时, 判断氧化还原反应进行的方向,计算此反应组成的原电池 的电动势。(15分) -22722.2175J·mo1 9.55*103 0.05799V 正向自发
势为+0.771V,F=96485C·mol-1。 (1) 计算反应的标准摩尔吉布斯函数变。 (2) 计算 Kθ。 (3) 当 c(I- )=1.0×10-2 mol·dm-3 以及 c(Fe3+)=c(Fe2+)/10 时, 判断氧化还原反应进行的方向,计算此反应组成的原电池 的电动势。(15 分) -22722.2175 J·mol-1 9.55*103 0.05799V 正向自发