
中华人民共和国国家标准 GB4789.4—2010 食品安全国家标准 食品微生物学检验沙门氏菌检验 National food safety standard Food microbiological examination:Salmonella 2010-03-26发布 2010-06-01实施 中华人民共和国卫生部 发布
中华人民共和国国家标准 GB 4789.4—2010 食品安全国家标准 食品微生物学检验 沙门氏菌检验 National food safety standard Food microbiological examination: Salmonella 中华人民共和国卫生部 发布 2010-03-26 发布 2010-06-01 实施

GB4789.4-2010 前言 本标准代替GB/T4789.42008《食品卫生微生物学检验沙门氏菌检验》。 本标准与GB/T4789.4-2008相,主要变化如下: —一修改了标准的中英文名称: —修改了标准的范用: 一修改了培养基和试剂: 一修改了设备和材料: 一像改了附录A。 本标准的附录A、附录B为规范性附录 本标准所代替的历次版本发布情况为: GB4789.4-84、GB4789.4-1994、GB/T4789.4-2003、GB/T4789.4-2008
GB 4789.4—2010 I 前 言 本标准代替 GB/T 4789.4-2008《食品卫生微生物学检验 沙门氏菌检验》。 本标准与 GB/T 4789.4-2008 相比,主要变化如下: ——修改了标准的中英文名称; ——修改了标准的范围; ——修改了培养基和试剂; ——修改了设备和材料; ——修改了附录 A。 本标准的附录 A、附录 B 为规范性附录。 本标准所代替的历次版本发布情况为: ——GB 4789.4-84、GB 4789.4-1994、GB/T 4789.4-2003、GB/T 4789.4-2008

GB4789.4-2010 食品安全国家标准 食品微生物学检验沙门氏菌检验 1范围 本标准规定了食品中沙门氏菌(Salmonella)的检验方法 本标准适用于食品中沙门氏菌的检验。 2设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 2.1冰箱:2℃~5℃。 2.2恒温培养箱:36℃±1℃,42℃±1℃ 2.3均质器。 2.4振荡器。 2.5电子天平:感量0.1g 2.6无菌锥形瓶:容量500mL,250mL. 2.7无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。 2.8无菌培养皿:直径90mm 2.9无菌试管:3mm×50mm、10mm×75mm 2.10无南毛细管。 2.11pH计或pH比色管或精密pH试纸。 2.12全自动微生物生化鉴定系统。 3培养基和试剂 3.1缓冲蛋白胨水(BPW):见附求A中A1。 3.2四硫磺酸钠煌绿(TTB)增菌液:见附录A中A.2。 3.3亚硒酸盐胱氨酸(SC)增菌液:见附录A中A.3。 3.4亚硫酸秘(BS)琼脂:见附录A中A.4。 3.5HE琼脂:见附录A中A5。 3.6木糖赖氨酸脱氧胆盐(XLD)琼脂:见附录A中A6
GB 4789.4—2010 1 食品安全国家标准 食品微生物学检验 沙门氏菌检验 1 范围 本标准规定了食品中沙门氏菌(Salmonella)的检验方法。 本标准适用于食品中沙门氏菌的检验。 2 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 2.1 冰箱:2 ℃~5 ℃。 2.2 恒温培养箱:36 ℃±1 ℃,42 ℃±1 ℃。 2.3 均质器。 2.4 振荡器。 2.5 电子天平:感量 0.1 g。 2.6 无菌锥形瓶:容量 500 mL,250 mL。 2.7 无菌吸管:1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)或微量移液器及吸头。 2.8 无菌培养皿:直径 90 mm。 2.9 无菌试管:3 mm×50 mm、10 mm×75 mm。 2.10 无菌毛细管。 2.11 pH 计或 pH 比色管或精密 pH 试纸。 2.12 全自动微生物生化鉴定系统。 3 培养基和试剂 3.1 缓冲蛋白胨水(BPW): 见附录 A 中 A.1。 3.2 四硫磺酸钠煌绿(TTB)增菌液:见附录 A 中 A.2。 3.3 亚硒酸盐胱氨酸(SC)增菌液:见附录 A 中 A.3。 3.4 亚硫酸铋(BS)琼脂:见附录 A 中 A.4。 3.5 HE 琼脂:见附录 A 中 A.5。 3.6 木糖赖氨酸脱氧胆盐(XLD)琼脂:见附录 A 中 A.6

GB4789.4-2010 3.7沙门氏菌属显色培养基。 3.8三糖铁(TSI)琼脂:见附录A中A7。 3.9蛋白胨水、靛基质试剂:见附录A中A8。 3.10尿素琼脂(pH7.2):见附录A中A9。 3.11氯化钾(KCN)培养基:见附录A中AI0。 3.12赖氨酸脱骏酶试验培养基:见附录A中A11。 3.13糖发酵管:见附录A中A12。 3.14邻硝基酚B-D半乳糖苷(ONPG)培养基:见附录A中A.13。 3.15半固体琼脂:见附录A中A.14。 3.16丙二酸钠培养基:见附录A中A15。 3.17沙门氏茵0和H诊断血清。 3.18生化鉴定试剂盒
GB 4789.4—2010 2 3.7 沙门氏菌属显色培养基。 3.8 三糖铁(TSI)琼脂:见附录 A 中 A.7。 3.9 蛋白胨水、靛基质试剂:见附录 A 中 A.8。 3.10 尿素琼脂(pH 7.2):见附录 A 中 A.9。 3.11 氰化钾 (KCN) 培养基:见附录 A 中 A.10。 3.12 赖氨酸脱羧酶试验培养基:见附录 A 中 A.11。 3.13 糖发酵管:见附录 A 中 A.12。 3.14 邻硝基酚 β-D 半乳糖苷(ONPG)培养基:见附录 A 中 A.13。 3.15 半固体琼脂:见附录 A 中 A.14。 3.16 丙二酸钠培养基:见附录 A 中 A.15。 3.17 沙门氏菌 O 和 H 诊断血清。 3.18 生化鉴定试剂盒
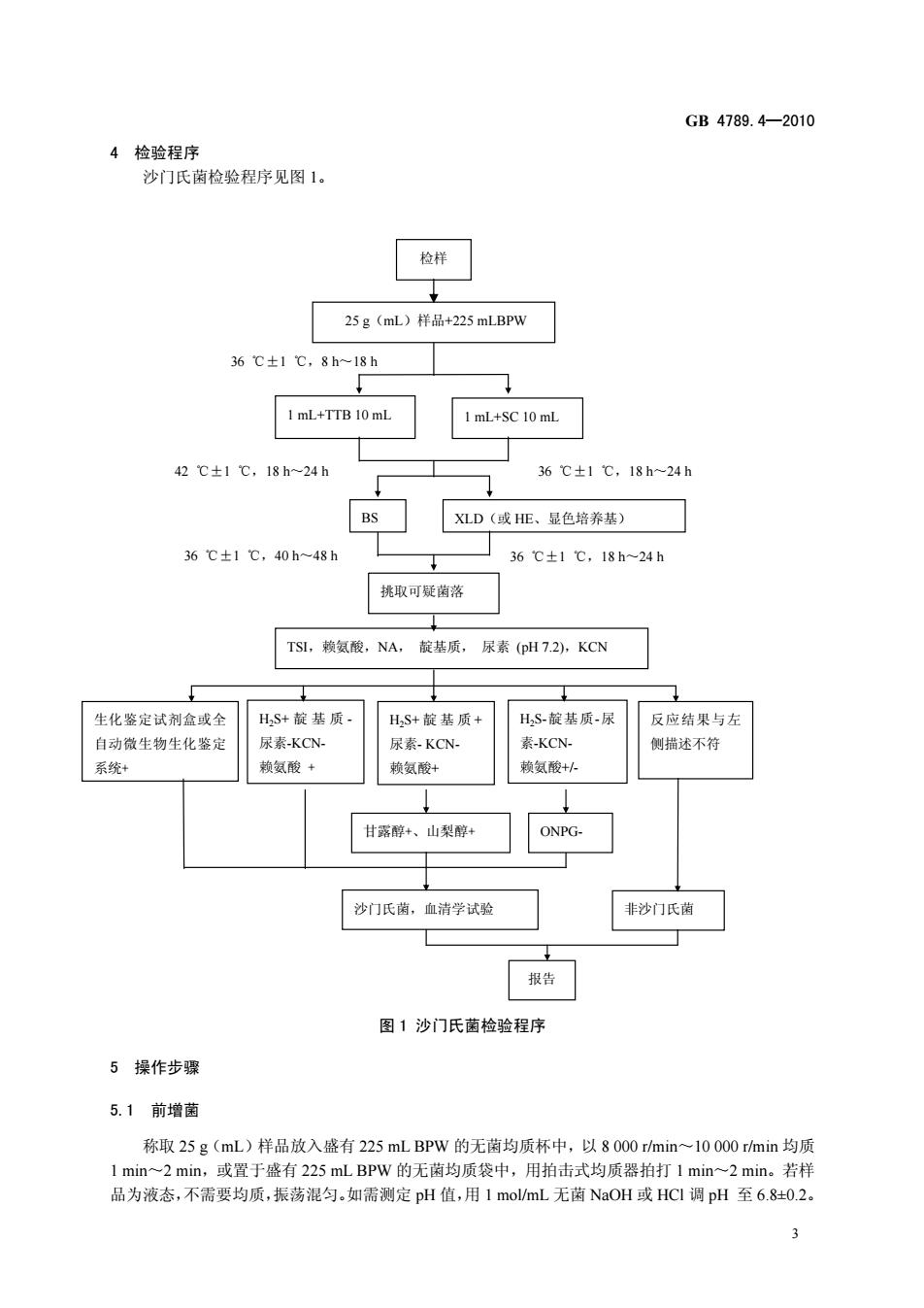
GB4789.4-2010 4检验程序 沙门氏菌检验程序见图1。 25g(mL)样品+225 mLBPW 36℃±1℃,8h~18h 1 mL+TTB 10 mL ImL+SC 10 mL 42℃±1℃,18h~24h 36℃±1℃,18h24 BS XLD(或HE、显色培养基) 36℃±1℃,40h-48h 36℃±1℃,18h~24h 挑取可疑菌落 TSL,赖氨酸,NA,靛基质,尿素(pH7.2),KCN 生化鉴定试剂盒或全 H,S+靛基质 HS+靛基质+ HS靛基质尿 反应结果与左 自动微生物生化鉴定 尿素-KCN- 尿素KCN 素-KCN. 侧描述不符 系统+ 赖氨酸+ 赖氨酸+ 赖氨酸+人 甘露醇+、山梨醇 ONPG- 沙门氏菌,血清学试验 非沙门氏菌 报告 图1沙门氏菌检验程序 5操作步骤 5.1前增菌 称取25g(mL)样品放入盛有225 mLBPW的无菌均质杯中,以8000rmin~10000rmin均质 2mn,或置于盛有25 mL BPW的无均质袋中,用拍击式均质器拍打1mm~2min,若样 昌为液态,不害爽巧底,表话程,如赛测定p值,用1oL无酒No我@调p至6O2 3
GB 4789.4—2010 3 4 检验程序 沙门氏菌检验程序见图 1。 图 1 沙门氏菌检验程序 5 操作步骤 5.1 前增菌 称取 25 g(mL)样品放入盛有 225 mL BPW 的无菌均质杯中,以 8 000 r/min~10 000 r/min 均质 1 min~2 min,或置于盛有 225 mL BPW 的无菌均质袋中,用拍击式均质器拍打 1 min~2 min。若样 品为液态,不需要均质,振荡混匀。如需测定 pH 值,用 1 mol/mL 无菌 NaOH 或 HCl 调 pH 至 6.8±0.2。 检样 36 ℃±1 ℃,8 h~18 h TSI,赖氨酸,NA, 靛基质, 尿素 (pH 7.2),KCN 挑取可疑菌落 BS XLD(或 HE、显色培养基) 1 mL+TTB 10 mL 1 mL+SC 10 mL 25 g(mL)样品+225 mLBPW H2S+ 靛基质 - 尿素-KCN- 赖氨酸 + H2S+ 靛基质 + 尿素- KCN- 赖氨酸+ H2S-靛基质-尿 素-KCN- 赖氨酸+/- 反应结果与左 侧描述不符 生化鉴定试剂盒或全 自动微生物生化鉴定 系统+ 42 ℃±1 ℃,18 h~24 h 36 ℃±1 ℃,18 h~24 h 36 ℃±1 ℃,40 h~48 h 36 ℃±1 ℃,18 h~24 h 甘露醇+、山梨醇+ ONPG- 报告 沙门氏菌,血清学试验 非沙门氏菌
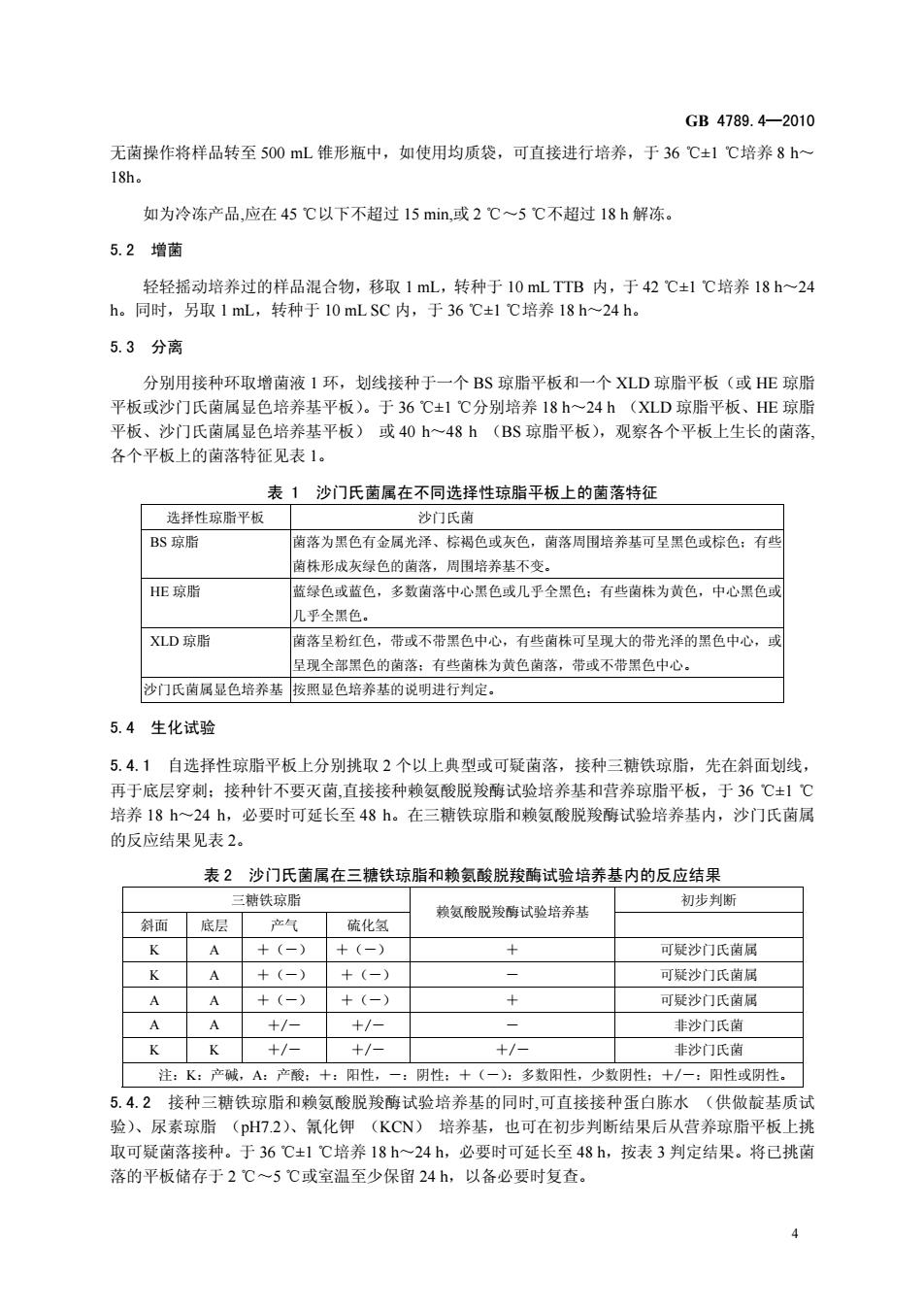
GB4789.4-2010 无菌操作将样品转至500mL锥形瓶中,如使用均质袋,可直接进行培养,于36C±!℃培养8h~ 18h。 如为冷冻产品,应在45℃以下不超过15min,或2℃一5℃不超过18h解冻。 5.2增菌 轻轻摇动培养过的样品混合物,移取1mL,转种于10 mLTTB内,于42℃±1℃培养18h一24 h。同时,另取1mL,转种于10mLSC内,于36℃±1℃培养18h~24h. 5.3分离 分别用接种环取增南液1环,划线接种于一个BS琼脂平板和一个XLD琼脂平板(或HE琼脂 平板或沙门氏菌属显色培养基平板)。于36℃±1℃分别培养18h~24h(X1D琼 、HE琼脂 平板、沙门氏茵属显色培养基平板)或40h~48h(BS琼脂平板),观察各个平板上生长的菌落。 各个平板上的菌落特征见表1。 表1沙门氏菌属在不同选择性琼脂平板上的菌落特征 选择性琼脂平板 少门氏菌 BS琼脂 南落为黑色有金属光泽、棕褐色或灰色,菌落周围培养基可呈黑色或棕色:有些 菌株形成灰绿色的菌落,周围培养基不变。 HE琼脂 蓝绿色或蓝色,多数南落中心黑色或几乎全黑色:有些黄株为黄色,中心黑色或 机平全里佰 XLD琼脂 菌落星粉红色,带或不带黑色中心,有些菌株可孕现大的带光泽的黑色中心,或 呈现全部黑色的菌落:有些菌株为黄色菌落,带或不带黑色中心, 沙门氏菌属显色培养基按照显色培养基的说明进行判定。 5.4生化试验 5.4.1自选择性琼脂平板上分别挑取2个以上典型或可疑菌落,接种三糖铁琼脂,先在斜面划线 再于底层穿刺:接种针不要灭菌,直接接种赖氨酸脱羧酶试验培养基和营养琼脂平板,于36℃±1℃ 培养18h~24h,必要时可延长至48h。在三糖铁球脂和赖氨酸脱羧酶试验培养基内,沙门氏菌属 的反应结果见表2 表2沙门氏菌属在三糖铁琼脂和赖氨酸脱羧酶试验培养基内的反应结果 三糖铁琼脂 赖氨酸脱羧南试验培养基 初步判断 斜面底层 产气 硫化氢 可疑沙门氏菌属 A 十(一 +(一 可疑沙门氏南屈 A A +(一) +(一) + 可疑沙门氏南属 +/- 非沙门氏 +1 非沙门氏菌 注:K:产碱,A:产酸:十:阳性,一:阴性:十(一):多数阳性,少数阴性:十/一:阳性或阴性。 5.4.2接种三糖铁琼脂和赖氨酸脱羧酶试验培养基的同时,可直接接种蛋白胨水(供做靛基质试 验)、尿素琼脂(pH7.2)、氰化钾(KCN)培养基,也可在初步判断结果后从营养琼脂平板上挑 取可疑菌落接种。于36℃±1℃培养18h~24h,必要时可延长至48h,按表3判定结果。将已挑菌 落的平板储存于2℃~5℃或室温至少保留24h,以备必要时复查
GB 4789.4—2010 4 无菌操作将样品转至 500 mL 锥形瓶中,如使用均质袋,可直接进行培养,于 36 ℃±1 ℃培养 8 h~ 18h。 如为冷冻产品,应在 45 ℃以下不超过 15 min,或 2 ℃~5 ℃不超过 18 h 解冻。 5.2 增菌 轻轻摇动培养过的样品混合物,移取 1 mL,转种于 10 mL TTB 内,于 42 ℃±1 ℃培养 18 h~24 h。同时,另取 1 mL,转种于 10 mL SC 内,于 36 ℃±1 ℃培养 18 h~24 h。 5.3 分离 分别用接种环取增菌液 1 环,划线接种于一个 BS 琼脂平板和一个 XLD 琼脂平板(或 HE 琼脂 平板或沙门氏菌属显色培养基平板)。于 36 ℃±1 ℃分别培养 18 h~24 h (XLD 琼脂平板、HE 琼脂 平板、沙门氏菌属显色培养基平板) 或 40 h~48 h (BS 琼脂平板),观察各个平板上生长的菌落, 各个平板上的菌落特征见表 1。 表 1 沙门氏菌属在不同选择性琼脂平板上的菌落特征 选择性琼脂平板 沙门氏菌 BS 琼脂 菌落为黑色有金属光泽、棕褐色或灰色,菌落周围培养基可呈黑色或棕色;有些 菌株形成灰绿色的菌落,周围培养基不变。 HE 琼脂 蓝绿色或蓝色,多数菌落中心黑色或几乎全黑色;有些菌株为黄色,中心黑色或 几乎全黑色。 XLD 琼脂 菌落呈粉红色,带或不带黑色中心,有些菌株可呈现大的带光泽的黑色中心,或 呈现全部黑色的菌落;有些菌株为黄色菌落,带或不带黑色中心。 沙门氏菌属显色培养基 按照显色培养基的说明进行判定。 5.4 生化试验 5.4.1 自选择性琼脂平板上分别挑取 2 个以上典型或可疑菌落,接种三糖铁琼脂,先在斜面划线, 再于底层穿刺;接种针不要灭菌,直接接种赖氨酸脱羧酶试验培养基和营养琼脂平板,于 36 ℃±1 ℃ 培养 18 h~24 h,必要时可延长至 48 h。在三糖铁琼脂和赖氨酸脱羧酶试验培养基内,沙门氏菌属 的反应结果见表 2。 表 2 沙门氏菌属在三糖铁琼脂和赖氨酸脱羧酶试验培养基内的反应结果 三糖铁琼脂 初步判断 斜面 底层 产气 硫化氢 赖氨酸脱羧酶试验培养基 K A +(-) +(-) + 可疑沙门氏菌属 K A +(-) +(-) - 可疑沙门氏菌属 A A +(-) +(-) + 可疑沙门氏菌属 A A +/- +/- - 非沙门氏菌 K K +/- +/- +/- 非沙门氏菌 注:K:产碱,A:产酸;+:阳性,-:阴性;+(-):多数阳性,少数阴性;+/-:阳性或阴性。 5.4.2 接种三糖铁琼脂和赖氨酸脱羧酶试验培养基的同时,可直接接种蛋白胨水 (供做靛基质试 验)、尿素琼脂 (pH7.2)、氰化钾 (KCN) 培养基,也可在初步判断结果后从营养琼脂平板上挑 取可疑菌落接种。于 36 ℃±1 ℃培养 18 h~24 h,必要时可延长至 48 h,按表 3 判定结果。将已挑菌 落的平板储存于 2 ℃~5 ℃或室温至少保留 24 h,以备必要时复查
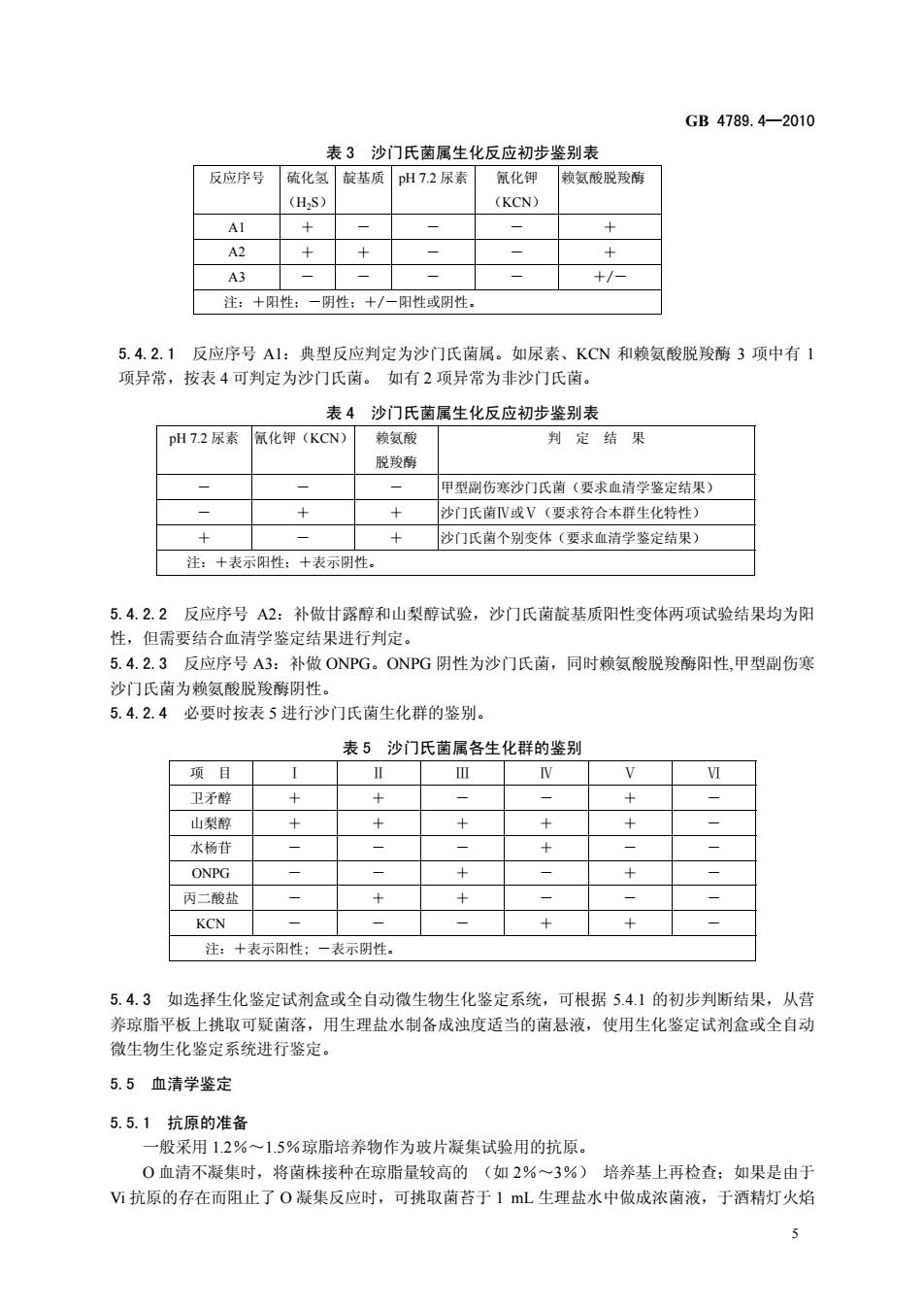
GB4789.4-2010 表3沙门氏菌属生化反应初步鉴别表 反应序号硫化氢靛基质H72尿素氧化钾 款氨酸脱羧酸 (HS) (KCN) A2 十 A3 +/ 注:+阳性:一阴性:+/一闲性或阴性。 5.4.2.1反应序号A1:典型反应判定为沙门氏茵属。如尿素、KCN和赖氨酸脱羧酶3项中有1 项异常,按表4可判定为沙门氏菌。如有2项异常为非沙门氏菌。 表4沙门氏菌属生化反应初步鉴别表 H72尿素化钾(KCN) 判定结果 脱 甲型副伤寒沙门氏菌(要求血清学鉴定结果》 + 沙门氏菌V或V(要求符合本群生化特性) 沙门氏菌个别变体(要求血清学鉴定结果) 注:十表示阳性:+表示阴性。 5.4.2.2反应序号A2:补做甘露醇和山梨醇试验,沙门氏茵靛基质阳性变体两项试验结果均为阳 性,但需要结合血清学鉴定结果进行判定, 5.4.2.3反应序号A3:补做ONPG。ONPG阴性为沙门氏菌,同时赖氨酸脱羧酶阳性,甲型副伤寒 沙门氏菌为赖氨酸脱羧酶阴性。 5.4.2.4必要时按表5进行沙门氏南生化群的鉴别。 表5沙门氏菌属各生化群的鉴别 项目 卫矛醇 型醇 水杨苷 ONPG 丙二酸盐 KCN 注:十表示阳性:一表示性。 5.4.3如选择生化鉴定试剂盒或全自动微生物生化鉴定系统,可根据5.4.1的初步判断结果,从营 养琼脂平板上挑取可疑茵落,用生理盐水制备成浊度适当的菌悬液,使用生化鉴定试剂盒或全自动 微生物生化鉴定系统进行鉴定 5.5血清学鉴定 5.5.1抗原的准备 一般采用1.2%~1.5%琼脂培养物作为玻片凝集试验用的抗原。 0血清不凝集时,将菌株接种在琼脂量较高的(如2%一3%) 培养基上再检查:如果是由于 抗原的存在而阻止了O凝集反应时,可挑取菌苔于1mL生理盐水中做成浓菌液,于酒精灯火焰
GB 4789.4—2010 5 表 3 沙门氏菌属生化反应初步鉴别表 反应序号 硫化氢 (H2S) 靛基质 pH 7.2 尿素 氰化钾 (KCN) 赖氨酸脱羧酶 A1 + - - - + A2 + + - - + A3 - - - - +/- 注:+阳性;-阴性;+/-阳性或阴性。 5.4.2.1 反应序号 A1:典型反应判定为沙门氏菌属。如尿素、KCN 和赖氨酸脱羧酶 3 项中有 1 项异常,按表 4 可判定为沙门氏菌。 如有 2 项异常为非沙门氏菌。 表 4 沙门氏菌属生化反应初步鉴别表 pH 7.2 尿素 氰化钾(KCN) 赖氨酸 脱羧酶 判 定 结 果 - - - 甲型副伤寒沙门氏菌(要求血清学鉴定结果) - + + 沙门氏菌Ⅳ或Ⅴ(要求符合本群生化特性) + - + 沙门氏菌个别变体(要求血清学鉴定结果) 注:+表示阳性;+表示阴性。 5.4.2.2 反应序号 A2:补做甘露醇和山梨醇试验,沙门氏菌靛基质阳性变体两项试验结果均为阳 性,但需要结合血清学鉴定结果进行判定。 5.4.2.3 反应序号 A3:补做 ONPG。ONPG 阴性为沙门氏菌,同时赖氨酸脱羧酶阳性,甲型副伤寒 沙门氏菌为赖氨酸脱羧酶阴性。 5.4.2.4 必要时按表 5 进行沙门氏菌生化群的鉴别。 表 5 沙门氏菌属各生化群的鉴别 项 目 Ⅰ Ⅱ Ⅲ Ⅳ Ⅴ Ⅵ 卫矛醇 + + - - + - 山梨醇 + + + + + - 水杨苷 - - - + - - ONPG - - + - + - 丙二酸盐 - + + - - - KCN - - - + + - 注:+表示阳性; -表示阴性。 5.4.3 如选择生化鉴定试剂盒或全自动微生物生化鉴定系统,可根据 5.4.1 的初步判断结果,从营 养琼脂平板上挑取可疑菌落,用生理盐水制备成浊度适当的菌悬液,使用生化鉴定试剂盒或全自动 微生物生化鉴定系统进行鉴定。 5.5 血清学鉴定 5.5.1 抗原的准备 一般采用 1.2%~1.5%琼脂培养物作为玻片凝集试验用的抗原。 O 血清不凝集时,将菌株接种在琼脂量较高的 (如 2%~3%) 培养基上再检查;如果是由于 Vi 抗原的存在而阻止了 O 凝集反应时,可挑取菌苔于 1 mL 生理盐水中做成浓菌液,于酒精灯火焰

GB4789.4-2010 上煮沸后再检查。H抗原发有不良时,将菌株接种在0.55%~0.65%半固体琼脂平板的中央,俟菌落 蔓延生长时,在其边缘部分取菌检查:或将菌株通过装有0.3%~0.4%半固体琼脂的小玻管1次一2 次,自远端取茵培养后再拾查 5.5.2多价菌体抗原(0)鉴定 在玻片上划出2个约1cm×2cm的区域,挑取1环待测菌,各放12环于玻片上的每一区域上 部,在其中一个区域下部加1滴多价菌体(O)抗血清,在另一区域下部加入1滴生理盐水,作为对 照。再用无菌的接种环或针分别将两个区域内的茵落研成乳状液。将玻片倾斜摇动混合1mi,并对 者黑暗背景进行观察,任何程度的凝集现象皆为阳性反应。 5.5.3多价鞭毛抗原(H)鉴定 同5.52。 5.5.4血洁学分型(选做项目】 5.5.4.10抗原的鉴定 用A~F多价0血清做玻片凝集试验,同时用生理盐水做对照。在生理盐水中自凝者为粗糙形 菌株,不能分型。 被AP多价0血清凝集者,依次用O4:O3、010:07:O8:O9:O2和O11因子血清做凝里 试验。根据试验结果,判定0群。被O3、010血清凝集的菌株,再用010、O15、034、O19单因 子血清做凝集试验,判定E1、E2、E3、E4各亚群,每 一个0抗原成分的最后确定均应根据0单因 子血清的检查结果,没有O单因子血清的要用两个O复合因子血清进行核对。 不被A一F多价O血清凝集者,先用9种多价O血清检查,如有其中一种血清凝集,测用这种 血清所包括的0群血清逐一检查,以确定0群。每种多价0血清所包括的0因子如下: 0老份 A,B,C,D,E,E,群 (并包括6,14群 0多价213,16,17,18,21群 0多价328,30,35,38,39群 0多价440,41,42,43群 0多价5 44,45,47,48看 0多价650,51,52,53群 0多价755,56,57,58群 0多价859,60.61,62群 0多价9 63,65,66,67群 5.5.4.2H抗原的鉴定 属于A~F各0群的常见菌型,依次用表6所述H因子血清检查第1相和第2相的H抗原。 表6A一F群常见菌型H抗原表 0群 第1相 第2相 B gfs B ibd CI k.vrc 5z15 2 D(不产气的 D(产气的》 8.m.p.q 无无 h.v 6.x E4 g.st 无 E4
GB 4789.4—2010 6 上煮沸后再检查。H 抗原发育不良时,将菌株接种在 0.55%~0.65%半固体琼脂平板的中央,俟菌落 蔓延生长时,在其边缘部分取菌检查;或将菌株通过装有 0.3%~0.4%半固体琼脂的小玻管 1 次~2 次,自远端取菌培养后再检查。 5.5.2 多价菌体抗原(O)鉴定 在玻片上划出 2 个约 1 cm×2 cm 的区域,挑取 1 环待测菌,各放 1/2 环于玻片上的每一区域上 部,在其中一个区域下部加 1 滴多价菌体(O)抗血清,在另一区域下部加入 1 滴生理盐水,作为对 照。再用无菌的接种环或针分别将两个区域内的菌落研成乳状液。将玻片倾斜摇动混合 1 min,并对 着黑暗背景进行观察,任何程度的凝集现象皆为阳性反应。 5.5.3 多价鞭毛抗原(H)鉴定 同 5.5.2。 5.5.4 血清学分型(选做项目) 5.5.4.1 O 抗原的鉴定 用 A~F 多价 O 血清做玻片凝集试验,同时用生理盐水做对照。在生理盐水中自凝者为粗糙形 菌株,不能分型。 被 A~F 多价 O 血清凝集者,依次用 O4;O3、O10;O7;O8;O9;O2 和 O11 因子血清做凝集 试验。根据试验结果,判定 O 群。被 O3、O10 血清凝集的菌株,再用 O10、O15、O34、O19 单因 子血清做凝集试验,判定 E1、E2、E3、E4 各亚群,每一个 O 抗原成分的最后确定均应根据 O 单因 子血清的检查结果,没有 O 单因子血清的要用两个 O 复合因子血清进行核对。 不被 A~F 多价 O 血清凝集者,先用 9 种多价 O 血清检查,如有其中一种血清凝集,则用这种 血清所包括的 O 群血清逐一检查,以确定 O 群。每种多价 O 血清所包括的 O 因子如下: O 多价 1 A,B,C,D,E,F,群 (并包括 6,14 群) O 多价 2 13,16,17,18,21 群 O 多价 3 28,30,35,38,39 群 O 多价 4 40,41,42,43 群 O 多价 5 44,45,47,48 群 O 多价 6 50,51,52,53 群 O 多价 7 55,56,57,58 群 O 多价 8 59,60,61,62 群 O 多价 9 63,65,66,67 群 5.5.4.2 H 抗原的鉴定 属于 A~F 各 O 群的常见菌型,依次用表 6 所述 H 因子血清检查第 1 相和第 2 相的 H 抗原。 表 6 A~F 群常见菌型 H 抗原表 O 群 第 1 相 第 2 相 A B B C1 C2 D( 不产气的) D(产气的) E1 E4 E4 a g,f,s i,b,d k,v,r,c b,d,r d g,m,p,q h,v g,s,t i 无 无 2 5,z15 2,5 无 无 6,w,x 无

GB4789.4-2010 不常见的南型,先用8种多价H血清检查,如有其中一种或两种血清凝集,则再用这一种或两种 血清所包括的各种H因子血清逐一检查,以第1相和第2项的H抗原。8种多价H血清所包括的H 因子如下: H多价1 a,b.c,d.i H多价2 eh,enx,enzis,fg,gms,gpu,gp,gq,mt,gzs H多价3kr,y,z,Z0,w,w,lz3,2g,lZ4o H多价41,2:1,5:1,6:1,7:26 H多价5 7423742247422729235,736Z3w H多价6 Z39,Z41,Z42,Z44 H多价7Z5,Z53,Z4,Z55 H多价8Z5,Z1,Z0,Z1,Z 每一个H抗原成分的最后确定均应根据H单因子血清的检查结果,没有H单因子血清的要用两 个H复合因子血清进行核对 检出第1相H抗原而未检出第2相H抗原的或检出第2相H抗原而未检出第1相H抗原的,可 在琼脂斜面上移种1一2代后再检查。如仍只检出一个相的H抗原,要用位相变异的方法检查其另一 个相。单相菌不必做位相弯异拾查 位相变异试验方法如下: 小玻管法:将半固体管(每管约1L-2L)在西精灯上溶化并冷至50℃,取已知相的H 因子血清0.05mL~0.1mL,加入于溶化的半固体内,混匀后,用毛细吸管吸取分装于供位相变异试 验的小玻管内,俟凝固后,用接种针挑取待检菌,接种于 一端。将小玻管平放在平皿内,并在其旁 团湿棉花, 防琼脂中水分蒸发 而 每天检查结果,待另 相细菌解 离后 可以从 挑取细菌进行检查。培养基内血清的浓度应有适当的比例,过高时细菌不能生长,过低时同一相细 菌的动力不能抑制。一般按原血清1:200~1:800的量加入。 小倒管法:将两瑞开口的小玻管(下端开口要留一个缺口,不要平齐)放在半固体管内小玻 管的上端应高出于培养基的表面, 灭菌后备用。临用时在酒精灯上加热溶化,冷至50℃, 挑取因子 血清1环,加入小套管中的半固体内,略加搅动,使其混匀,俟凝固后,将待检南株接种于小套管 中的半固体表层内,每天检查结果,待另一相细菌解离后,可从套管外的半固体表面取菌检查,或 转种1%软琼脂斜面,于37℃培养后再做凝集试验。 简易平板法 将0.35%~0.4%半周体琼脂平板烘干表面水分,挑取因子血清1环,滴在半周体 平板表面,放置片刻,待血清吸收到琼脂内,在血清部位的中央点种待检菌株,培养后,在形成蔓 延生长的菌苔边缘取菌检查。 5.5.4.3Vi抗原的鉴定 用因子血清检查。已知具有V抗原的菌型有:伤寒沙门氏菌,丙型副剧伤寒沙门氏菌,都柏林 沙门氏菌。 5.5.4.4菌型的判定 根据血清学分型鉴定的结果,按照附录B或有关沙门氏菌属抗原表判定菌型。 6结果与报告 综合以上生化试验和血清学鉴定的结果,报告25g(mL)样品中检出或未检出沙门氏菌
GB 4789.4—2010 7 不常见的菌型,先用 8 种多价 H 血清检查,如有其中一种或两种血清凝集,则再用这一种或两种 血清所包括的各种 H 因子血清逐一检查,以第 1 相和第 2 项的 H 抗原。8 种多价 H 血清所包括的 H 因子如下: H 多价 1 a,b,c,d,i H 多价 2 eh,enx,enz15,fg,gms,gpu,gp,gq,mt,gz51 H 多价 3 k,r,y,z,z10,lv,lw,lz13,lz28,lz40 H 多价 4 1,2;1,5;1,6;1,7;z6 H 多价 5 z4z23,z4z24,z4z32,z29,z35,z36,z38 H 多价 6 z39,z41,z42,z44 H 多价 7 z52,z53,z54,z55 H 多价 8 z56,z57,z60,z61,z62 每一个 H 抗原成分的最后确定均应根据 H 单因子血清的检查结果,没有 H 单因子血清的要用两 个 H 复合因子血清进行核对。 检出第 1 相 H 抗原而未检出第 2 相 H 抗原的或检出第 2 相 H 抗原而未检出第 1 相 H 抗原的,可 在琼脂斜面上移种 1~2 代后再检查。如仍只检出一个相的 H 抗原,要用位相变异的方法检查其另一 个相。单相菌不必做位相变异检查。 位相变异试验方法如下: 小玻管法: 将半固体管(每管约 1 mL~2 mL) 在酒精灯上溶化并冷至 50 ℃,取已知相的 H 因子血清 0.05 mL~0.1 mL,加入于溶化的半固体内,混匀后,用毛细吸管吸取分装于供位相变异试 验的小玻管内,俟凝固后,用接种针挑取待检菌,接种于一端。将小玻管平放在平皿内,并在其旁 放一团湿棉花,以防琼脂中水分蒸发而干缩,每天检查结果,待另一相细菌解离后,可以从另一端 挑取细菌进行检查。培养基内血清的浓度应有适当的比例,过高时细菌不能生长,过低时同一相细 菌的动力不能抑制。一般按原血清 1:200~1:800 的量加入。 小倒管法:将两端开口的小玻管 (下端开口要留一个缺口,不要平齐) 放在半固体管内,小玻 管的上端应高出于培养基的表面,灭菌后备用。临用时在酒精灯上加热溶化,冷至 50 ℃,挑取因子 血清 1 环,加入小套管中的半固体内,略加搅动,使其混匀,俟凝固后,将待检菌株接种于小套管 中的半固体表层内,每天检查结果,待另一相细菌解离后,可从套管外的半固体表面取菌检查,或 转种 1%软琼脂斜面,于 37 ℃培养后再做凝集试验。 简易平板法:将 0.35%~0.4%半固体琼脂平板烘干表面水分,挑取因子血清 1 环,滴在半固体 平板表面,放置片刻,待血清吸收到琼脂内,在血清部位的中央点种待检菌株,培养后,在形成蔓 延生长的菌苔边缘取菌检查。 5.5.4.3 Vi 抗原的鉴定 用 Vi 因子血清检查。已知具有 Vi 抗原的菌型有:伤寒沙门氏菌,丙型副伤寒沙门氏菌,都柏林 沙门氏菌。 5.5.4.4 菌型的判定 根据血清学分型鉴定的结果,按照附录 B 或有关沙门氏菌属抗原表判定菌型。 6 结果与报告 综合以上生化试验和血清学鉴定的结果,报告25 g(mL)样品中检出或未检出沙门氏菌

GB4789.4-2010 附录A (规范性附录) 培养基和试剂 A.1缓冲蛋白胨水(BPW) A.1.1成分 蛋白胨 10.0g 氯化钠 5.0g 磷酸氢二钠(含12个结品水) 9.0g 磷酸二氢钾 1.5g 蒸馏水 1000ml plH7.240.2 A.1.2制法 将各成分加入蒸馏水中,搅混均匀,静置约10min,煮沸溶解,调节pH,高压灭菌121℃,15 min. A2四硫磺酸钠煌绿(TTB)增菌液 A.2.1基础液 蛋白陈 10.0g 牛肉音 5.0g 氯化钠 30g 碳酸钙 45.0g 蒸留水 1000mL pH7.040.2 除碳酸钙外,将各成分加入蒸馏水中,煮沸溶解,再加入碳酸钙,调节pH,高压灭菌121℃, 20 min. A2.2硫代硫酸钠溶液 硫代硫酸钠(含5个结晶水》 50.0g 蒸馏水 加至100mL 高压灭菌121℃,20min A.2.3碘溶液 碘片 20.0g 碘化钾 25.0g 蒸馏水 加至100mL 将碘化钾充分溶解于少量的蒸馏水中,再投入碘片,振摇玻瓶至碘片全部溶解为止,然后加蒸 馏水至规定的总量 贮存于棕色瓶内,塞紧瓶盖备用。 A.2.40.5%煌绿水溶 煌绿 0.5g 蒸馏水 100mL 溶解后,存放暗处,不少于1d,使其自然灭南。 A.2.5牛胆盐溶液 牛胆盐 10.0g
GB 4789.4—2010 8 附录A (规范性附录) 培养基和试剂 A.1 缓冲蛋白胨水(BPW) A.1.1 成分 蛋白胨 10.0 g 氯化钠 5.0 g 磷酸氢二钠(含 12 个结晶水) 9.0 g 磷酸二氢钾 1.5 g 蒸馏水 1 000 mL pH 7.2±0.2 A.1.2 制法 将各成分加入蒸馏水中,搅混均匀,静置约 10 min,煮沸溶解,调节 pH,高压灭菌 121 ℃,15 min。 A.2 四硫磺酸钠煌绿(TTB)增菌液 A.2.1 基础液 蛋白胨 10.0 g 牛肉膏 5.0 g 氯化钠 3.0 g 碳酸钙 45.0 g 蒸馏水 1 000 mL pH 7.0±0.2 除碳酸钙外,将各成分加入蒸馏水中,煮沸溶解,再加入碳酸钙,调节 pH,高压灭菌 121 ℃, 20 min。 A.2.2 硫代硫酸钠溶液 硫代硫酸钠(含 5 个结晶水) 50.0 g 蒸馏水 加至 100 mL 高压灭菌 121 ℃,20 min。 A.2.3 碘溶液 碘 片 20.0 g 碘化钾 25.0 g 蒸馏水 加至 100 mL 将碘化钾充分溶解于少量的蒸馏水中,再投入碘片,振摇玻瓶至碘片全部溶解为止,然后加蒸 馏水至规定的总量,贮存于棕色瓶内,塞紧瓶盖备用。 A.2.4 0.5%煌绿水溶液 煌绿 0.5 g 蒸馏水 100 mL 溶解后,存放暗处,不少于 1d,使其自然灭菌。 A.2.5 牛胆盐溶液 牛胆盐 10.0 g