
中华人民共和国国家标准 GB4789.10-2010 食品安全国家标准 食品微生物学检验金黄色葡萄球菌检验 National food safety standard Food microbiological examination:Staphylococcus aureu 2010-03-26发布 2010-06-01实施 中华人民共和国卫生部发布
中华人民共和国国家标准 GB 4789.10—2010 食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验 National food safety standard Food microbiological examination: Staphylococcus aureus 中华人民共和国卫生部 发布 2010-03-26 发布 2010-06-01 实施

GB4789.10-2010 前言 本标准代替GB/T4789.10-2008《食品卫生微生物学检验金黄色葡萄球菌检验》和 GB/T4789.37-2008《食品卫生微生物学检验金黄色葡萄球菌计数). 本标准与GB/T4789.10-2008和GB/T4789.37-2008相比,主要修改如下: 一修改了标准的中英文名称: 一修改了范围: 一规范了样品制备过程 一增加了计算公式中系数1.1的解释: -修改了附录A中胰酪胨大豆肉汤的名称,规范为10%氯化钠胰酪胨大豆肉汤: 一增加了第二法金黄色荷萄球菌Baird--Parker平板计数和第三法金黄色简萄球菌MPN计数。 本标准的附录A、附录B、附录C是规范性附录。 本标准所代替标准的历次版本发布情况为: GB4789.10-84、GB4789.10-1994、GB/T4789.10-2003、GB/T4789.10-2008。 GB/T4789.37-2008
GB 4789.10—2010 I 前 言 本标准代替 GB/T 4789.10-2008《食品卫生微生物学检验 金黄色葡萄球菌检验》和 GB/T 4789.37-2008《食品卫生微生物学检验 金黄色葡萄球菌计数》。 本标准与 GB/T 4789.10-2008 和 GB/T 4789.37-2008 相比,主要修改如下: ——修改了标准的中英文名称; ——修改了范围; ——规范了样品制备过程; ——增加了计算公式中系数 1.1 的解释; ——修改了附录 A 中胰酪胨大豆肉汤的名称,规范为 10%氯化钠胰酪胨大豆肉汤; ——增加了第二法金黄色葡萄球菌 Baird-Parker 平板计数和第三法金黄色葡萄球菌 MPN 计数。 本标准的附录 A、附录 B、附录 C 是规范性附录。 本标准所代替标准的历次版本发布情况为: ——GB 4789.10-84、GB 4789.10-1994、GB/T 4789.10-2003、GB/T 4789.10-2008。 ——GB/T 4789.37-2008

GB4789.10-2010 食品安全国家标准 食品微生物学检验金黄色葡萄球菌检验 1范围 本标准规定了食品中金黄色葡萄球菌(Sap咖lococcus aureus)的检验方法。 本标准第一法适用于食品中金黄色葡萄球菌的定性检验:第二法适用于金黄色葡萄球菌含量较高的 食品中金黄色葡萄球菌的计数:第三法适用于金黄色葡萄球菌含量较低而杂菌含量较高的食品中金黄色 葡萄球菌的计数。 2设备和材料 除微生物实验室常规灭南及培养设备外,其他设备和材料如下: 2.1恒温培养箱:36℃±1℃ 2.2冰箱:2℃一5℃。 2.3恒温水浴箱:37℃~65℃。 2.4天平:感量0.1g 2.5均质器。 2.6振荡器。 2.7无菌吸管:1mL(具0.01mL刻度)、10ml(具0.1mL刻度)或微量移液器及吸头。 2.8无菌锥形瓶:容量100mL、500mL。 2.9无菌培养皿:直径90mm。 2.10注射器:0.5mL。 2.11pH计或pH比色管或精密pH试纸 3培养基和试剂 3.110%氯化钠胰酪陈大豆肉汤:见附录A中A1。 3.27.5%氯化钠肉汤:见附录A中A2。 3.3血琼脂平板:见附录A中A3。 3.4 Baird-Parker琼脂平板:见附录A中A.4
GB 4789.10—2010 1 食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验 1 范围 本标准规定了食品中金黄色葡萄球菌(Staphylococcus aureus)的检验方法。 本标准第一法适用于食品中金黄色葡萄球菌的定性检验;第二法适用于金黄色葡萄球菌含量较高的 食品中金黄色葡萄球菌的计数;第三法适用于金黄色葡萄球菌含量较低而杂菌含量较高的食品中金黄色 葡萄球菌的计数。 2 设备和材料 除微生物实验室常规灭菌及培养设备外,其他设备和材料如下: 2.1 恒温培养箱:36 ℃±1 ℃。 2.2 冰箱:2 ℃~5 ℃。 2.3 恒温水浴箱:37 ℃~65 ℃。 2.4 天平:感量 0.1 g。 2.5 均质器。 2.6 振荡器。 2.7 无菌吸管:1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)或微量移液器及吸头。 2.8 无菌锥形瓶:容量 100 mL、500 mL。 2.9 无菌培养皿:直径 90 mm。 2.10 注射器:0.5 mL。 2.11 pH 计或 pH 比色管或精密 pH 试纸。 3 培养基和试剂 3.1 10 %氯化钠胰酪胨大豆肉汤:见附录 A 中 A.1。 3.2 7.5 %氯化钠肉汤:见附录 A 中 A.2。 3.3 血琼脂平板:见附录 A 中 A.3。 3.4 Baird-Parker 琼脂平板:见附录 A 中 A.4

GB4789.10-2010 3.5脑心浸出液肉汤(BH山:见附录A中A5。 3.6兔血浆:见附录A中A.6。 3.7稀释液:磷酸盐缓冲液:见附录A中A7。 3.8营养琼脂小斜面:见附录A中A8。 3.9革兰氏染色液:见附录A中A.9。 3.10无菌生理盐水:见附录A中A.10
GB 4789.10—2010 2 3.5 脑心浸出液肉汤(BHI) :见附录 A 中 A.5。 3.6 兔血浆:见附录 A 中 A.6。 3.7 稀释液:磷酸盐缓冲液:见附录 A 中 A.7。 3.8 营养琼脂小斜面:见附录 A 中 A.8。 3.9 革兰氏染色液:见附录 A 中 A.9。 3.10 无菌生理盐水:见附录 A 中 A.10
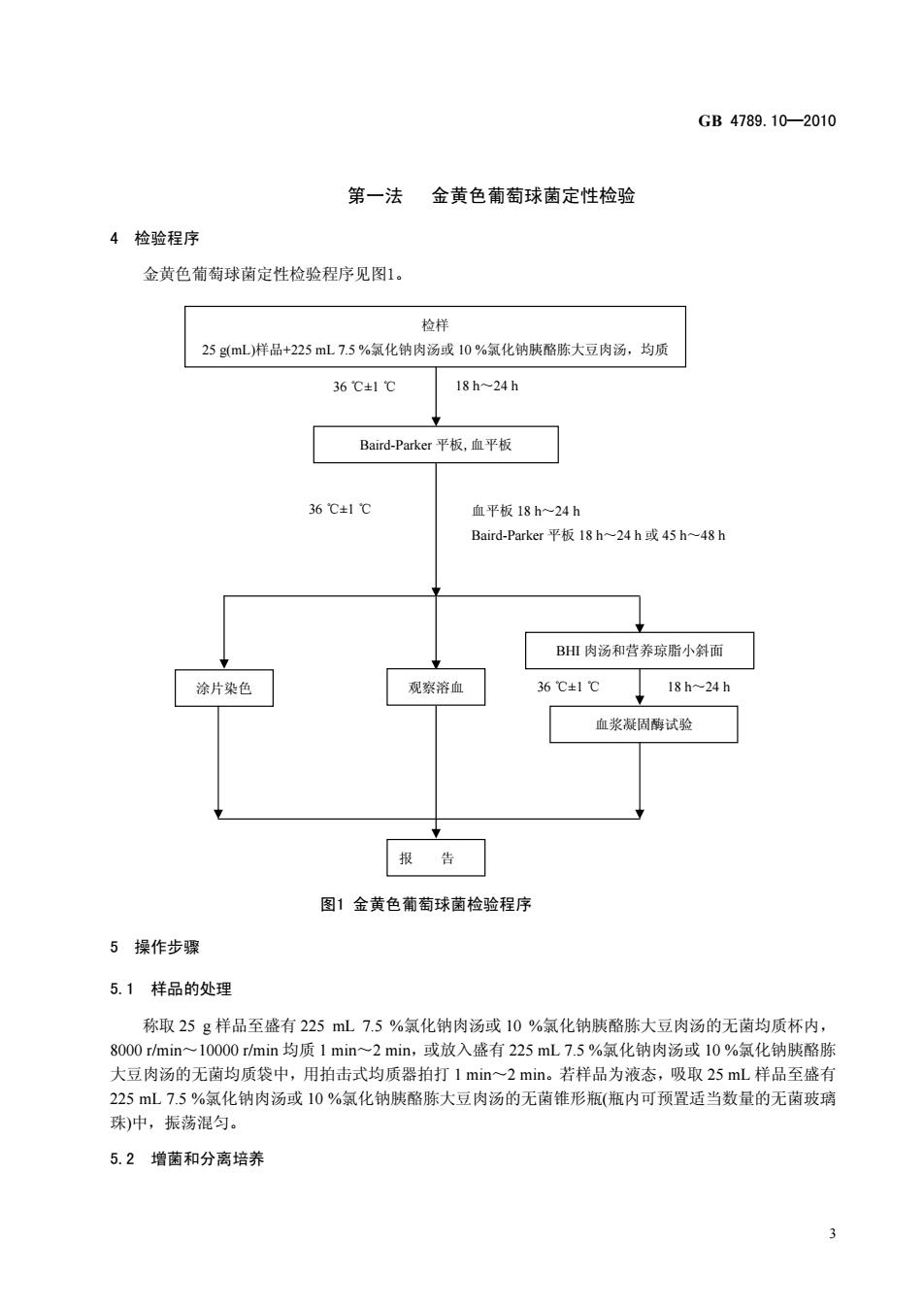
GB4789.10-2010 第一法金黄色葡萄球菌定性检验 4检验程序 金黄色葡萄球菌定性检验程序见图1 检样 25gmL)样品+225mL75%氧化钠肉汤或10%氧化钠胰酪陈大豆肉汤,均质 36℃±1℃ 18h-24h Band-Pate平板.直平板 36℃±1℃ 血平板18h~24h Baird--Parker平板18h-24h或45h~48h BH肉汤和营养琼脂小斜面 涂片染色 观察溶血 36±1℃ 18h-24h 血浆凝固悔试验 报告 图1金黄色葡萄球菌检验程序 5操作步骤 5.1样品的处理 称取25g样品至盛有225mL7.5%氯化钠肉汤或10%氯化钠胰酪胨大豆肉汤的无菌均质杯内 8000min一10000min均质1min一2min,或放入盛有225mL75%氯化钠肉汤域10%氯化钠胰酪 大豆肉汤的无菌均质袋中,用拍击式均质器拍打1min~2min。若样品为液态,吸取25mL样品至盛有 225mL7.5%氯化钠肉汤或10%氯化钠胰酪陈大豆肉汤的无菌锥形瓶(瓶内可预置适当数量的无茵玻璃 珠)中,振荡混匀。 5.2增菌和分离培养
GB 4789.10—2010 3 36 ±1 ℃ ℃ 18 h~24 h 36 ±1 ℃ ℃ 18 h~24 h 第一法 金黄色葡萄球菌定性检验 4 检验程序 金黄色葡萄球菌定性检验程序见图1。 图1 金黄色葡萄球菌检验程序 5 操作步骤 5.1 样品的处理 称取 25 g 样品至盛有 225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨大豆肉汤的无菌均质杯内, 8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有 225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨 大豆肉汤的无菌均质袋中,用拍击式均质器拍打 1 min~2 min。若样品为液态,吸取 25 mL 样品至盛有 225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨大豆肉汤的无菌锥形瓶(瓶内可预置适当数量的无菌玻璃 珠)中,振荡混匀。 5.2 增菌和分离培养 36 ±1 ℃ ℃ 血平板 18 h~24 h Baird-Parker 平板 18 h~24 h 或 45 h~48 h Baird-Parker 平板,血平板 检样 25 g(mL)样品+225 mL 7.5 %氯化钠肉汤或 10 %氯化钠胰酪胨大豆肉汤,均质 血浆凝固酶试验 BHI 肉汤和营养琼脂小斜面 涂片染色 观察溶血 报 告

GB4789.10-2010 5.2.1将上述样品匀液于36℃±1℃培养18h~24h。金黄色葡萄球菌在7.5%氯化钠肉汤中呈混浊生 长,污染严重时在10%氯化钠肤酪陈大豆肉汤内呈混浊生长。 5.2.2将上述培养物,分别划线接种到Baird-Parker平板和血平板,血平板36C±1℃培养18h~24h Baird-Parker平板36C±1℃培养18h~24h或45h~48h。 5.2.3金黄色葡萄球菌在Baird--Parker平板上,菌落直径为2mm~3mm,颜色呈灰色到黑色,边缘为 淡色,周围为一混浊带,在其外层有一透明圈。用接种针接触菌落有似奶油至树胶样的硬度,偶然会遇 到非脂肪溶解的类似菌落:但无混浊带及透明圈。长期保存的冷冻或干燥食品中所分离的茵落比典型菌 落所产生的黑色较淡些,外观可能粗糙并干燥。在血平板上,形成菌落较大,圆形、光滑凸起、湿润 金黄色(有时为白色),菌落周围可见完全透明溶血圈。挑取上述菌落进行革兰氏染色镜检及血浆凝固 酶试验。 5.3鉴定 5.3.1染色镜检:金黄色葡萄球菌为革兰氏阳性球菌,排列呈葡萄球状,无芽胞,无荚膜,直径约为 0.5um-1um。 5.3.2血浆凝固酶试验:挑取、Baird-.Parker平板或血平板上可疑菌落1个或以上,分别接种到5mLBH 和营养球脂小斜面,36C±1℃培养18h~24h。 取新鲜配置兔血浆0.5mL,放入小试管中,再加入BH培养物0.2mL~0.3mL,振荡摇匀,置36 ℃士1℃温箱或水浴箱内,每半小时观察一次,观察6h,如呈现凝周(即将试管倾斜或倒置时,呈现凝 块)或凝固体积大于原体积的一半,被判定为阳性结果。同时以血浆凝固酶试验阳性和阴性葡萄球菌菌 株的肉汤培养物作为对照。也可用商品化的试剂,按说明书操作,进行血浆凝固酶试验。 结果如可疑,挑取营养琼脂小斜面的菌落到5mLBH,36℃±1℃培养18h~48h,重复试验, 5.4葡萄球菌肠毒素的检验 可疑食物中毒样品或产生葡萄球菌肠毒素的金黄色葡萄球菌菌株的鉴定,应按附录B检测葡萄球菌 肠毒素。 6结果与报告 6.1结果判定:符合523、5.3,可判定为金黄色葡萄球南。 6.2结果报告:在25g(mL)样品中检出或未检出金黄色葡萄球茵
GB 4789.10—2010 4 5.2.1 将上述样品匀液于 36 ℃±1 ℃培养 18 h~24 h。金黄色葡萄球菌在 7.5%氯化钠肉汤中呈混浊生 长,污染严重时在 10%氯化钠胰酪胨大豆肉汤内呈混浊生长。 5.2.2 将上述培养物,分别划线接种到 Baird-Parker 平板和血平板,血平板 36 ℃±1 ℃培养 18 h~24 h。 Baird-Parker 平板 36 ℃±1 ℃培养 18 h~24 h 或 45 h~48 h。 5.2.3 金黄色葡萄球菌在 Baird-Parker 平板上,菌落直径为 2 mm~3 mm,颜色呈灰色到黑色,边缘为 淡色,周围为一混浊带,在其外层有一透明圈。用接种针接触菌落有似奶油至树胶样的硬度,偶然会遇 到非脂肪溶解的类似菌落;但无混浊带及透明圈。长期保存的冷冻或干燥食品中所分离的菌落比典型菌 落所产生的黑色较淡些,外观可能粗糙并干燥。在血平板上,形成菌落较大,圆形、光滑凸起、湿润、 金黄色(有时为白色),菌落周围可见完全透明溶血圈。挑取上述菌落进行革兰氏染色镜检及血浆凝固 酶试验。 5.3 鉴定 5.3.1 染色镜检:金黄色葡萄球菌为革兰氏阳性球菌,排列呈葡萄球状,无芽胞,无荚膜,直径约为 0.5 μm~1 μm。 5.3.2 血浆凝固酶试验:挑取、Baird-Parker 平板或血平板上可疑菌落 1 个或以上,分别接种到 5 mL BHI 和营养琼脂小斜面,36 ±1 ℃ ℃培养 18 h~24 h。 取新鲜配置兔血浆 0.5 mL,放入小试管中,再加入 BHI 培养物 0.2 mL~0.3 mL,振荡摇匀,置 36 ℃ ℃ ±1 温箱或水浴箱内,每半小时观察一次,观察 6 h,如呈现凝固(即将试管倾斜或倒置时,呈现凝 块)或凝固体积大于原体积的一半,被判定为阳性结果。同时以血浆凝固酶试验阳性和阴性葡萄球菌菌 株的肉汤培养物作为对照。也可用商品化的试剂,按说明书操作,进行血浆凝固酶试验。 结果如可疑,挑取营养琼脂小斜面的菌落到 5 mL BHI,36 ±1 ℃ ℃培养 18 h~48 h,重复试验。 5.4 葡萄球菌肠毒素的检验 可疑食物中毒样品或产生葡萄球菌肠毒素的金黄色葡萄球菌菌株的鉴定,应按附录B检测葡萄球菌 肠毒素。 6 结果与报告 6.1 结果判定:符合 5.2.3、5.3,可判定为金黄色葡萄球菌。 6.2 结果报告:在 25 g(mL)样品中检出或未检出金黄色葡萄球菌
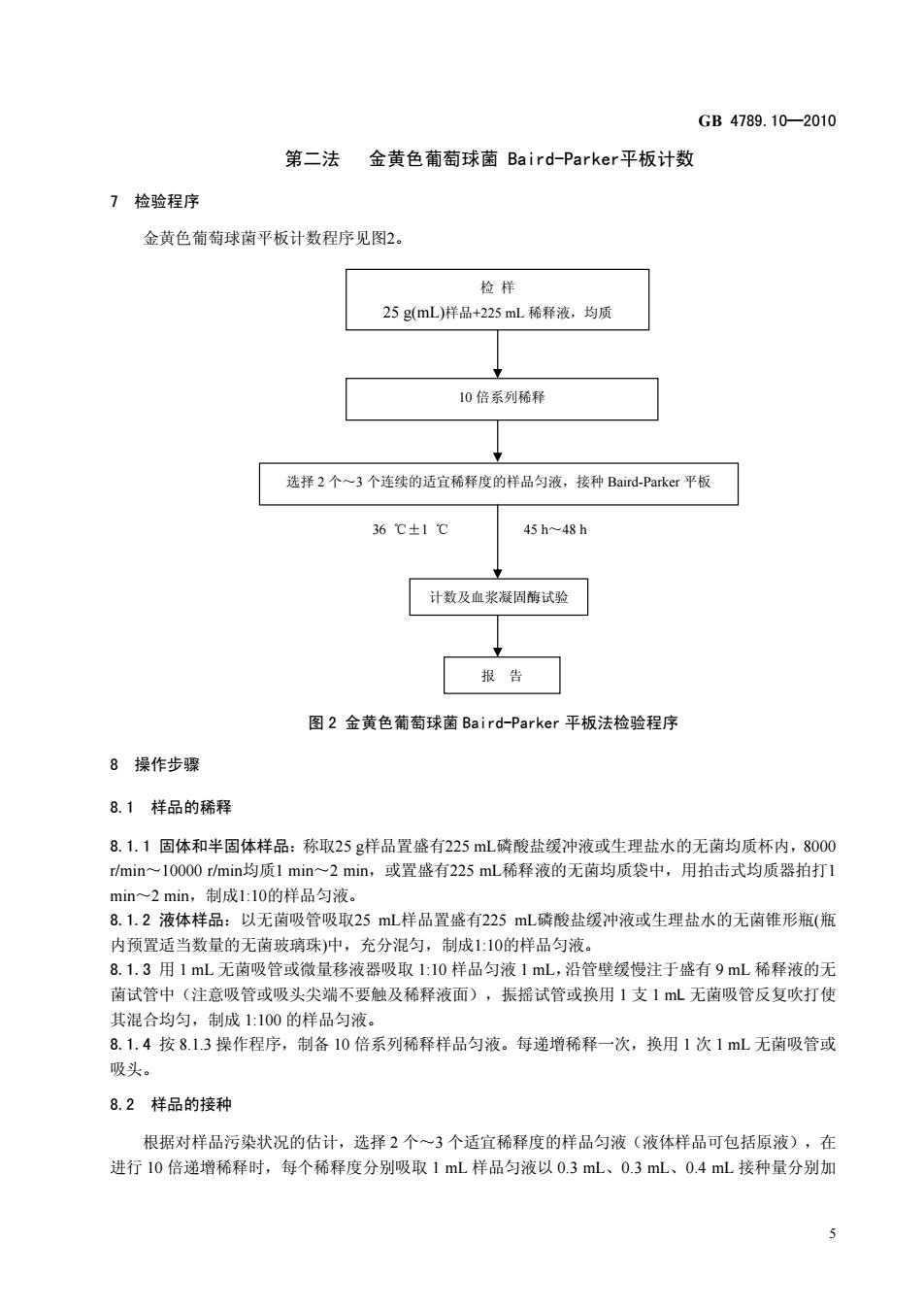
GB4789.10-2010 第二法金黄色葡萄球菌Baird--Parker平板计数 7检验程序 金黄色葡萄球菌平板计数程序见图2 检样 25gmL)样品+225ml稀释液,均质 10倍系列稀释 选择2个一3个连续的适宜稀释度的样品匀液,接种Bard.Parker平板 36℃±1℃ 45h48h 计数及血浆凝固酶试验 报告☐ 图2金黄色葡萄球菌Baird--Parker平板法检验程序 8操作步躁 8.1样品的稀释 8.1.1固体和半固体样品:称取25g样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 min~10000min均质1min一2min,或置盛有225mL稀释液的无菌均质袋中,用拍击式均质器拍打1 min~2min,制成1:10的样品匀液 8.1.2液体样品:以无菌吸管吸取25mL样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶 内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。 8.1.3用1mL无菌吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9mL稀释液的无 茵试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打使 其混合均匀,制成1:100的样品匀液。 8.1.4按8.13操作程序,制备10倍系列稀释样品匀液。每递增稀释一次,换用1次1mL无菌吸管或 吸头。 82样品的接种 根据对样品污染状况的估计,选择2个一3个适宜稀释度的样品匀液(液体样品可包括原液),在 进行10倍递增稀释时,每个稀释度分别吸取1mL样品匀液以0.3mL、0.3mL、0.4mL接种量分别加 5
GB 4789.10—2010 5 36 ℃±1 ℃ 第二法 金黄色葡萄球菌 Baird-Parker平板计数 7 检验程序 金黄色葡萄球菌平板计数程序见图2。 图 2 金黄色葡萄球菌 Baird-Parker 平板法检验程序 8 操作步骤 8.1 样品的稀释 8.1.1 固体和半固体样品:称取25 g样品置盛有225 mL磷酸盐缓冲液或生理盐水的无菌均质杯内,8000 r/min~10000 r/min均质1 min~2 min,或置盛有225 mL稀释液的无菌均质袋中,用拍击式均质器拍打1 min~2 min,制成1:10的样品匀液。 8.1.2 液体样品:以无菌吸管吸取25 mL样品置盛有225 mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶 内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。 8.1.3 用 1 mL 无菌吸管或微量移液器吸取 1:10 样品匀液 1 mL,沿管壁缓慢注于盛有 9 mL 稀释液的无 菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用 1 支 1 mL 无菌吸管反复吹打使 其混合均匀,制成 1:100 的样品匀液。 8.1.4 按 8.1.3 操作程序,制备 10 倍系列稀释样品匀液。每递增稀释一次,换用 1 次 1 mL 无菌吸管或 吸头。 8.2 样品的接种 根据对样品污染状况的估计,选择 2 个~3 个适宜稀释度的样品匀液(液体样品可包括原液),在 进行 10 倍递增稀释时,每个稀释度分别吸取 1 mL 样品匀液以 0.3 mL、0.3 mL、0.4 mL 接种量分别加 10 倍系列稀释 选择 2 个~3 个连续的适宜稀释度的样品匀液,接种 Baird-Parker 平板 计数及血浆凝固酶试验 报 告 检 样 25 g(mL)样品+225 mL 稀释液,均质 45 h~48 h

GB4789.10-2010 入三块Baird-Parker平板,然后用无菌L棒涂布整个平板,注意不要触及平板边缘。使用前,如Baird-Parker 平板表面有水珠,可放在25℃一50℃的培养箱里干燥,直到平板表面的水珠消失。 8.3培养 8.3.1.1在通常情况下,涂布后,将平板静置10mi,如样液不易吸收,可将平板放在培养箱36℃±1 ℃培养1h:等样品匀液吸收后翻转平皿,倒置于培养箱,36℃±1℃培养,45h~48h。 8.4典型菌落计数和确认 8.4.1金黄色葡萄球菌在Baird--Parker平板上,菌落直径为 mm 3mm,颜色呈灰色到黑色,边缘为 淡色,周用为一混浊带,在其外层有一透明圈。用接种针接触南落有似奶油至树胶样的硬度,偶然会遇 到非脂肪溶解的类似菌落:但无混浊带及透明圈。长期保存的冷冻或干燥食品中所分离的菌落比典型菌 落所产生的黑色较淡些,外观可能知精并干燥。 8.4.2选择有典型的金黄色葡萄球菌菌落的平板,且同一稀释度3个平板所有菌落数合计在20C℉U入 200CFU之间的平板,计数典型菌落数。如果: a)只有一个稀释度平板的菌落数在20C℉U~200C℉U之间且有典型菌落,计数该稀释度平板上的 典型茵落: b)最低稀释度平板的菌落数小于20C℉U且有典型菌落,计数该稀释度平板上的典型菌落 c)某一稀释度平板的菌落数大于200C℉U且有典型菌落,但下一稀释度平板上没有典型茵落, 应计数该稀释度平板上的典型南落: d)某一稀释度平板的菌落数大于200CFU且有典型南落,且下一稀释度平板上有典型菌落,但 其平板上的南落数不在20C℉U~200CFU之间,应计数该稀释度平板上的典型南落: 以上按公式(1)计算 e)2个连续稀释度的平板南落数均在20CFU-200CFU之间,按公式(2)计算。 8.4.3从典型菌落中任选5个菌落(小于5个全选),分别按5.3.2做血浆凝爾试验。 9结果计算: 公式(1): T=AB d 式中: 了—样品中金黄色葡萄球茵菌落数 一某一稀释度典型菌落的总数: 一某一稀释度血浆凝周酶阳性的菌落数 -某一稀释度用于血浆凝固酶试验的菌落数: d一稀释因子。 公式(2): T-AIBV/C1+42B2/C2 1.ld 式中 T- -样品中金黄色葡萄球菌菌落数: A1一第一稀释度(低稀释倍数)典型菌落的总数: 42一第二稀释度(高稀释倍数)典型菌落的总数: B1一第一稀释度(低稀释倍数)血浆凝固酶阳性的菌落数: 6
GB 4789.10—2010 6 入三块Baird-Parker平板,然后用无菌L棒涂布整个平板,注意不要触及平板边缘。使用前,如Baird-Parker 平板表面有水珠,可放在 25 ℃~50 ℃的培养箱里干燥,直到平板表面的水珠消失。 8.3 培养 8.3.1.1 在通常情况下,涂布后,将平板静置 10 min,如样液不易吸收,可将平板放在培养箱 36 ℃±1 ℃培养 1 h;等样品匀液吸收后翻转平皿,倒置于培养箱,36 ℃±1 ℃培养,45 h~48 h。 8.4 典型菌落计数和确认 8.4.1 金黄色葡萄球菌在 Baird-Parker 平板上,菌落直径为 2 mm~3 mm,颜色呈灰色到黑色,边缘为 淡色,周围为一混浊带,在其外层有一透明圈。用接种针接触菌落有似奶油至树胶样的硬度,偶然会遇 到非脂肪溶解的类似菌落;但无混浊带及透明圈。长期保存的冷冻或干燥食品中所分离的菌落比典型菌 落所产生的黑色较淡些,外观可能粗糙并干燥。 8.4.2 选择有典型的金黄色葡萄球菌菌落的平板,且同一稀释度 3 个平板所有菌落数合计在 20 CFU~ 200 CFU 之间的平板,计数典型菌落数。如果: a)只有一个稀释度平板的菌落数在20 CFU~200 CFU之间且有典型菌落,计数该稀释度平板上的 典型菌落; b) 最低稀释度平板的菌落数小于 20 CFU 且有典型菌落,计数该稀释度平板上的典型菌落; c) 某一稀释度平板的菌落数大于 200 CFU 且有典型菌落,但下一稀释度平板上没有典型菌落, 应计数该稀释度平板上的典型菌落; d) 某一稀释度平板的菌落数大于 200 CFU 且有典型菌落,且下一稀释度平板上有典型菌落,但 其平板上的菌落数不在 20 CFU~200 CFU 之间,应计数该稀释度平板上的典型菌落; 以上按公式(1)计算。 e) 2 个连续稀释度的平板菌落数均在 20 CFU~200 CFU 之间,按公式(2)计算。 8.4.3 从典型菌落中任选 5 个菌落(小于 5 个全选),分别按 5.3.2 做血浆凝固酶试验。 9 结果计算: 公式(1): Cd AB T = ………………………………………………………………… (1) 式中: T——样品中金黄色葡萄球菌菌落数; A——某一稀释度典型菌落的总数; B——某一稀释度血浆凝固酶阳性的菌落数; C——某一稀释度用于血浆凝固酶试验的菌落数; d——稀释因子。 公式(2): ………………………(2) 式中: T ——样品中金黄色葡萄球菌菌落数; A1——第一稀释度(低稀释倍数)典型菌落的总数; A2——第二稀释度(高稀释倍数)典型菌落的总数; B1——第一稀释度(低稀释倍数)血浆凝固酶阳性的菌落数; d A B C A B C T 1.1 1 1 1+ 2 2 2 =

GB4789.10-2010 2一第二稀释度(高稀释倍数)血浆凝周酶阳性的茵落数: C1一第一稀释度(低稀释倍数)用于血浆凝固酶试验的南落数: C2一第二稀释度(高稀释倍数)用于血浆凝固酶试验的菌落数: 1.1一计算系数 d一稀释因子(第一稀释度), 10结果与报告 根据Baird-.Parker平板上金黄色葡萄球菌的典型菌落数,按9中公式计算,报告每g(mL)样品中金 黄色葡萄球菌数,以CU/g(mL)表示:如T值为0,则以小于1乘以最低稀释倍数报告。 1
GB 4789.10—2010 7 B2——第二稀释度(高稀释倍数)血浆凝固酶阳性的菌落数; C1——第一稀释度(低稀释倍数)用于血浆凝固酶试验的菌落数; C2——第二稀释度(高稀释倍数)用于血浆凝固酶试验的菌落数; 1.1——计算系数; d ——稀释因子(第一稀释度)。 10 结果与报告 根据Baird-Parker平板上金黄色葡萄球菌的典型菌落数,按9中公式计算,报告每g(mL)样品中金 黄色葡萄球菌数,以CFU/g(mL)表示;如T值为0,则以小于1乘以最低稀释倍数报告
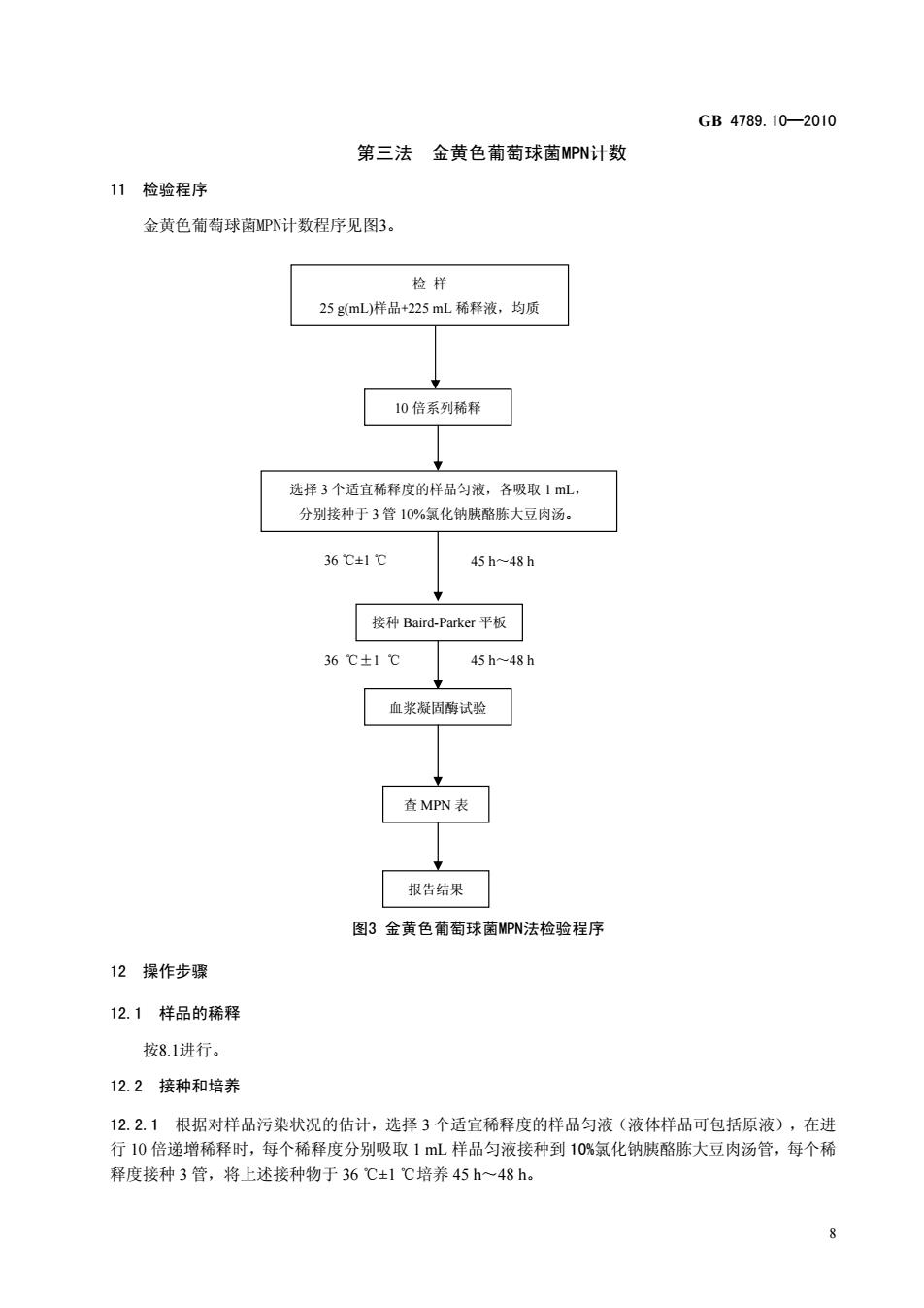
GB4789.10-2010 第三法金黄色葡萄球菌MPN计数 11检验程序 金黄色葡萄球南MPN计数程序见图3 检样 25gmL)样品+225mL稀释液,均质 10倍系列稀释 选择3个话省稀释度的样品匀液.各吸取1mL, 分别接种于3管10%氯化钠胰酪陈大豆肉汤。 36c±1 45h~48h 接种Baird-Parker平板 36℃±1℃ 45h48h 血浆凝周酶试验 查MPN表 报告结果 图3金黄色葡萄球菌MPN法检验程序 12操作步骤 12.1样品的稀释 按8.1进行。 12.2接种和培养 1221根据对样品污垫状况的估计,洗3个活宜稀府的样品匀液(液体样品可句括原液),在讲 行10倍递增稀释时,每个稀释度分别吸取1mL样品匀液接种到10%氯化纳胰酪陈大豆肉汤管,每个稀 释度接种3管,将上述接种物于36℃±1℃培养45h~48h
GB 4789.10—2010 8 第三法 金黄色葡萄球菌MPN计数 11 检验程序 金黄色葡萄球菌MPN计数程序见图3。 图3 金黄色葡萄球菌MPN法检验程序 12 操作步骤 12.1 样品的稀释 按8.1进行。 12.2 接种和培养 12.2.1 根据对样品污染状况的估计,选择 3 个适宜稀释度的样品匀液(液体样品可包括原液),在进 行 10 倍递增稀释时,每个稀释度分别吸取 1 mL 样品匀液接种到 10%氯化钠胰酪胨大豆肉汤管,每个稀 释度接种 3 管,将上述接种物于 36 ±1 ℃ ℃培养 45 h~48 h。 10 倍系列稀释 选择 3 个适宜稀释度的样品匀液,各吸取 1 mL, 分别接种于 3 管 10%氯化钠胰酪胨大豆肉汤。 接种 Baird-Parker 平板 血浆凝固酶试验 检 样 25 g(mL)样品+225 mL 稀释液,均质 查 MPN 表 报告结果 36 ℃±1 ℃ 45 h~48 h 36 ℃±1 ℃ 45 h~48 h