
第7章氧化还原与消毒 7.1概述 7.1.1氧化剂和消毒方法 氧化还原方法常被用于去除水中的致病微生物以及有机或无机污染物等,以 保障水的卫生安全。氧化剂在水处理过程中可以与水中微生物如原生动物、浮游生 物、藻类、细菌、病毒等作用,使之灭活或强化去除,该过程又被称作消毒过程:也 可以 水中有机或无机污染物作用, 分解 环或转化成其他形态,降低其危 性或使其更易于去除。常见的氧化剂有氯、臭氧、二氧化氯、过氧化氢、高锰酸盐、 高铁酸盐等 氯氧化与消毒是水处理中应用最广的化学氧化方法,主要用于水的消毒,至今 仍广泛地应用于给水、游泳池循环水和各种污水处理中。但山于氯具有很强的取代 作用,在消毒的同时还会与水中有机物进行取代反应,生成一些对人体健康具有潜 在危害的卤代刚产物(如三卤甲烷、卤乙酸等),因此.目前氢主要用于最后消毒 而不适用于预氧化 臭氧是水处理中应用较早的氧化剂。臭氧具有很强的杀菌作用 ,其杀菌能力约 是氯消毒的几百倍。臭氧能够选择性地与水中带 自不饱和键的多种有机污染物作用 使之部分降解为分了量更小的有机物或部分无机物,臭氧一般能够使水中有机物的 可生化性提高,因而与生物活性炭结合使用能够显著地提高对水中有机物的综合去 除效率。 二氧化氨是一种良好的消毒剂,其消毒能力比氯高几十倍。但二氧化氯需要现 场制备,其主要消毒副产物是亚氯酸根,对红血球有破坏作用,因而二氧化氯投加量 不省过大 过氧化氢是一种强氧化剂,主要用于水与污水的高级氧化(如Fenton试剂 即Fe(Ⅱ)/H 高锰酸盐 一种强氧化剂,能够选择性地与水中有机物作用,破坏有机物的 不饱和键。同时,高锰酸盐在氧化过程中产生的新生态二氧化锰对水中多种微量有 机与无机污染物有吸附作用,可在一定程度上提高对水中多种有机污染物和重金属 的去除。此外,新生态水合二氧化锰对高锰酸盐氧化一些污染物有一定的催化作用。 山于高锰酸盐是具有复杂变价态中间产物的氧化剂,因而在水处理中有重要的应用 潜力 高铁酸盐的氧化还原电位比较高(E-2.2O),在氧化过程中也能够形成复杂的 中间态成分 其有 种作用 但房 铁酸盐 急定 需要提高, 尽管目前尚没有在水处理中大规模推广应用,仍是一种很具有研究开发 潜力的氧化剂。 除了用化学方法消毒以外,还可用物理方法消毒,目前减用较多的是鉴外线消 击。 7.1.2化学氧化 按化学药剂在水处理过程中的投加点不同和产生的作用不同,可将氧化分为 顶氧化、中间氧化和后氧化,如图7 1所示
氧化剂(预氧化)氧化剂(中间氧化)氧化剂(后氧化) 原水一一→混凝一→沉淀 →过滤 →消毒一→出水 图7.1氧化剂在水处理中的投加位置 化学预氧化对水中藻类、浮游生物、色度、臭、味、有机物、铁、锰等具有 显著的去除作用,同时可破坏氯化消毒副产物的前驱物质。藻类和浮游生物的过量 警殖,将给水厂运行带来不利影响,如增加混凝剂的投量 、阻塞滤池 缩短滤 池运 周期等。 氧化剂能 使藻类或 物灭活 不同程度地破坏藻体或浮游生物体,并释 放出一部分胞内或胞外成分,有利于混凝 色度是饮用水水质重要的控制指标之一,高色水将给人带来明显的感官不适: 水中的发色物质一般主要是腐殖质,其大分了结构中含有一些不饱和键、芳香环及 发色基团等。化学预氧化能破坏水中一些物质的不饱和键和发色基团,对后续工艺 强化去除色度起到了重要的作用。 除臭、除味一吉是饮用水外理的核心问颗之一 臭、是由水中名种有机与 无机物质综合作用而表现出来的包括土颗粒 的植物 微生物(浮游牛物」 细 真菌等)及客 硫化物 铁和 有机物和一些气 水中植物在某些微生物(如放线菌、 蓝绿藻等)作用下所产生的微量有机物(奥 甲基异茨醇、土臭素等)也是臭、味的主要来源。化学预氧化、中间氧化和后氧 化都对不同种类的臭味物质其有一定的去除效果,但氧化剂在去除一部分臭、味的 同时,还会与水中共存的其他有机物作用而产生新的臭、味,例如,臭氧与有机物作 用产生一系列醌类化合物.使饮用水中带有一定程度的水果味:氢与水中份类化合 物作用产生带有刺激性气味的氯酚:二氧化氯在氧化过程中也会产生一些异味。高 象加的除皇、味作用明昆无作用。外 高锰酸钾与某些药剂复合(高锰酸盐 复合 能使 的 臭、 此外,山于未经混凝的原水成分很复 ,在预氧化过程中氧化剂 会与水中多种 成分作用,既能够氧化分解水中某些微量无机、有机污染物,也能将腐殖酸等大分 了氧化,产生一些小分了有机物,同时预氧化能破坏有机物对胶体的保护作用,提高 混凝效果。通常水处理中常用的氧化剂主要与水中有机物的不饱和键作用,生成相 战的含氧有机中间产物。 几种氧化剂能迅速地室化水中游离态铁、锰,但对地表水中的稳定性铁、缸 的氧化效果明显降低。高锰酸盐和高铁酸盐对地表水中铁锰的强化去除效果相对较 并已经在生产中应用。几种氧化剂与水中铁链的定量反应关系如表7一1所示 几种常用氧化剂与Fe(IⅡ)和M恤(Ⅱ)作用的定量关系表7-】 金属/氧化物 反 定量关系 1.Fe() 2Fe+0,(aa)+5H0 Q (aq)-Q 2Fe(0D,(s)+0.(ag)+4 O.43mgO.x/mgFe HOC1→C 2H0c1+5H0 2Fe(00:(s)+2C1+0(aq)+6 0.64mgHOCl/mgFe
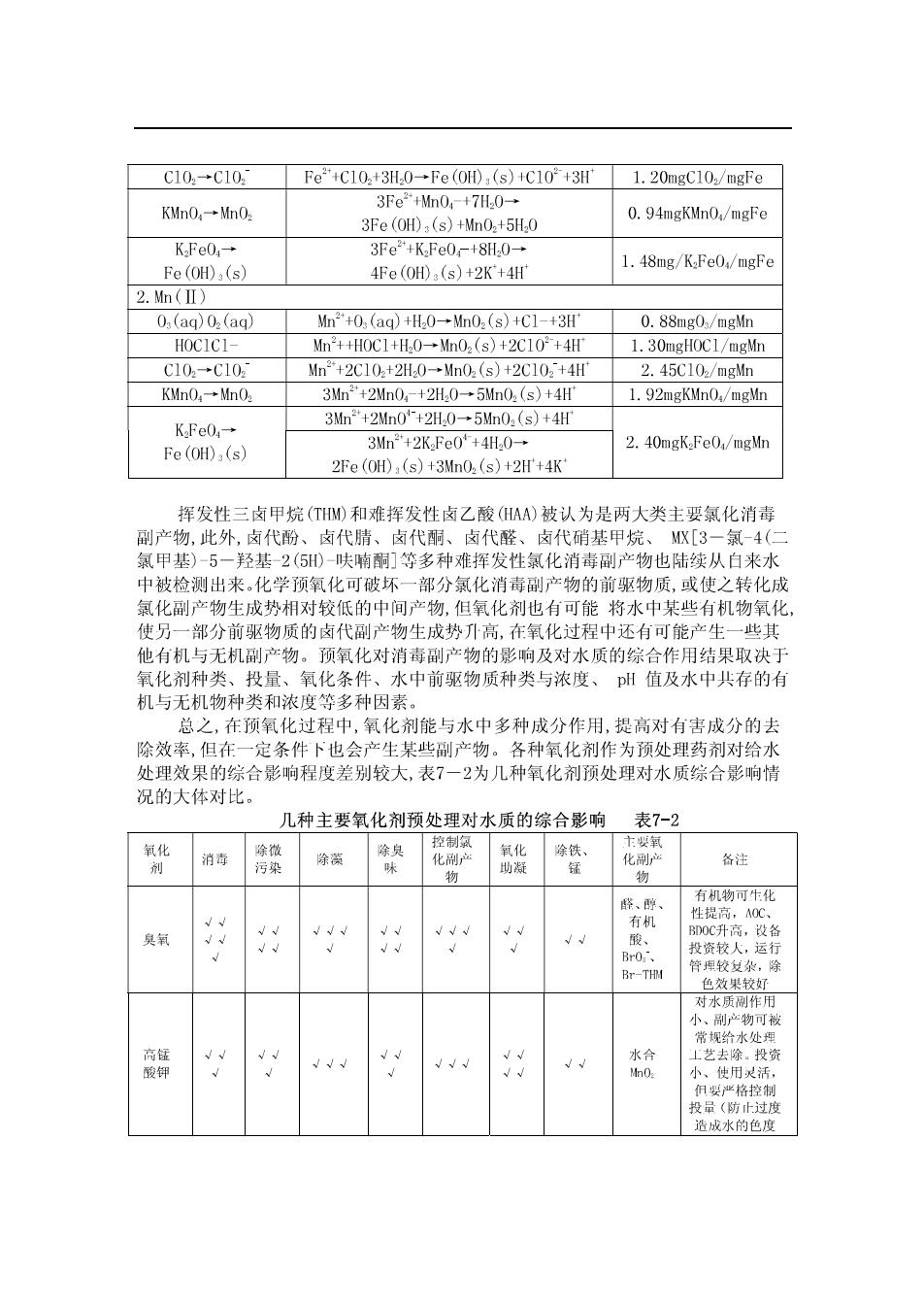
C10+C10 Fe*+C10.+3HO-Fe (OH),(s)+C10*+3H' 1.20mgC10/mgFe 3Fe2+n0,-+7H0-. KMnO,→MmO 3Fe(0HD,(s)+02+5,0 0.94mgKMnO/mgFe KFe0.- 3Fe+KFe0-+8H.0-→ Fe(OH),(s) 4Fe(0H,(s)+2K'+4H 1.48mg/K.FeO./mgFe 2.n( 0(ag)0 (ag) Mn+0,(aq)H0→Mn0,(s)+C1-+3 0.88mg0/mgMn HOCICI- Mn++H0C1+H0+Mn0(s)+2C10+4H 1 30mgHOCI/meVn 10..10 Mn+2C10+2H.0-→n0,(s)+2C102+4 )45C10./man KMnO,-→MhO 3Mm2+2Mn0,-+2H.0→5Mn0.(s)+4H 1.92mgKMn0,/mgMn K.FeO- 3n+2Mn0+2H0-→5Mn0.(S)+4 3Mn°+2KFe0+4H0 2.40mgK.Fe0/mgMn Fe(OH)(s) 2Fe(0HD,(s)+3n0,(s)+2H+4K 挥发性三卤甲烷(THM)和难挥发性卤乙酸AA)被认为是两大类主要氯化消毒 刚产物.外卤代、卤代吉、代市、代、女代省甚用、「3一氢-4 氯甲基)5一羟基2(5)-呋喃酮]等多种难挥发性氯化消毒刷产物也陆续从白来水 中被检测出来,化学预氧化可破 部分氯化消毒副 物的前驱物质, 或使之转化 氯化副产物生成势相对较低的中间产物,但氧化剂也有可能将水中某些有机物氧化 使另一部分前驱物质的卤代副产物生成势升高,在氧化过程中还有可能产生 他有机与无机副产物。预氧化对消毒副产物的影响及对水质的综合作用结果取决于 氧化剂种类、投量、氧化条件、水中前驱物质种类与浓度、州值及水中共存的有 机与无机物种类和浓度等多种因素。 总之在预氧化时程中氧化剂能与水中多种成仆作用.想高对有害成公的 除效率,但在 定条件下也会产生某些副产物。各种氧化剂作为预处理药剂对给水 处理效果的综合影响程度差别较大,表7一2为几种氧化剂预处理对水质综合影响情 况的大体对比。 几种主要氧化剂预处理对水质的综合影响表7-2 消毒 除 锰 臭氧 Br-THI 对水厨测作 产物可 夜鲜 业格控 适成水的

不能 氯化消诗剂 时 化贵 在水中作 Fe(OH) 加设各,对水月 物品丁被去除 ,表巾列出在通常情况下的效果√ —略有效果:√ 一较了:√√ 良好:√ 三肉甲烷:M一肉乙酸:A0C一化可问化有机碳:0C一可牛物降解蒂解性有机碳 中间氧化通常设在常规处理工艺的沉淀之后或过滤之后,作为水的深度处理 手段通讨与颗铲活件炭(GAC)成生物活性炭(BAC)联用利用活件炭的良(吸附性 能和生物降解功能将氧化后形成的可生化性较高的小分了有机物、有毒有害中间 物及消毒副, 体物等进一步 去除 多采用臭氧 化剂 后氧化是保证饮用水卫生安全的最后通屏隙其宴目的是消游,即灭产 水中致病微生物。水中消毒剂可分为4类:(1)氧化剂:通过氧化作用破坏有机体内的 物质而达到灭活微生物的作用:(2)金、银等重金属离了:重金属往往能够使微生物 体内的蛋白质失去活性,例如铜离了能灭活藻类:(3)一些物理方法杀灭微生物或者 将微生物分离出来,如紫外线、超声波、辐射,还有加热法、冷冻法、机械过滤等: (4)阳离了表面活性剂,如季胺类与有机阳离了(CHI)化合物)。目前饮用水中常 用的消毒剂为氧化剂类,其氧化还原电位如表7-3所示 氧化剂类消毒剂及其标准(25℃)氧化还原电位(E 表7-3 半反应(还原式) E°(V) 半反还原式 E (V) 0+2r+2e→0+Hl0 2.07 [H0I+T+2e→I+L0 0.99 H0C1+HT+2e→C1+H 1.49 C10,(aq)+e-→C1+20If 0.95 C1.426-.2C1 1.36 0C1+H20+2e°→C1+20r 0.90 H0Br+Hf+2e-→0+20 1.33 0Br+H,0+2e→Br+20H 0.70 0.+H012e→02+20r 1.24 1t2e→2T 0.54 c10.taC10 1.15 L+2e→3I Br+2e→2B 1.07 0+H.0+2e→I+20H

7.1.3消毒与灭活 目前液氯仍是主要的消毒剂。氯消毒效果比较好,成木较低,可在管网中保持 定余量,存在的问题是氯与水中一些有机物作用产生对人体有害的副产物,因此 安全氯化消毒引起人们普遍的关注,应在保证消毒效果的前提卜控制氯化消毒副产 物生成量。 衡量消毒剂的消毒效果一般要确定所使用的消毒剂对微生物的灭活速率,最终 决定有效接触时间及投药量 1.Chick定律 奇克(Chick)最早阐述了消毒过程中的规律,认为消毒过程类似于双分了化 学反应,只不过反应物分别是消毒剂与微生物,可以用化学反应速率描述,其表达式 为: In(N/N.)=-kt 式中 一接触t时间后存活的微生物数量: 一初始微生物数量: k一速率常数,T t一接触时间,s。 此后,瓦特逊(Watsor)又提出了速率常数k与消毒剂浓度C的关系 k=k'C(7-2 式中n一稀释系数 与消毒剂浓度无关的速率常数 当C,n k'均为定值时 在完全 含式系统中,消毒剂浓度恒定的理想情况 卜下,消毒速率为定值,则在半对数坐标纸上作图应得 一直线天系,但什实你情日 式验数据在半对数坐标纸上并不总是直线关系,微生物的灭活率着时间的变化 呈现出不同情况的变化,其偏差可能是山多种因素造成的,如微生物种类,水的 值以及温度等因素的差异,以及山于水的流态而造成的消毒剂在水中的空间及时 间分布的不均匀等因素。图7-2表示出几种典型的情况。图中纵坐标为-1gN/八。) 横坐标为接触时间t,为活生物体的初始密度,N为接触时间t存活的生物体察度, N/N为存活率,以百分数表 -/ 过为灭活率。 曲线代表灭活率在大部分 间内随接触时间的增 屈于多细 的情 曲 B代 数的情况:曲线C的灭活率随接触时间的增加而降低:曲线D则出现两阶段不同的 灭活率。 当灭活率为90%时,存活率为10%,相当于N/为0.1,在图7-2的-1g/N。)坐标 相应为1。同样,当灭活率为99%、99.9%和99.99%等数值时,-1g(N/N,)相应为2、3和 4等整数,因此近年也常把这些百分数分别说成是1-1g、2-1g、3-1g和41g的去除率 或灭活率。同样,n1g的去除率或灭活率则代表去除率或灭活率为(1-10)×100%
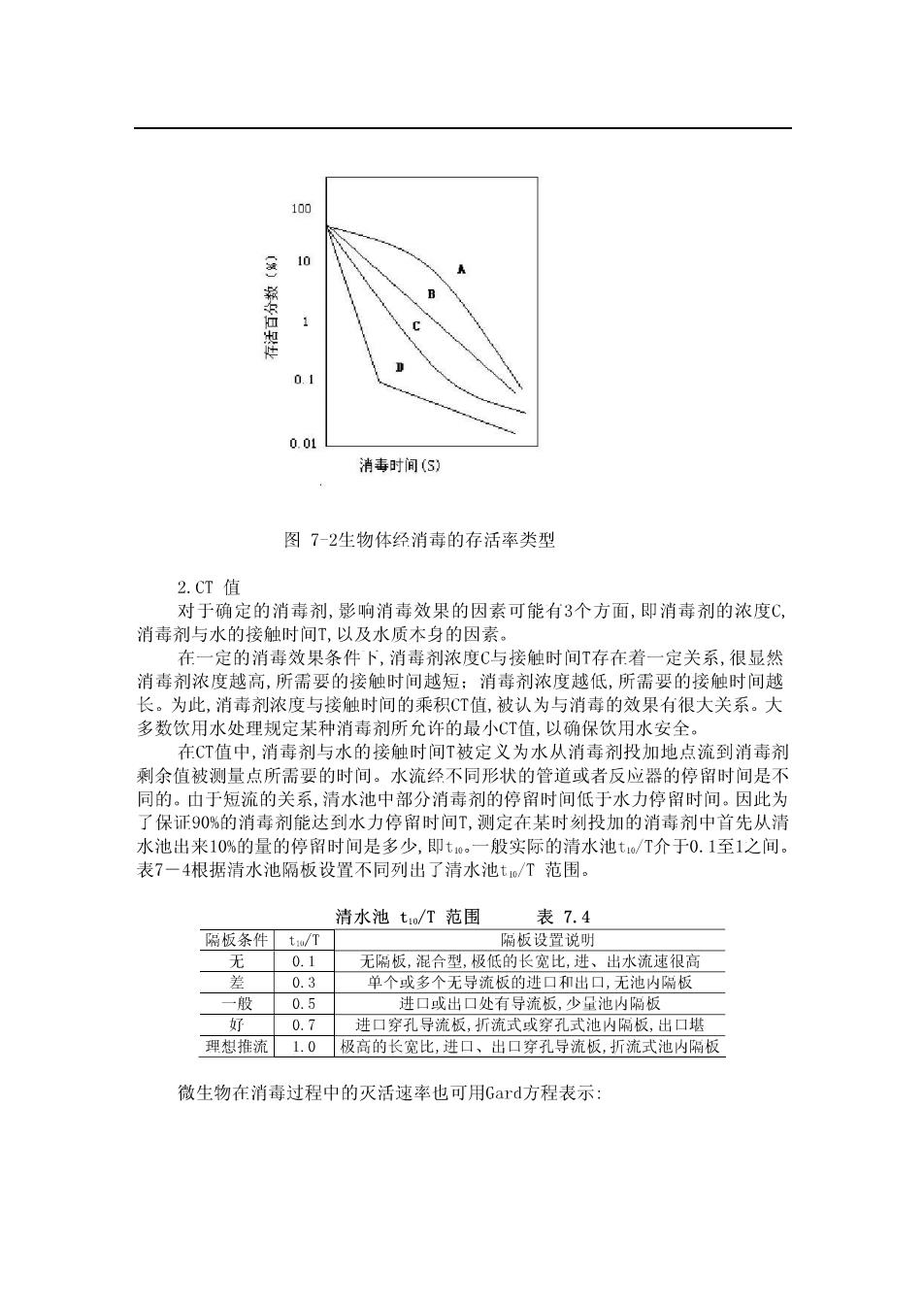
100 1 0.1 0.01 消毒]时间(S】 图72生物体经消毒的存活率类型 2.CT值 对于确定的消毒剂,影响消毒效果的因素可能有3个方面,即消毒剂的浓度℃, 消毒剂与水的接触时间T,以及水质本身的因素。 在一定的消毒效果条件卜,消毒剂浓度C与接触时间T存在着一定关系,很显然 度越高,所孟要的接触时间越短消壶剂浓度越低,所要的接 为此,消毒剂浓 与接触时间的乘 被认为与消毒的效果有很大关系。大 多数饮用 水处单就足 某种消毒剂所允许的最小CT值,以 确保饮用水 在CT值中,消毒剂与水的接触时间T被定义为水从消毒剂投加地点流到消毒剂 剩余值被测量点所需要的时间。水流经不同形状的管道或者反应器的停留时间是不 同的。山于短流的关系,清水池中部分消毒剂的停留时间低于水力停留时间。因此为 了保证90%的消毒剂能达到水力停留时间T,测定在某时刻投加的消毒剂中首先从清 水池出米1O%的量的停留时间是多少,即t。一般实际的清水池t√T介于0.1至1之间。 表7一4根据清水池隔板设置不同列出了清水池t/T范围。 清水池to/T范围 表7.4 隔板条件tT 无版,混合型, 置说明 出水流速很高 板的进 十0.7 进口穿孔写 山可堪 弹想推流1.0极高的长宽比 出口穿孔导流板,折流式池内隔板 微生物在消毒过程中的灭活速率也可用Gard方程表示:

dN kCN dt1+a(CT) (7-3) 式中k一常数,L/(g·nn): C一消浓度 常数.1 mg·n): -微生物浓度,个L 对(7-3)式从t=0到t=T积分得: 1 N。+a(CTe (7-4) N为t-0时的生物浓度。令a-1/b和k/a-kb=n,使b的单位与CT完全一样得: (7-5) No b 上式在双对数坐标纸上为一条斜率为n的直线。1g(1+CT/b)与1g(CT/b)的值 般相差不大,故上式可进一步筒化成: (7-6) 上式陈为C。11 ins-Se11eck灭活模型。h(7-6)式可可n.h为N=N村的CT值.因出 当Nb的情况,b代表消毒的滞后现象 根据消毒试验的数振,以-1g/八)为纵坐标,k(CT)为横坐标作图,可得一直 线,其斜率为-,横轴的截距为1gb。中所得的直线,可以根据所要灭活的百分数求 所需的CT值。 山(7一6)式还可得知,当N/N值固定,即灭活率(1-N/N)给定后,CT值必然是 个常数。 对对要灭活的微生物.根据所要达到的消毒效果(以细菌灭活率的对数路值表 示)及使用消毒剂的不同规定了不同的CT值(g· min/L)(表7-5是对贾第虫孢囊灭 活的CT值)。 对贾第虫孢囊灭活的CT值(温度10℃,pH6-9) 表7.5 CT值(mg·min/L) 消毒剂 1g火活学 0.51.01.5 2.02.5 3.0 见氧 0.2 1.☑ 3101 930 230 1540 850 7.2氯氧化与消毒 7.2.1氯的性质 氯气是一种黄色气体,有刺激性,密度为3.2kg/m,极易被压缩成號珀色的液

氯。液氯常温常压卜极易气化,气化时需要吸热,常采用淋水管喷水供能。氯气容易 溶解于水,在20℃和98kPa时,溶解度为7160mg/L。 当氯溶解在水中时,很快会发生卜列两个反应, C+H,0=HOC1+HCI (7-7) HOC1=H*+0C (78 通常认为,起消毒作用的主要是HOC1.反应(7-7)(7-8)会受到温度和pH值的影响, 其平衡常数为: K,-I:ltocn- (79) HOCT 表7.6列出了不同温度卜次氯酸离解平衡常数。 不同温度下次氯酸离解平衡常数 表7.6 度(℃) 0 10 150095 K,×108(o1/L)2.02.32.63.03.33.7 因此,H0CI与OC厂的相对比例取决于温度与pH值。图7-3给出了3个温度下 HOC1所占的比例,OC1浓度随pH值和温度而变化,氯消毒效果也会受到温度和p 值的影响 2氯消毒过程 一般认为,氯消毒过程中主要通过次氯酸HOCI起消毒作用,当HOCI分了到达细菌 内部时,与有机体发生氧化作用而使细菌姚亡。C厂虽然也具有氧化性,但山于静电 斥力难于接近带负电的细菌,因而在消毒过程中作用有限。生产实践表明,H值越低 则消毒作用越强,从而证明了OCI是起消毒作用的主要成分(见图7-3)

H0G1含量() 100 OC. 40 15℃- 20 60657070a6 图?-30C1含量与值的关系 山于在很多受污染的地表水源中含有一定的氨氮,氯加入含有氨氨的水中后会 产生如下反应 NH,+HOCI=NH,CI+H,O (7-10) NH,CI+HOCI=NHCL,+H.O (7-11) NHCI,+HOCI-NCI,+H.O (7-12 因此,在水中同时存在次氯酸(HOCI)、一氯胺(NH,CI)、二氣胺(NHC2)和 三氯胺(NC,),这些反应的平衡状态以及物质含量比例取决于氯与氨的相对浓 度、pH值和温度 在各组分占不同比例的混合物中,其消毒效果有不同的表现,简单地说,主 要的消毒作用来白于次氯酸,氯胺的消毒作用来白于上述反应中维持平衡所不断 释放出来的次氯酸,因此,氯胺的消毒效果慢而持续。有实验证明,用氯消毒,5in 内可杀灭细菌达99%以上:而用氯胺时,相同条件卜,5nin内仅达60%,需要将水与 氯胺的接触时间延长到十儿小时,才能达到99%以上的灭南效果。当水中所含的氯 以氯胺形式存在时,称为化合 为此,可 将气 为两大类 白由性 毒(即C1,、HOC1与OCI厂)和化合性氯消毒。白山性氯的消毒效果比化合性氯高得 多,但是白山性氯消毒的持续性不如化合性氯,后者的持续消毒效果好。 (2》折点加氮法 水中加氯量,可以分为两部分,即需氯量和余氯。需氯量指用于灭活水中微生物」 氧化有机物和无机还原性物质等所消耗的氯当水中余氯为游离性余氯时,消毒过
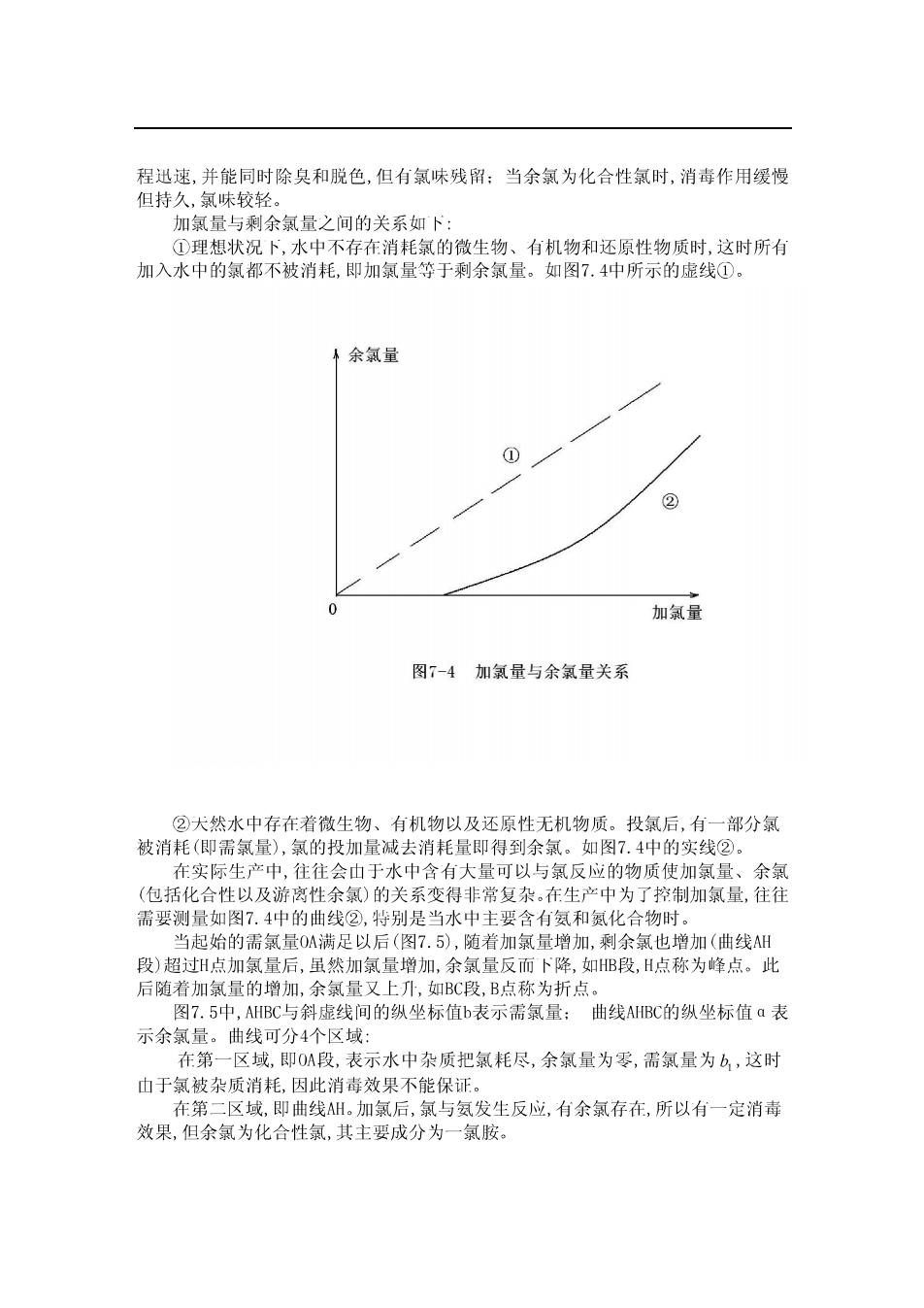
程迅速,并能同时除臭和脱色,但有氯味残留:当余氯为化合性氯时,消毒作用缓慢 但持久,氯味较轻。 加氯量与剩余氯量之间的关系如卜: ①理想状况卜,水中不存在消耗氯的微生物、有机物和还原性物质时,这时所有 加入水中的氯都不被消耗,即加氯量等于剩余氯量。 如图7.4中所示的虚线① 余氯量 ① 加氯量 图7-4加氯量与余氯量关系 ②大然水中存在若微生物、有机物以及还原性无机物质。投氯后,有一部分氯 被消耗(即需氯量),氯的投加量减去消耗量即得到余氯。如图7.4中的实线② 在实际生产中,往往会 于水中含有大量可以 氯反应的物质使加氯 量、余氯 (包括化合性以及游离性余氯)的关系变得非常复杂在生产中为了控制加氯量,往往 需要测量如图7.4中的曲线②,特别是当水中主要含有氨和氮化合物时。 当起始的需氯量0A满足以后(图7.5),随者加氯量增加,剩余氯也增加(曲线 段)超过H点加氯量后,虽然加氯量增加,余氯量反而卜降,如B段,H点称为峰点。此 后随着加氯量的增加,余氯量又上儿,如BC段,B点称为折点。 图7.5中,AHBC与斜虚线间的纵坐标值b表示需氯量:曲线AIBC的纵坐标值a表 示余氯量。曲线可分4个区域: 在第一区域,即O段,表示水中杂质把氯耗尽,余氯量为零,需氯量为,这时 山于氯被杂质消耗,因此消毒效果不能保证。 在第二区域,即曲线H。加氯后,氯与氨发生反应,有余氯存在,所以有一定消毒 效果,但余氯为化合性氯,其主要成分为一氯胺