
第15章 d区元素
第15章 d区元素

d 区元素的电子分别填充在 3d 亚层、4d 亚层和 5d 亚 层上 。 1996年2月德国科学家宣布发现112号元素, 使 第四过渡系的空格终于被添满
d 区元素的电子分别填充在 3d 亚层、4d 亚层和 5d 亚 层上 。 1996年2月德国科学家宣布发现112号元素, 使 第四过渡系的空格终于被添满

1.了解 d 区元素的通性,即 d 电子化学的特征; 3.掌握铬单质的特性与制备,三价铬与六价铬的转变; 4.了解钼和钨的简单化合物及同多酸、杂多酸的概念; 8.了解锌、镉、汞的单质及重要化合物。 7.掌握铜单质及其常见化合物,着重了解其歧化反应; 6.了解铁、钴、镍氧化还原性变化规律,掌握其氧化 物和氢氧化物性质; 5.掌握从软锰矿制备单质锰,锰的变价及其氧化性; 2.掌握钛单质、TiO2、TiCl4 的性质和制备,钛合金 的应用; 本章教学要求
1.了解 d 区元素的通性,即 d 电子化学的特征; 3.掌握铬单质的特性与制备,三价铬与六价铬的转变; 4.了解钼和钨的简单化合物及同多酸、杂多酸的概念; 8.了解锌、镉、汞的单质及重要化合物。 7.掌握铜单质及其常见化合物,着重了解其歧化反应; 6.了解铁、钴、镍氧化还原性变化规律,掌握其氧化 物和氢氧化物性质; 5.掌握从软锰矿制备单质锰,锰的变价及其氧化性; 2.掌握钛单质、TiO2、TiCl4 的性质和制备,钛合金 的应用; 本章教学要求
15.1 通性 Ageneral survey 15.10 过渡元素与CO形成的化合物 15.2 钛 Titanium 15.3 铬 Chromium 15.4 钼和钨 Molybdnum and tungsten 15.5 锰 Manganese 15.6 铁、钴、镍 Iron, cobalt and nickel 15.7 铜 Copper 15.8 贵金属元素的不活泼性和催化性能 Non-active and catalytical properties for the noble elements 15.9 锌、镉、汞 Zinc, cadmium and mercury
15.1 通性 Ageneral survey 15.10 过渡元素与CO形成的化合物 15.2 钛 Titanium 15.3 铬 Chromium 15.4 钼和钨 Molybdnum and tungsten 15.5 锰 Manganese 15.6 铁、钴、镍 Iron, cobalt and nickel 15.7 铜 Copper 15.8 贵金属元素的不活泼性和催化性能 Non-active and catalytical properties for the noble elements 15.9 锌、镉、汞 Zinc, cadmium and mercury

15.1 通性 A general survey 15.1.1 金属单质的物理性质 Physical properties of metallic elementary substance 15.1.2 无机颜料和化合物的颜色 Inorganic pigments and color of compounds
15.1 通性 A general survey 15.1.1 金属单质的物理性质 Physical properties of metallic elementary substance 15.1.2 无机颜料和化合物的颜色 Inorganic pigments and color of compounds

15.1.3 氧化态 Oxidation state 15.1.4 形成配位化合物 Formation of coordination compounds 15.1.5 过渡金属与工业催化 Transition metals and industrial catalysis
15.1.3 氧化态 Oxidation state 15.1.4 形成配位化合物 Formation of coordination compounds 15.1.5 过渡金属与工业催化 Transition metals and industrial catalysis

● 熔、沸点高,硬度、密度大的金属大都集中在这一区 ● 不少元素形成有颜色的化合物 ● 许多元素形成多种氧化态从而导致丰富的氧化还原行为 ● 形成配合物的能力比较强,包括形成经典的维尔纳配合物 和金属有机配合物 ● 参与工业催化过程和酶催化过程的能力强 d区元素显示出许多区别于主族元素的性质 d 区元素所有这些特征不同程度上与价层 d 电子的 存在有关,因而有人将 d 区元素的化学归结为 d 电子 的化学
● 熔、沸点高,硬度、密度大的金属大都集中在这一区 ● 不少元素形成有颜色的化合物 ● 许多元素形成多种氧化态从而导致丰富的氧化还原行为 ● 形成配合物的能力比较强,包括形成经典的维尔纳配合物 和金属有机配合物 ● 参与工业催化过程和酶催化过程的能力强 d区元素显示出许多区别于主族元素的性质 d 区元素所有这些特征不同程度上与价层 d 电子的 存在有关,因而有人将 d 区元素的化学归结为 d 电子 的化学
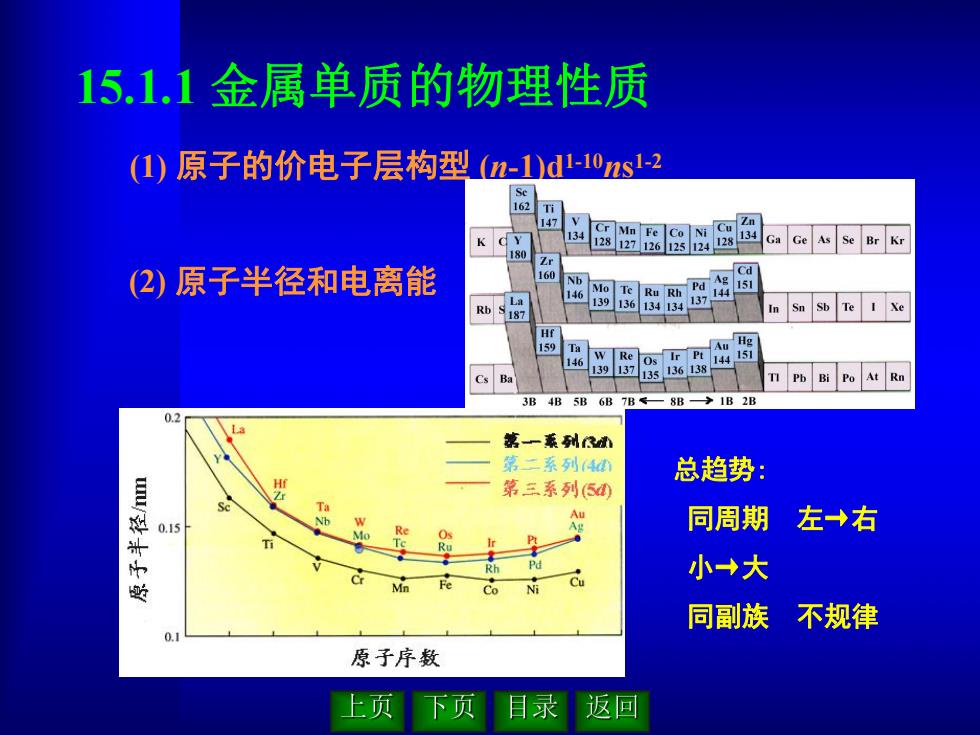
(1) 原子的价电子层构型 (n-1)d1-10ns 1-2 15.1.1 金属单质的物理性质 总趋势: 同周期 左→右 小→大 同副族 不规律 (2) 原子半径和电离能
(1) 原子的价电子层构型 (n-1)d1-10ns 1-2 15.1.1 金属单质的物理性质 总趋势: 同周期 左→右 小→大 同副族 不规律 (2) 原子半径和电离能

(3) 金属单质的物理性质 ●硬度大 硬度最大的金属:铬(Cr) 摩氏 9.0 ●导电性,导热性,延展性好 ●熔点、沸点高 熔点最高的单质: 钨(W) 3683±20℃ ●密度大 密度最大的单质: 锇(Os ) 22.48 g·cm-3
(3) 金属单质的物理性质 ●硬度大 硬度最大的金属:铬(Cr) 摩氏 9.0 ●导电性,导热性,延展性好 ●熔点、沸点高 熔点最高的单质: 钨(W) 3683±20℃ ●密度大 密度最大的单质: 锇(Os ) 22.48 g·cm-3
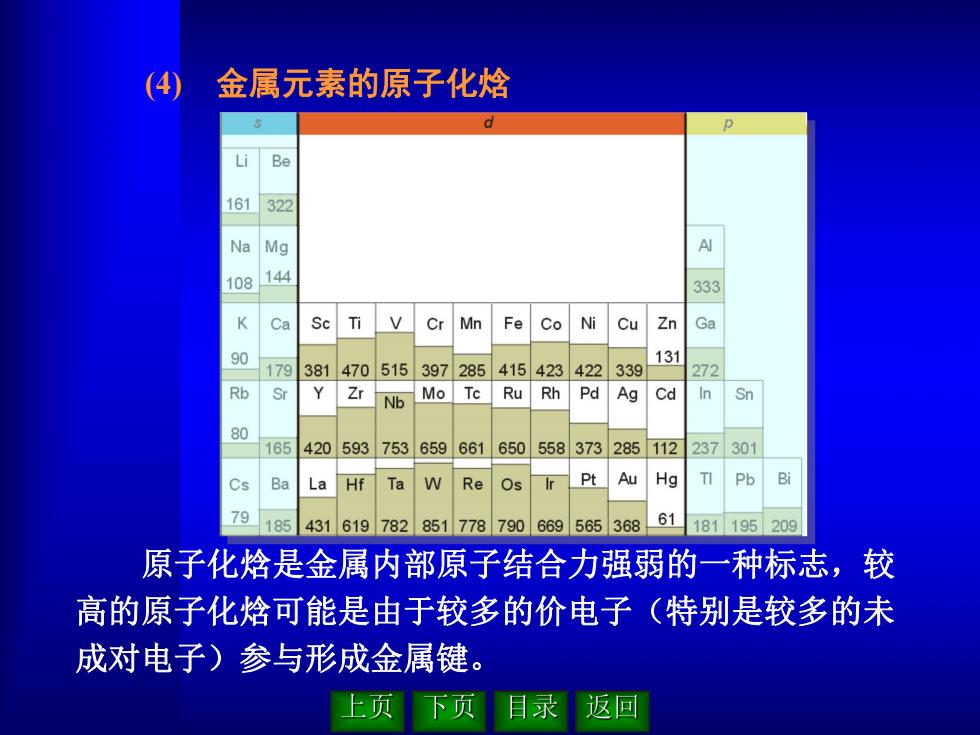
(4) 金属元素的原子化焓 原子化焓是金属内部原子结合力强弱的一种标志,较 高的原子化焓可能是由于较多的价电子(特别是较多的未 成对电子)参与形成金属键
(4) 金属元素的原子化焓 原子化焓是金属内部原子结合力强弱的一种标志,较 高的原子化焓可能是由于较多的价电子(特别是较多的未 成对电子)参与形成金属键