
第3章1 化学反应速率 研究化学反应进行方向和进 行程度的化学热力学,不涉及反 应时间问题
第 3 章 化学反应速率 研究化学反应进行方向和进 行程度的化学热力学,不涉及反 应时间问题

因此,它不能表示化学反应 进行的快慢,即化学反应速率的 大小
因此,它不能表示化学反应 进行的快慢,即化学反应速率的 大小

H2(g)+302(g)—H,0(1) △GR=-237.1kJ·mol-1 这个反应自发趋势很大,平衡 转化率极高。 但因其反应速率太小,将反应 物放在一起。常温下长时间看不到 产物生成
这个反应自发趋势很大,平衡 转化率极高。 但因其反应速率太小,将反应 物放在一起。常温下长时间看不到 产物生成。 H2(g)+ O2(g)—— H2O(l) = - 237.1 kJ • mol-1 rG ⊖ m 2 1

化学反应速率属于反应的现实 性问题,而研究反应现实性的分支 科学为化学动力学
化学反应速率属于反应的现实 性问题,而研究反应现实性的分支 科学为化学动力学

3.1 反应速率的定义 化学反应速率是指在一定 条件下反应物转变为生成物的 速率
3. 1 反应速率的定义 化学反应速率是指在一定 条件下反应物转变为生成物的 速率

化学反应速率经常用单位时 间内反应物浓度的减少或生成物 浓度的增加来表示。 浓度一般用mol•dm-3表示, 时间用s,min,h为单位来表示
化学反应速率经常用单位时 间内反应物浓度的减少或生成物 浓度的增加来表示。 浓度一般用 mol•dm-3表示, 时间用 s,min,h 为单位来表示

因而,常见的反应速率的单位有 mol·dm-3。s-1, mol·dm-3·min-1, mol·dm-3·h-1
因而,常见的反应速率的单位有 mol • dm-3 • s-1 , mol • dm-3 • min-1 , mol • dm-3 • h-1

3.1.1 平均速率 对于下面反应,测得不同时刻 的浓度数据 CHCOOC2Hs +OH- CHCOO+C2H5 OH
3. 1. 1 平均速率 CH3COOC2H5 + OH- —— CH3COO- + C2H5 OH 对于下面反应,测得不同时刻 的浓度数据

CHCOOC2Hs+OH- CHCOO+C2H5 OH tC(OH t2 c(OH t3 c(OH)3
t 1 c OH- ( )1 t 2 c OH- ( )2 CH3COOC2H5+ OH-—— CH3COO-+ C2H5 OH t 3 c OH- ( )3
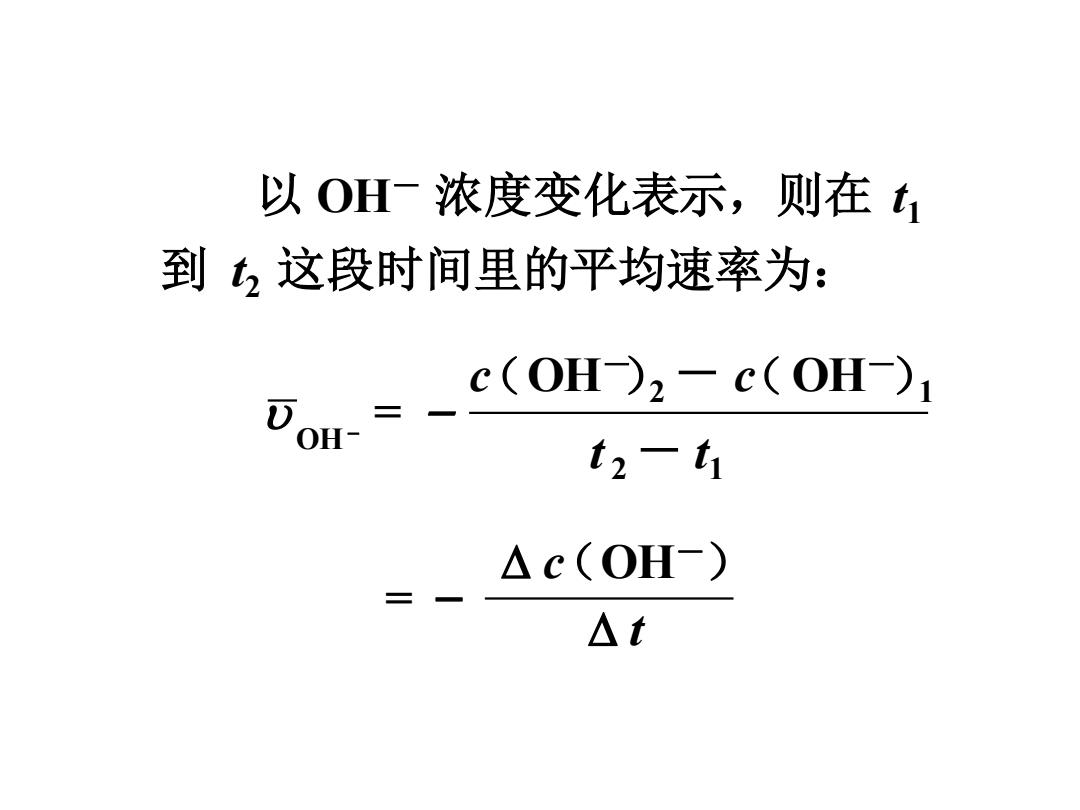
以OH一浓度变化表示,则在t 到这段时间里的平均速率为: = c(OH2-c(OH DoH- t2-t1 △c(OH-) 三 △t
以 OH- 浓度变化表示,则在 t1 到 t2 这段时间里的平均速率为: c OH- 2 - c OH- 1 t 2 - t1 OH- = - ( ) ( ) c OH- t = - ( )