
第8章1 酸碱解离平衡 1887年阿仑尼乌斯提出 电离学说,重新定义了酸碱
1887 年阿仑尼乌斯提出 电离学说,重新定义了酸碱。 第 8 章 酸碱解离平衡

在水中解离时所生成的阳离 子全部是氢离子的化合物叫酸; 解离时所生成的阴离子全部 是氢氧根离子的化合物叫碱
在水中解离时所生成的阳离 子全部是氢离子的化合物叫酸; 解离时所生成的阴离子全部 是氢氧根离子的化合物叫碱

阿仑尼乌斯认为电解质在 水溶液中是解离的,但解离都 是不完全的, 存在解离平衡
阿仑尼乌斯认为电解质在 水溶液中是解离的,但解离都 是不完全的, 存在解离平衡

这种观点对于弱电解质是 完全正确的。 但对于强电解质则表现出 局限性
这种观点对于弱电解质是 完全正确的。 但对于强电解质则表现出 局限性

现代结构理论和测试方法 均证明,像KCI这样的强电 解质在水中是完全解离的
现代结构理论和测试方法 均证明, 像 KCl 这样的强电 解质在水中是完全解离的

8.1 弱酸和弱碱的解离平衡 8.1.1 一元弱酸、弱碱的解离平衡 1.解离平衡常数 作为弱电解质的弱酸和弱碱在 水溶液中存在着解离平衡
8. 1 弱酸和弱碱的解离平衡 8. 1. 1 一元弱酸、弱碱的解离平衡 1. 解离平衡常数 作为弱电解质的弱酸和弱碱在 水溶液中存在着解离平衡

将醋酸的分子式CH,COOH 简写成HAc,其中Ac一代表醋酸 根CH,COO-。 则醋酸的解离平衡可表示成 HAc-H++Ac
将醋酸的分子式 CH3COOH 简写成 HAc,其中Ac- 代表醋酸 根 CH3COO-。 则醋酸的解离平衡可表示成 HAc H+ + Ac-

HAc -H++Ac 酸式解离的解离平衡常数用K日 表示,经常简写作K c(H)C(Ac) K c(HAc)
酸式解离的解离平衡常数用 表示,经常简写作 Ka。 K ⊖ a K a = c H+ c Ac- c HAc ( )( ) ( ) HAc H+ + Ac-
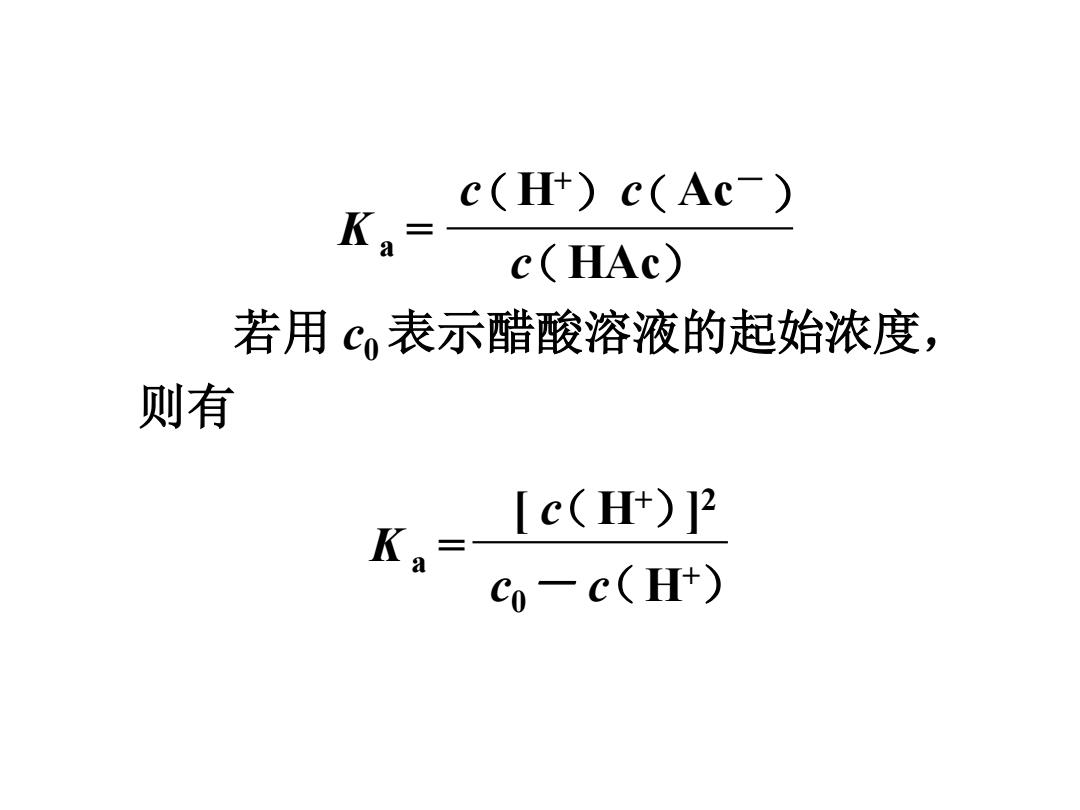
c(H)c(Ac K c(HAc) 若用c表示醋酸溶液的起始浓度, 侧有 [c(H+)]2 K= co-cH+
若用 c0 表示醋酸溶液的起始浓度, 则有 K a = c H+ c Ac- c HAc ( )( ) ( ) K a = c0- c (H+) [ c H+ ] ( )2

解该一元二次方程,可以在 已知弱酸的起始浓度和平衡常数 的前提下,求出溶液的c(H+)
解该一元二次方程,可以在 已知弱酸的起始浓度和平衡常数 的前提下,求出溶液的 c(H+)