
《无机化学及实验》理论课程教学大纲 一、课程基本信息 课程编码:084106B 中文名称:无机化学①) 英文名称:Inorganic Chemistry 课程类别:专业基础课程 总学时:45(理论学时) 总学分:3 适用专业:材料科学与工程专业 先修课程:高中化学、高等数学 开课系部:应用化学系 二、理论教学课程的性质、目标和任务 《无机化学》课程是材料科学与工程专业必修的一门专业技术基础课。通过本课程的学 习,使学生了解无机化学的研究对象和发展趋势,以及其在化学学科中的地位:掌握化学基 本概念和定律、化学四大平衡、热力学、化学反应速度、原子结构和元素周期系、分子结构 和晶体结构等:培养学生具有分析处理一般无机化学问题的初步能力以及应用参考资料自学 一般无机化学书刊、获取新知识的能力,提高学生的实践能力和创新能力。为学生学习后续 课程做好准备,使得学生初步具有在材料科学与工程企业从事生产操作与工艺控制的能力并 且为学生在以后不同材料加工单元操作,材料加工过程与设备,工艺与设备的制图与设计知 识,材料安全生产的新技术、新方法和发展趋势等方面打下比较坚实的基础。 三、理论教学课程教学基本要求 1.教学内容要着眼于为学生今后发展奠定基础,强调的应是无机化学教学中最基础的内容 (不是专业选修课,更不是研究生课程内容的下放 2.无机化学的教学不只是传授无机化学知识(基础的,前沿的),更要传授获取知识的方 法和思想,培养学生的创新意识和科学品质,使学生具备潜在的发展能力和基础(继续学 习的能力,表述和应用知识的能力,发展和创造知识的能力)。 3.基础知识必须充分重视,但其内涵应随着时代的演进、科技的进步、学科的发展、社会 的需要而有所变化。 4.教学中要提倡因材施教,课课堂内外相辅相成,适当减少课堂讲授,辅以讨论、讲坐等 丰富多彩的课外活动。 四、课程教学内容及要求
《无机化学及实验》理论课程教学大纲 一、课程基本信息 课程编码:084106B 中文名称:无机化学(I) 英文名称:Inorganic Chemistry 课程类别:专业基础课程 总 学 时:45(理论学时) 总 学 分:3 适用专业:材料科学与工程专业 先修课程:高中化学、高等数学 开课系部:应用化学系 二、理论教学课程的性质、目标和任务 《无机化学》课程是材料科学与工程专业必修的一门专业技术基础课。通过本课程的学 习,使学生了解无机化学的研究对象和发展趋势,以及其在化学学科中的地位;掌握化学基 本概念和定律、化学四大平衡、热力学、化学反应速度、原子结构和元素周期系、分子结构 和晶体结构等;培养学生具有分析处理一般无机化学问题的初步能力以及应用参考资料自学 一般无机化学书刊、获取新知识的能力,提高学生的实践能力和创新能力。为学生学习后续 课程做好准备,使得学生初步具有在材料科学与工程企业从事生产操作与工艺控制的能力并 且为学生在以后不同材料加工单元操作,材料加工过程与设备,工艺与设备的制图与设计知 识,材料安全生产的新技术、新方法和发展趋势等方面打下比较坚实的基础。 三、理论教学课程教学基本要求 1.教学内容要着眼于为学生今后发展奠定基础,强调的应是无机化学教学中最基础的内容 (不是专业选修课,更不是研究生课程內容的下放 2.无机化学的教学不只是传授无机化学知识(基础的,前沿的),更要传授获取知识的方 法和思想,培养学生的创新意识和科学品质,使学生具备潜在的发展能力和基础(继续学 习的能力,表述和应用知识的能力,发展和创造知识的能力)。 3.基础知识必须充分重视,但其內涵应随着时代的演进、科技的进步、学科的发展、社会 的需要而有所变化。 4.教学中要提倡因材施教,课课堂内外相辅相成,适当减少课堂讲授,辅以讨论、讲坐等 丰富多彩的课外活动。 四、课程教学内容及要求

绪论(1学时) 【教学目标与要求】 1.结合无机化学的最新进展: 2.介绍无机化学的研究对象、目的和任务。 【教学重点与难点】 1.无机化学的任务、最新发展方向及应用 2.化学发展简史 【教学内容】 1.化学研究的对象和内容 2.化学发展简史 3.无机化学简介 4.如何学好无机化学 第一章化学基础知识(2学时) 【教学目标与要求】 1.掌握理想气体状态方程及其应用、分压定律和扩散定律: 2.掌握液体蒸气压和沸点的概念: 3.了解实际气体状态方程、气体分子运动论、晶体内部结构: 4.理解气体分子的速率分布和能量分布: 5.掌握溶液浓度的几种表示方法,了解温度对溶解度的影响: 6.掌握溶液浓度的几种表示方法,了解温度对溶解度的影响: 7.理解和掌握非电介质稀溶液的蒸气压下降、沸点升高、凝固点下降、渗透压等依数性, 能够进行相关的计算: 【教学重点与难点】 1.理想气体状态方程及其应用,分压定律和扩散定律,晶体内部,结构难挥发非电介质稀 溶液的蒸气压下降(拉乌尔定律),沸点升高,凝固点下降 2.气体分子运动论 【教学内容】 1.1气体
绪论(1 学时) 【教学目标与要求】 1. 结合无机化学的最新进展; 2.介绍无机化学的研究对象、目的和任务。 【教学重点与难点】 1.无机化学的任务、最新发展方向及应用 2.化学发展简史 【教学内容】 1. 化学研究的对象和内容 2.化学发展简史 3. 无机化学简介 4. 如何学好无机化学 第一章 化学基础知识(2 学时) 【教学目标与要求】 1. 掌握理想气体状态方程及其应用、分压定律和扩散定律; 2. 掌握液体蒸气压和沸点的概念; 3. 了解实际气体状态方程、气体分子运动论、晶体内部结构; 4. 理解气体分子的速率分布和能量分布; 5. 掌握溶液浓度的几种表示方法,了解温度对溶解度的影响; 6. 掌握溶液浓度的几种表示方法,了解温度对溶解度的影响; 7. 理解和掌握非电介质稀溶液的蒸气压下降、沸点升高、凝固点下降、渗透压等依数性, 能够进行相关的计算; 【教学重点与难点】 1.理想气体状态方程及其应用,分压定律和扩散定律,晶体内部,结构难挥发非电介质稀 溶液的蒸气压下降(拉乌尔定律),沸点升高,凝固点下降 2.气体分子运动论 【教学内容】 1.1 气体

1.1.1理想气体和实际气体状态方程 1.1.2混合气体分压定律 1.1.3气体扩散定律、气体分子的速率分布和能量分布 1.2液体和溶液 1.2.1溶液浓度表示方法 1.2.2溶液的饱和蒸汽压 12.3非电解质稀溶液的依数性:难挥发非电介质稀溶液的蒸气压下降(拉乌尔定律),沸 点升高,凝固点下降、渗透压及其根据公式计算常数的变化,或者根据沸点、凝固点、渗 透压的变化计算物质的分子量 1.3固体和晶体 1.3.1晶体和非晶体 1.3.2对称性 1.3.3晶体和点阵 第二章化学热力学基础(6学时) 【教学目标与要求】 1.掌握热力学的一些基本概念,如系统、环境、状态函数、强度性质、广延性质、功、热 及过程等。熟悉热力学标准状态的定义和意义,理解状态函数的基本特征: 2.掌握用标准摩尔生成焓、标准摩尔燃烧焓计算化学反应热的方法,特别要掌握根据盖斯 定律或利用状态函数的基本特征,设计过程,计算化学反应热的方法及计算公式的使用条 件: 3.学会用吉布斯自由能变化△Gm判断标准状况下等温等压化学反应的方向,利用实际 △G判断所给状况下反应进行的方向:学会通过吉布斯函数来判断化学反应控制的温度以 及实际发生化学反应的情况,根据计算,利用理论来指导化合物的合成以及选择最优势的 合成条件。 【教学重点与难点】 1.掌握热力学第一定律及它对恒压只做体积功、恒容只做体积功过程的应用:盖斯定律及 化学反应热的计算:吉布斯自由能变化△Gm与化学反应方向的判断 2.状态函数,反应热的计算,吉布斯自由能,化学反应方向的判断 【教学内容】
1.1.1 理想气体和实际气体状态方程 1.1.2 混合气体分压定律 1.1.3 气体扩散定律、气体分子的速率分布和能量分布 1.2 液体和溶液 1.2.1 溶液浓度表示方法 1.2.2 溶液的饱和蒸汽压 1.2.3 非电解质稀溶液的依数性:难挥发非电介质稀溶液的蒸气压下降(拉乌尔定律),沸 点升高,凝固点下降、渗透压及其根据公式计算常数的变化,或者根据沸点、凝固点、渗 透压的变化计算物质的分子量 1.3 固体和晶体 1.3.1 晶体和非晶体 1.3.2 对称性 1.3.3 晶体和点阵 第二章 化学热力学基础(6 学时) 【教学目标与要求】 1. 掌握热力学的一些基本概念,如系统、环境、状态函数、强度性质、广延性质、功、热 及过程等。熟悉热力学标准状态的定义和意义,理解状态函数的基本特征; 2. 掌握用标准摩尔生成焓、标准摩尔燃烧焓计算化学反应热的方法,特别要掌握根据盖斯 定律或利用状态函数的基本特征,设计过程,计算化学反应热的方法及计算公式的使用条 件; 3. 学会用吉布斯自由能变化 ΔrGm ф判断标准状况下等温等压化学反应的方向,利用实际 ΔrGm判断所给状况下反应进行的方向;学会通过吉布斯函数来判断化学反应控制的温度以 及实际发生化学反应的情况,根据计算,利用理论来指导化合物的合成以及选择最优势的 合成条件。 【教学重点与难点】 1.掌握热力学第一定律及它对恒压只做体积功、恒容只做体积功过程的应用;盖斯定律及 化学反应热的计算;吉布斯自由能变化 ΔrGm与化学反应方向的判断 2.状态函数,反应热的计算,吉布斯自由能,化学反应方向的判断 【教学内容】

2.1热力学第一定律 2.1.1热力学常用术语 2.1.2热力学第一定律:系统和环境,状态和状态函数,过程和过程变量,热和功:热力学 能和焓: 2.2热化学 2.2.1化学反应热效应:恒容过程和恒压过程 2.2.2盖斯定律:热化学方程式 2.2.3生成热:生成焓与标准生成焓 2.2.4燃烧热:燃烧焓 2.2.5从键能估算反应热:化学反应热的有关计算 2.3化学反应的方向 2.3.1反应进行的方式 2.3.2反应进行的方向:反应方向的概念 2.3.3反应焓变对反应方向的影响 2.3.4状态函数一熵:系统的混乱度,熵,热力学第二定律,热力学第三定律 2.35吉布斯自由能:吉布斯自由能判据,标准摩尔生成吉布斯自由能 第三章化学反应速率(4学时) 【教学目标与要求】 1.掌握反应速率的意义及速率方程表达式: 2.理解碰撞理论、过渡态理论: 3.熟悉实验活化能及速率常数的计算: 4.理解对化学反应速率、基元反应、复杂反应、反应级数、反应分子数、活化能等概念: 熟悉一级反应及半衰期的计算,了解零级、二级、三级反应:能运用质量作用定律对基元 反应的反应速率进行有关的计算:能利用Arrhenius经验公式进行有关的计算: 5.掌握浓度、温度、催化剂对反应速率的影响。根据Arrhenius经验公式求算反应的活化 能及不同温度下的速率常数。 【教学重点与难点】 L.Arrhenius经验公式与活化能和速率常数的计算,浓度、温度、催化剂对反应速率的影 响
2.1 热力学第一定律 2.1.1 热力学常用术语 2.1.2 热力学第一定律:系统和环境,状态和状态函数,过程和过程变量,热和功;热力学 能和焓; 2.2 热化学 2.2.1 化学反应热效应:恒容过程和恒压过程 2.2.2 盖斯定律:热化学方程式 2.2.3 生成热:生成焓与标准生成焓 2.2.4 燃烧热:燃烧焓 2.2.5 从键能估算反应热:化学反应热的有关计算 2.3 化学反应的方向 2.3.1 反应进行的方式 2.3.2 反应进行的方向:反应方向的概念 2.3.3 反应焓变对反应方向的影响 2.3.4 状态函数—熵:系统的混乱度,熵,热力学第二定律,热力学第三定律 2.3.5 吉布斯自由能:吉布斯自由能判据,标准摩尔生成吉布斯自由能 第三章 化学反应速率(4 学时) 【教学目标与要求】 1. 掌握反应速率的意义及速率方程表达式; 2. 理解碰撞理论、过渡态理论; 3. 熟悉实验活化能及速率常数的计算; 4. 理解对化学反应速率、基元反应、复杂反应、反应级数、反应分子数、活化能等概念; 熟悉一级反应及半衰期的计算,了解零级、二级、三级反应;能运用质量作用定律对基元 反应的反应速率进行有关的计算;能利用 Arrhenius 经验公式进行有关的计算; 5. 掌握浓度、温度、催化剂对反应速率的影响。根据 Arrhenius 经验公式求算反应的活化 能及不同温度下的速率常数。 【教学重点与难点】 1. Arrhenius 经验公式与活化能和速率常数的计算,浓度、温度、催化剂对反应速率的影 响

2.反应级数,影响化学反应速率的因素 【教学内容】 3.1反应速率的概念 3.1.1平均速率 3.1.2瞬时速率 3.2反应速率和反应物浓度的关系:浓度对反应速率的影响,反应的分子数和反应级数, 速率常数,反应速率的质量作用定律 3.3反应机理:基元反应 3.4反应物浓度与时间的关系:零级,一级,二级反应 3.5化学反应速率理论简介:活化能,碰撞理论,过渡状态理论 3.6影响反应速率的因素:Arrhenius经验公式,表观活化能:温度对反应速率的影响: 催化剂对反应速率的影响 第四章化学平衡(5学时) 【教学目标与要求】 1.理解平衡常数K的意义及其与吉布斯自由能(△Gm)的关系,△Gm◆=一RTlnK,利 用公式计算平衡常数或△Gm: 2.掌握化学反应等温式,Van't Hoff方程△,G=△Gm+RTnQ的意义及其相关的计算与应 用。利用函数△Gm或△G判断标准态及非标准态下化学反应的方向性: 3.掌握QK作为过程判据的方法: 4.掌握温度、压力、浓度、催化剂对化学平衡移动的影响以及平衡移动原理,能够根据条 件的变化判断化学反应的移动。 【教学重点与难点】 l.平衡常数心与吉布斯自由能(△Gm)的关系及相关计算,Van't Hoff方程△.G=△Gm· +RTnQ的应用 2.化学反应方向的判据,化学平衡的移动 【教学内容】 4.1化学平衡状态:化学反应的可逆性和化学平衡 4.1.1经验平衡常数 4.1.2平衡常数和平横转化率
2.反应级数,影响化学反应速率的因素 【教学内容】 3.1 反应速率的概念 3.1.1 平均速率 3.1.2 瞬时速率 3.2 反应速率和反应物浓度的关系:浓度对反应速率的影响,反应的分子数和反应级数, 速率常数,反应速率的质量作用定律 3.3 反应机理:基元反应 3.4 反应物浓度与时间的关系:零级,一级,二级反应 3.5 化学反应速率理论简介:活化能,碰撞理论,过渡状态理论 3.6 影响反应速率的因素: Arrhenius 经验公式,表观活化能;温度对反应速率的影响; 催化剂对反应速率的影响 第四章 化学平衡(5 学时) 【教学目标与要求】 1. 理解平衡常数 K ф的意义及其与吉布斯自由能(ΔrGm ф)的关系,ΔrGm ф=-RTlnK ф,利 用公式计算平衡常数 K ф或 ΔrGm ф; 2. 掌握化学反应等温式,Van't Hoff 方程 ΔrG=ΔrGm ф+RTlnQ 的意义及其相关的计算与应 用。利用函数 ΔrGm ф或 ΔrG 判断标准态及非标准态下化学反应的方向性; 3. 掌握 Q/K ф作为过程判据的方法; 4. 掌握温度、压力、浓度、催化剂对化学平衡移动的影响以及平衡移动原理,能够根据条 件的变化判断化学反应的移动。 【教学重点与难点】 1.平衡常数 K ф与吉布斯自由能(ΔrGm ф)的关系及相关计算,Van't Hoff 方程 ΔrG=ΔrGm ф +RTlnQ 的应用 2.化学反应方向的判据,化学平衡的移动 【教学内容】 4.1 化学平衡状态:化学反应的可逆性和化学平衡 4.1.1 经验平衡常数 4.1.2 平衡常数和平横转化率

4.2化学反应进行的方向 4.2.1标准平衡常数,平衡常数与化学反应的程度, 4.2.2标准平衡常数与化学反应的方向 4.3标准平衡常数心与△Gm的关系 4.3.1化学反应等温式 4.4化学平衡的移动:浓度、压强、温度对化学平衡的影响 第五章原子结构与元素周期律(6学时) 【教学目标与要求】 1.从氢原子光谱了解能级的概念: 2.了解原子核外电子运动的近代概念: 3.掌握四个量子数对核外电子运动状态的描述: 4.熟悉s、p、d原子轨道和电子云的形状和伸展方向: 5.掌握周期系内各元素原子的核外电子层结构的特征,电子排布规律,并结合原子系数, 熟悉元素性质周期性变化规律。 【教学重点与难点】 1.s、p、d原子轨道,四个量子数与核外电子运动状态,核外电子排布规律及价电子层 结构特征 2.波函数和原子轨道,几率分布和电子云,四个量子数的含义及关系,多电子原子能级 图,能级交错,屏蔽效应与有效核电荷,钻穿效应,电离能,电子亲和能,电负性 【教学内容】 5.1近代原子结构理论的确立 5.1.1原子结构模型 5.1.2氢原子光谱:能级的概念:量子化的概念 5.1.3玻尔理论 5.2微观粒子运动的特殊性 5.2.1微观粒子运动的波粒二象性 5.2.2不确定原理 5.2.3微观粒子运动的统计规律 5.3核外电子运动状态的描述
4.2 化学反应进行的方向 4.2.1 标准平衡常数,平衡常数与化学反应的程度, 4.2.2 标准平衡常数与化学反应的方向 4.3 标准平衡常数 K ф与 ΔrGm ф的关系 4.3.1 化学反应等温式 4.4 化学平衡的移动:浓度、压强、温度对化学平衡的影响 第五章 原子结构与元素周期律(6 学时) 【教学目标与要求】 1. 从氢原子光谱了解能级的概念; 2. 了解原子核外电子运动的近代概念; 3. 掌握四个量子数对核外电子运动状态的描述; 4. 熟悉 s、p、d 原子轨道和电子云的形状和伸展方向; 5. 掌握周期系内各元素原子的核外电子层结构的特征,电子排布规律,并结合原子系数, 熟悉元素性质周期性变化规律。 【教学重点与难点】 1. s、p、d 原子轨道,四个量子数与核外电子运动状态,核外电子排布规律及价电子层 结构特征 2. 波函数和原子轨道,几率分布和电子云,四个量子数的含义及关系,多电子原子能级 图,能级交错,屏蔽效应与有效核电荷,钻穿效应,电离能,电子亲和能,电负性 【教学内容】 5.1 近代原子结构理论的确立 5.1.1 原子结构模型 5.1.2 氢原子光谱:能级的概念;量子化的概念 5.1.3 玻尔理论 5.2 微观粒子运动的特殊性 5.2.1 微观粒子运动的波粒二象性 5.2.2 不确定原理 5.2.3 微观粒子运动的统计规律 5.3 核外电子运动状态的描述

5.3.1薛定谔方程(只列出公式) 5.3.2四个量子数 5.3.3用图形描述核外电子的运动状态:波函数和原子轨道:波函数的角度分布图(示例的 角度分布作图方法):概率密度和电子云:电子云的角度分布图:波函数和电子云的径向 分布图: 5.4核外电子的排布 5.4.1影响轨道能量的因素 5.4.2多电子原子能级:近似能级图 5.4.3核外电子的排布:能量最低原理,泡利不相容原理,洪特规则:屏蔽效应和钻穿效应 5.5元素周期表 5.5.1元素的周期 5.5.2元素的族 5.5.3元素的分区 5.6元素基本性质的周期性:有效核电荷:原子半径:电离能:电子亲和能:电负性 第六章分子结构和共价键理论(6学时) 【教学目标与要求】 1.理解并掌握共价键的饱和性和方向性及σ键和π键的区别: 2.掌握杂化轨道理论的要点,并说明一些分子的构型: 3.掌握分子轨道理论的基本要点:掌握同核双原子分子和异核双原子分子的分子轨道式及 能级图:应用同核双原子分子的分子轨道能级图说明分子的磁性、稳定性和键级: 【教学重点与难点】 1.共价键的本质,共价键的饱和性和方向性,杂化轨道类型,分子轨道能级图,分子轨道 式,分子间力 2.杂化轨道理论,σ键和π键特征,成键与反键轨道,价层电子对互斥理论,极化作用 【教学内容】 6.1路易斯理论 62价键理论:共价键的本质,共价键的饱和性和方向性,原子轨道的重叠 6.3杂化轨道理论 6.3.1杂化轨道概念
5.3.1 薛定谔方程(只列出公式) 5.3.2 四个量子数 5.3.3 用图形描述核外电子的运动状态:波函数和原子轨道;波函数的角度分布图(示例的 角度分布作图方法);概率密度和电子云;电子云的角度分布图;波函数和电子云的径向 分布图; 5.4 核外电子的排布 5.4.1 影响轨道能量的因素 5.4.2 多电子原子能级:近似能级图 5.4.3 核外电子的排布:能量最低原理,泡利不相容原理,洪特规则;屏蔽效应和钻穿效应 5.5 元素周期表 5.5.1 元素的周期 5.5.2 元素的族 5.5.3 元素的分区 5.6 元素基本性质的周期性:有效核电荷;原子半径;电离能;电子亲和能;电负性 第六章 分子结构和共价键理论(6 学时) 【教学目标与要求】 1. 理解并掌握共价键的饱和性和方向性及 σ 键和 π 键的区别; 2. 掌握杂化轨道理论的要点,并说明一些分子的构型; 3. 掌握分子轨道理论的基本要点;掌握同核双原子分子和异核双原子分子的分子轨道式及 能级图;应用同核双原子分子的分子轨道能级图说明分子的磁性、稳定性和键级; 【教学重点与难点】 1.共价键的本质,共价键的饱和性和方向性,杂化轨道类型,分子轨道能级图,分子轨道 式,分子间力 2.杂化轨道理论,σ 键和 π 键特征,成键与反键轨道,价层电子对互斥理论,极化作用 【教学内容】 6.1 路易斯理论 6.2 价键理论:共价键的本质,共价键的饱和性和方向性,原子轨道的重叠 6.3 杂化轨道理论 6.3.1 杂化轨道概念

6.3.2杂化轨道类型、要点,等性杂化与不等性杂化 6.4价层电子对互斥理论:判断共价分子结构的一般规则 6.4.1中心价层电子的总数和对数 6.4.2电子对数和电子对空间构型的关系 6.4.3分子构型和电子对空间构型的关系 6.5分子轨道理论 6.5.1基本要点 6.5.2原子轨道线性组合三原则:对称性匹配,能量相近,轨道最大重叠 6.5.3分子轨道中的电子排布:成键分子轨道和反键分子轨道,同核双原子分子的分子轨道 能级图,异核双原子分子及多原子的分子轨道能级图,键参数(键能,键长,键角,键 级) 第七章晶体结构(5学时) 【教学目标与要求】 1.掌握离子晶体、原子晶体、分子晶体和金属晶体的内部结构与性质的关系: 2.从晶格质点上粒子间结合力的不同来理解晶体的类型,掌握四种典型的离子晶体的结构 特征和晶格配位数: 3.理解离子极化对晶体键型、配位数、溶解度和颜色的影响: 4.掌握分子的极性,分子间力(取向力、诱导力、色散力、范德华力)及氢键的要领并解 释物质的性质。 5.掌握离子极化作用要领并能运用离子极化作用解释化合物结构和物质的性质。 【教学重点与难点】 1分子间作用力:取向力,诱导力,色散力:离子键特征,离子极化作用,离子极化作用 对化合物结构和性质的影响 2.离子极化作用,离子极化作用对化合物结构和性质的影响 【教学内容】 7.1分子晶体和分子间作用力 7.1.1分子的极性 7.1.2分子间作用力:取向力,诱导力,色散力 7.1.3次级键和氢键
6.3.2 杂化轨道类型、要点,等性杂化与不等性杂化 6.4 价层电子对互斥理论:判断共价分子结构的一般规则 6.4.1 中心价层电子的总数和对数 6.4.2 电子对数和电子对空间构型的关系 6.4.3 分子构型和电子对空间构型的关系 6.5 分子轨道理论 6.5.1 基本要点 6.5.2 原子轨道线性组合三原则:对称性匹配,能量相近,轨道最大重叠 6.5.3 分子轨道中的电子排布:成键分子轨道和反键分子轨道,同核双原子分子的分子轨道 能级图,异核双原子分子及多原子的分子轨道能级图,键参数(键能,键长,键角,键 级) 第七章 晶体结构(5 学时) 【教学目标与要求】 1. 掌握离子晶体、原子晶体、分子晶体和金属晶体的内部结构与性质的关系; 2. 从晶格质点上粒子间结合力的不同来理解晶体的类型,掌握四种典型的离子晶体的结构 特征和晶格配位数; 3. 理解离子极化对晶体键型、配位数、溶解度和颜色的影响; 4. 掌握分子的极性,分子间力(取向力、诱导力、色散力、范德华力)及氢键的要领并解 释物质的性质。 5. 掌握离子极化作用要领并能运用离子极化作用解释化合物结构和物质的性质。 【教学重点与难点】 1.分子间作用力:取向力,诱导力,色散力;离子键特征,离子极化作用,离子极化作用 对化合物结构和性质的影响 2. 离子极化作用,离子极化作用对化合物结构和性质的影响 【教学内容】 7.1 分子晶体和分子间作用力 7.1.1 分子的极性 7.1.2 分子间作用力:取向力,诱导力,色散力 7.1.3 次级键和氢键

7.2离子晶体和离子键 7.2.1离子键的形成 7.2.2离子键的性质 7.2.3离子键的强度 7.2.4离子键的特征:离子的电荷,电子层构型,离子半径 7.2.5离子晶体 7.3离子极化 7.3.1离子极化作用 7.3.2离子极化作用对化合物结构和性质的影响 7.4金属晶体和金属键:金属键的改性共价键理论,金属键的能带理论 7.5原子晶体和混合晶体 第八章酸碱解离平衡(6学时) 【教学目标与要求】 1.了解强电解质溶液的离子强度和活度,了解酸碱理论: 2.理解影响盐水解的因素: 3.掌握弱酸、弱碱的解离平衡,水的离子积和溶液的pH值的计算:掌握弱酸强碱盐、强 酸弱碱盐、弱酸弱碱盐、弱酸酸式盐溶液pH值的计算。 【教学重点与难点】 1.弱酸、弱碱的解离平衡,水的离子积和溶液pH值的计算:弱酸强碱盐、强酸弱碱盐、 弱酸弱碱盐、弱酸酸式盐溶液pH值的计算 2离子强度,活度,缓冲溶液,盐的水解,离子效应,酸碱理论 【教学内容】 81弱酸、弱碱的解离平衡 8.1.1一元弱酸、弱碱的解离平衡 8.1.2水的离子积和溶液的pH值 8.1.3多元弱酸解离平衡 8.1.4缓冲溶液 8.2盐的水解 8.2.1水解平衡常数:弱酸强碱盐、强酸弱碱盐、弱酸弱碱盐
7.2 离子晶体和离子键 7.2.1 离子键的形成 7.2.2 离子键的性质 7.2.3 离子键的强度 7.2.4 离子键的特征:离子的电荷,电子层构型,离子半径 7.2.5 离子晶体 7.3 离子极化 7.3.1 离子极化作用 7.3.2 离子极化作用对化合物结构和性质的影响 7.4 金属晶体和金属键 :金属键的改性共价键理论,金属键的能带理论 7.5 原子晶体和混合晶体 第八章 酸碱解离平衡(6 学时) 【教学目标与要求】 1. 了解强电解质溶液的离子强度和活度,了解酸碱理论; 2. 理解影响盐水解的因素; 3. 掌握弱酸、弱碱的解离平衡,水的离子积和溶液的 pH 值的计算;掌握弱酸强碱盐、强 酸弱碱盐、弱酸弱碱盐、弱酸酸式盐溶液 pH 值的计算。 【教学重点与难点】 1.弱酸、弱碱的解离平衡,水的离子积和溶液 pH 值的计算;弱酸强碱盐、强酸弱碱盐、 弱酸弱碱盐、弱酸酸式盐溶液 pH 值的计算 2.离子强度,活度,缓冲溶液,盐的水解, 离子效应, 酸碱理论 【教学内容】 8.1 弱酸、弱碱的解离平衡 8.1.1 一元弱酸、弱碱的解离平衡 8.1.2 水的离子积和溶液的 pH 值 8.1.3 多元弱酸解离平衡 8.1.4 缓冲溶液 8.2 盐的水解 8.2.1 水解平衡常数:弱酸强碱盐、强酸弱碱盐、弱酸弱碱盐
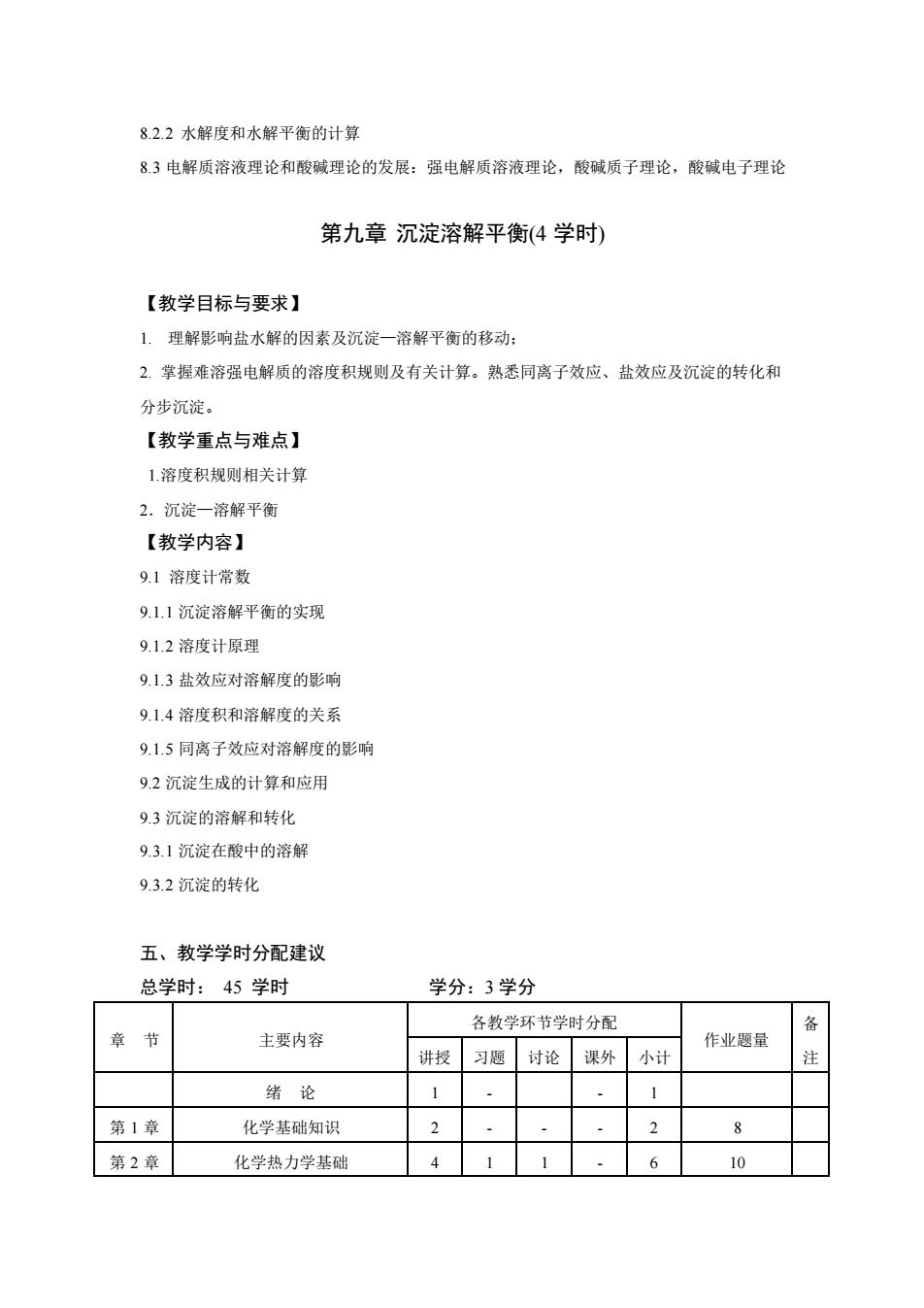
8.2.2水解度和水解平衡的计算 83电解质溶液理论和酸碱理论的发展:强电解质溶液理论,酸碱质子理论,酸碱电子理论 第九章沉淀溶解平衡(4学时) 【教学目标与要求】 1.理解影响盐水解的因素及沉淀一溶解平衡的移动: 2.掌握难溶强电解质的溶度积规则及有关计算。熟悉同离子效应、盐效应及沉淀的转化和 分步沉淀。 【教学重点与难点】 1.溶度积规则相关计算 2.沉淀一溶解平衡 【教学内容】 9.1溶度计常数 9.1.1沉淀溶解平衡的实现 9.1.2溶度计原理 9.1.3盐效应对溶解度的影响 9.1.4溶度积和溶解度的关系 9.1.5同离子效应对溶解度的影响 9.2沉淀生成的计算和应用 9.3沉淀的溶解和转化 9.3.1沉淀在酸中的溶解 9.3.2沉淀的转化 五、教学学时分配建议 总学时:45学时 学分:3学分 各教学环节学时分配 备 章节 主要内容 作业题量 讲授 习题 讨论 课外 小计 注 绪论 1 1 第1章 化学基础知识 2 2 8 第2章 化学热力学基础 4 6 10
8.2.2 水解度和水解平衡的计算 8.3 电解质溶液理论和酸碱理论的发展:强电解质溶液理论,酸碱质子理论,酸碱电子理论 第九章 沉淀溶解平衡(4 学时) 【教学目标与要求】 1. 理解影响盐水解的因素及沉淀—溶解平衡的移动; 2. 掌握难溶强电解质的溶度积规则及有关计算。熟悉同离子效应、盐效应及沉淀的转化和 分步沉淀。 【教学重点与难点】 1.溶度积规则相关计算 2.沉淀—溶解平衡 【教学内容】 9.1 溶度计常数 9.1.1 沉淀溶解平衡的实现 9.1.2 溶度计原理 9.1.3 盐效应对溶解度的影响 9.1.4 溶度积和溶解度的关系 9.1.5 同离子效应对溶解度的影响 9.2 沉淀生成的计算和应用 9.3 沉淀的溶解和转化 9.3.1 沉淀在酸中的溶解 9.3.2 沉淀的转化 五、教学学时分配建议 总学时: 45 学时 学分:3 学分 章 节 主要内容 各教学环节学时分配 作业题量 备 讲授 习题 讨论 课外 小计 注 绪 论 1 - - 1 第 1 章 化学基础知识 2 - - - 2 8 第 2 章 化学热力学基础 4 1 1 - 6 10