
运城学院 《无机化学》 课程教学大纲 应用化学系 2022年编制
运城学院 《无机化学》 课程教学大纲 应用化学系 2022 年编制

一、课程基本信息 课程名称:(中文):无机化学I (英文):Inorganic Chemistry 课程代码:08S1105B 课程类别:专业核心课程 课程性质:必修 适用专业:化学专业 课程学时:48 课程学分:3 先修课程:高中化学、高等数学 选用教材: 《无机化学》,宋天佑等,高等教育出版社,2019年第4版 参考书目: 1.《无机化学》,北京师范大学等,高等教育出版社,2021年第5版 2.《无机化学》,天津大学,高等教育出版社,2018年第5版 3.《无机化学》,孟长功,高等教育出版社,2018年第6版 4.《无机化学例题与习题》,徐家宁等,高等教育出版社,2020年第4版 5.《近代化学导论》,申泮文,高等教育出版社,2001年第2版 6.《中级无机化学》,唐宗薰,高等教育出版社,2003年 7.《中级无机化学》,项斯芬、姚光庆,北京大学出版社,2003年 二、课程目标 (一)课程具体目标 通过本课程的学习,学生达到以下目标: 1.使学生在高中化学知识的基础上,进一步学习化学基础理论、基本知识,掌握化学反 应的一般规律和基本化学计算方法。培养学生分析问题、解决问题的能力。【毕业要求 3学科素养】 2.学会并实践在学习中进行初步反思,在反思中改进学习方法、提高学习效果。逐渐完 成从中学到大学在学习方式上的过渡,使学生在听课、查阅参考书、自学等方面都有一 个突跃。【毕业要求7反思研究】 3.以辩证唯物主义观点和科学的方法为指导,阐明无机化学的基本原理,揭示无机化学 中的对立统一规律及元素和化合物性质的变化规律,以促进学生辩证唯物主义世界观的
1 一、课程基本信息 课程名称:(中文):无机化学Ⅰ (英文):Inorganic Chemistry 课程代码:08S1105B 课程类别:专业核心课程 课程性质:必修 适用专业:化学专业 课程学时:48 课程学分:3 先修课程:高中化学、高等数学 选用教材: 《无机化学》,宋天佑等,高等教育出版社,2019年第4版 参考书目: 1. 《无机化学》,北京师范大学等,高等教育出版社,2021 年第 5 版 2. 《无机化学》,天津大学,高等教育出版社,2018 年第 5 版 3. 《无机化学》,孟长功,高等教育出版社,2018 年第 6 版 4. 《无机化学例题与习题》,徐家宁等,高等教育出版社,2020 年第 4 版 5. 《近代化学导论》,申泮文,高等教育出版社,2001 年第 2 版 6. 《中级无机化学》,唐宗薰,高等教育出版社, 2003 年 7. 《中级无机化学》,项斯芬、姚光庆,北京大学出版社,2003 年 二、课程目标 (一)课程具体目标 通过本课程的学习,学生达到以下目标: 1. 使学生在高中化学知识的基础上,进一步学习化学基础理论、基本知识,掌握化学反 应的一般规律和基本化学计算方法。培养学生分析问题、解决问题的能力。【毕业要求 3 学科素养】 2. 学会并实践在学习中进行初步反思,在反思中改进学习方法、提高学习效果。逐渐完 成从中学到大学在学习方式上的过渡,使学生在听课、查阅参考书、自学等方面都有一 个突跃。【毕业要求 7 反思研究】 3. 以辩证唯物主义观点和科学的方法为指导,阐明无机化学的基本原理,揭示无机化学 中的对立统一规律及元素和化合物性质的变化规律,以促进学生辩证唯物主义世界观的
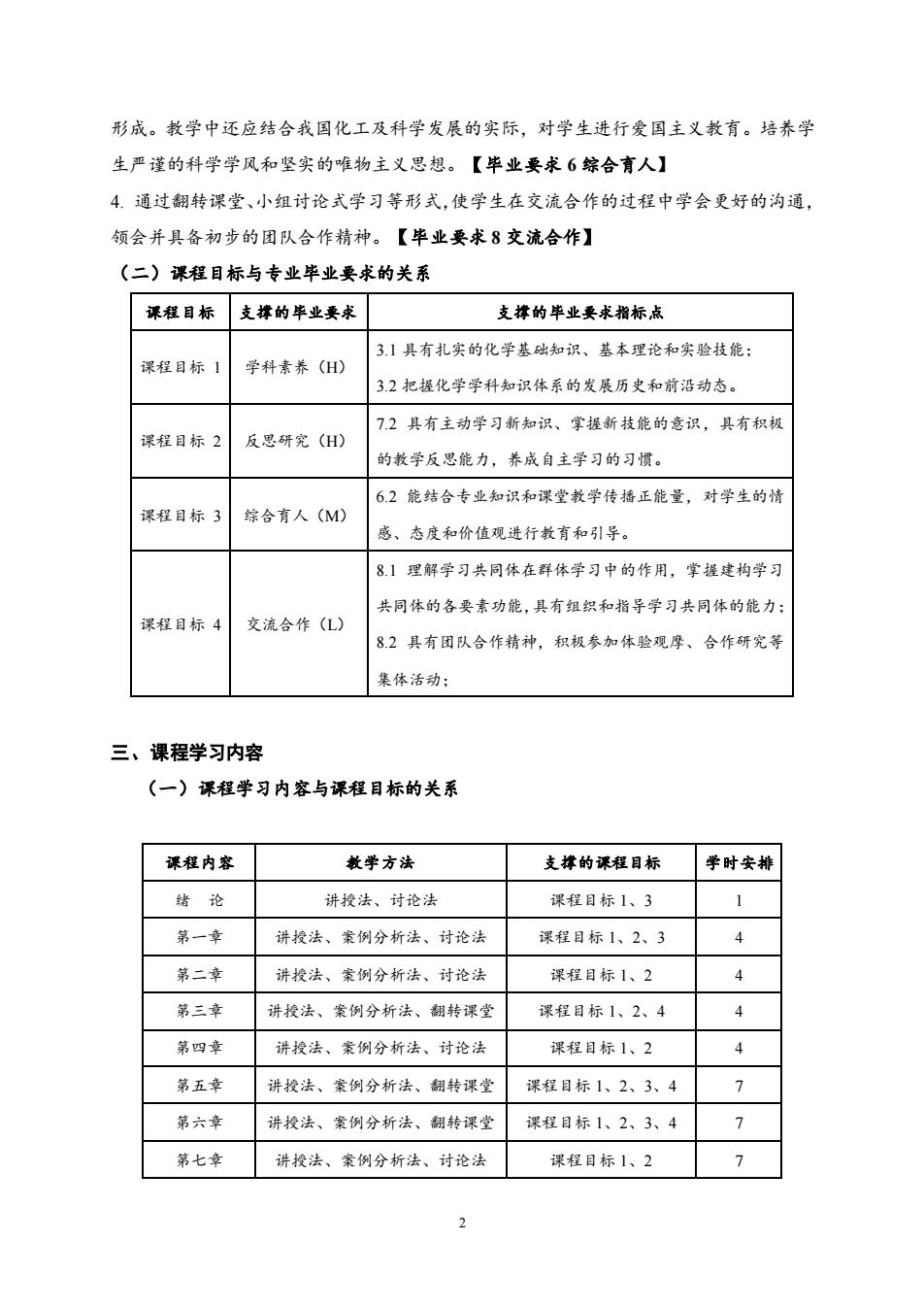
形成。教学中还应结合我国化工及科学发展的实际,对学生进行爱国主义教育。培养学 生严谨的科学学风和坚实的唯物主义思想。【毕业要求6综合育人】 4.通过翻转课堂、小组讨论式学习等形式,使学生在交流合作的过程中学会更好的沟通, 领会并具备初步的团队合作精神。【毕业要求8交流合作】 (二)课程目标与专业毕业要求的关系 课程目标 支撑的毕业要求 支撑的毕业要求指标点 3.1具有扎实的化学基础知识、基本理论和实验技能; 课程目标1 学科素养(H) 3.2把握化学学科知识体系的发展历史和前沿动态。 72具有主动学习新知识、掌握新技能的意识,具有积极 课程目标2 反思研究(H) 的教学反思能力,养成自主学习的习惯。 62能结合专业知识和课堂教学传播正能量,对学生的情 课程目标3 综合育人(M) 感、态度和价值观进行教育和引导。 81理解学习共同体在群体学习中的作用,掌握建构学习 共同体的各要素功能,具有组织和指导学习共同体的能力; 课程目标4 交流合作(L) 8.2具有团队合作精神,积极参加体验观摩、合作研究等 集体活动: 三、课程学习内容 (一)课程学习内容与课程目标的关系 课程内容 教学方法 支撑的课程目标 学时安排 绪论 讲授法、讨论法 课程目标1、3 第一章 讲授法、案例分析法、讨论法 课程目标1、2、3 4 第二章 讲授法、案例分析法、讨论法 课程目标1、2 4 第三章 讲授法、案例分析法、翻转课堂 课程目标1、2、4 第四章 讲授法、案例分析法、讨论法 课程目标1、2 4 第五章 讲授法、案例分析法、翻转课堂 课程目标1、2、3、4 > 第六章 讲授法、案例分析法、翻转课堂 课程目标1、2、3、4 7 第七章 讲授法、案例分析法、讨论法 课程目标1、2 7
2 形成。教学中还应结合我国化工及科学发展的实际,对学生进行爱国主义教育。培养学 生严谨的科学学风和坚实的唯物主义思想。【毕业要求 6 综合育人】 4. 通过翻转课堂、小组讨论式学习等形式,使学生在交流合作的过程中学会更好的沟通, 领会并具备初步的团队合作精神。【毕业要求 8 交流合作】 (二)课程目标与专业毕业要求的关系 课程目标 支撑的毕业要求 支撑的毕业要求指标点 课程目标 1 学科素养(H) 3.1 具有扎实的化学基础知识、基本理论和实验技能; 3.2 把握化学学科知识体系的发展历史和前沿动态。 课程目标 2 反思研究(H) 7.2 具有主动学习新知识、掌握新技能的意识,具有积极 的教学反思能力,养成自主学习的习惯。 课程目标 3 综合育人(M) 6.2 能结合专业知识和课堂教学传播正能量,对学生的情 感、态度和价值观进行教育和引导。 课程目标 4 交流合作(L) 8.1 理解学习共同体在群体学习中的作用,掌握建构学习 共同体的各要素功能,具有组织和指导学习共同体的能力; 8.2 具有团队合作精神,积极参加体验观摩、合作研究等 集体活动; 三、课程学习内容 (一)课程学习内容与课程目标的关系 课程内容 教学方法 支撑的课程目标 学时安排 绪 论 讲授法、讨论法 课程目标 1、3 1 第一章 讲授法、案例分析法、讨论法 课程目标 1、2、3 4 第二章 讲授法、案例分析法、讨论法 课程目标 1、2 4 第三章 讲授法、案例分析法、翻转课堂 课程目标 1、2、4 4 第四章 讲授法、案例分析法、讨论法 课程目标 1、2 4 第五章 讲授法、案例分析法、翻转课堂 课程目标 1、2、3、4 7 第六章 讲授法、案例分析法、翻转课堂 课程目标 1、2、3、4 7 第七章 讲授法、案例分析法、讨论法 课程目标 1、2 7

第八章 讲授法、案例分析法、翻转课堂 课程目标1、2、4 5 第九章 讲授法、案例分析法、翻转课堂 课程目标1、2、4 4 复习 讲授法、讨论法 课程目标1、2 1 合计 48 (二)具体内容 绪论 【教学目标】 1.明确无机化学的研究对象、目的和任务。 2.了解无机化学的发展历程及最新进展,激发学生对无机化学的学习兴趣,增强学 生的国际视野,树立“新化学人”为中华民族的伟大复兴而努力奋斗的信念; 3.掌握无机化学的学习方法,引起学生对无机化学课程的重视,培养学生良好的学 习习惯。 【教学内容】 0.1化学研究的对象和内容 0.2化学发展简史 0.3无机化学简介 0.4如何学好无机化学 【重点】 无机化学的任务、最新发展方向及应用 【难点】 化学发展简史 【教学方法】 通过多媒体课件与传统讲授相结合,阐述无机化学课程的主要内容。结合高中化学 的学习经历,讨论化学学习过程中有效的学习方法,及学习中的难点,讨论如何学好无 机化学。 【复习思考】 无机化学主要研究什么?如何学好无机化学?
3 第八章 讲授法、案例分析法、翻转课堂 课程目标 1、2、4 5 第九章 讲授法、案例分析法、翻转课堂 课程目标 1、2、4 4 复习 讲授法、讨论法 课程目标 1、2 1 合计 48 (二)具体内容 绪论 【教学目标】 1. 明确无机化学的研究对象、目的和任务。 2. 了解无机化学的发展历程及最新进展,激发学生对无机化学的学习兴趣,增强学 生的国际视野,树立“新化学人”为中华民族的伟大复兴而努力奋斗的信念; 3. 掌握无机化学的学习方法,引起学生对无机化学课程的重视,培养学生良好的学 习习惯。 【教学内容】 0.1 化学研究的对象和内容 0.2 化学发展简史 0.3 无机化学简介 0.4 如何学好无机化学 【重点】 无机化学的任务、最新发展方向及应用 【难点】 化学发展简史 【教学方法】 通过多媒体课件与传统讲授相结合,阐述无机化学课程的主要内容。结合高中化学 的学习经历,讨论化学学习过程中有效的学习方法,及学习中的难点,讨论如何学好无 机化学。 【复习思考】 无机化学主要研究什么?如何学好无机化学?

第一章化学基础知识 【教学目标】 1.掌握理想气体状态方程及其应用、分压定律和扩散定律: 2.掌握液体蒸气压和沸,点的概念; 3.了解实际气体状态方程、气体分子运动论、晶体内部结构: 4.理解气体分子的速率分布和能量分布; 5.掌握溶液浓度的几种表示方法,了解温度对溶解度的影响: 6.理解和掌握非电介质稀溶液的蒸气压下降、沸点升高、凝固点下降、渗透压等依 数性,能够进行相关的计算; 【教学内容】 1.1气体 1.1.1理想气体和实际气体状态方程 1.1.2混合气体分压定律 1.1.3气体扩散定律、气体分子的速率分布和能量分布 1.2液体和溶液 1.2.1溶液浓度表示方法 1.2.2溶液的饱和蒸汽压 1.2.3非电解质稀溶液的依数性:难挥发非电介质稀溶液的蒸气压下降(拉乌尔定 律),沸点升高,凝固点下降、渗透压及其根据公式计算常数的变化,或者根据沸点、 凝固点、渗透压的变化计算物质的分子量 1.3固体和晶体 1.3.1晶体和非晶体 1.3.2对称性 1.3.3晶体和点阵 【重点】 1.理想气体状态方程及其应用,分压定律和扩散定律, 2.难挥发非电介质稀溶液的依数性:蒸气压下降(拉乌尔定律),沸点升高,凝固 点下降 【难点】 1.难挥发非电介质稀溶液的依数性的应用及计算
4 第一章 化学基础知识 【教学目标】 1. 掌握理想气体状态方程及其应用、分压定律和扩散定律; 2. 掌握液体蒸气压和沸点的概念; 3. 了解实际气体状态方程、气体分子运动论、晶体内部结构; 4. 理解气体分子的速率分布和能量分布; 5. 掌握溶液浓度的几种表示方法,了解温度对溶解度的影响; 6. 理解和掌握非电介质稀溶液的蒸气压下降、沸点升高、凝固点下降、渗透压等依 数性,能够进行相关的计算; 【教学内容】 1.1 气体 1.1.1 理想气体和实际气体状态方程 1.1.2 混合气体分压定律 1.1.3 气体扩散定律、气体分子的速率分布和能量分布 1.2 液体和溶液 1.2.1 溶液浓度表示方法 1.2.2 溶液的饱和蒸汽压 1.2.3 非电解质稀溶液的依数性:难挥发非电介质稀溶液的蒸气压下降(拉乌尔定 律),沸点升高,凝固点下降、渗透压及其根据公式计算常数的变化,或者根据沸点、 凝固点、渗透压的变化计算物质的分子量 1.3 固体和晶体 1.3.1 晶体和非晶体 1.3.2 对称性 1.3.3 晶体和点阵 【重点】 1. 理想气体状态方程及其应用,分压定律和扩散定律, 2. 难挥发非电介质稀溶液的依数性:蒸气压下降(拉乌尔定律),沸点升高,凝固 点下降 【难点】 1. 难挥发非电介质稀溶液的依数性的应用及计算

2.气体分子运动论 【教学方法】 1.通过多媒体课件与传统讲授相结合,让学生掌握理想气体状态方程及其应用,分 压定律和扩散定律。 2.通过课堂讨论,加深学生对拉乌尔定律的认识。 3.通过小组学习与课堂汇报,使学生理解学习共同体的作用并形成初步的团队协作 精神。 【复习思考】 1.乙二醇的沸,点是197.9℃,乙醇的沸点是78.3℃,用作汽车散热器水箱中的防冻 剂,哪一种物质较好?请简述理由。 2.根据气体的分压定律,说明什么是气体的分体积定律。 第二章化学热力学基础 【教学目标】 1.掌握热力学的一些基本概念,如系统、环境、状态函数、强度性质、广延性质、 功、热及过程等。熟悉热力学标准状态的定义和意义,理解状态函数的基本特征: 2.掌握用标准摩尔生成焓、标准摩尔燃烧焓计算化学反应热的方法,特别要掌握根 据盖斯定律或利用状态函数的基本特征,设计过程,计算化学反应热的方法及计算公式 的使用条件; 3.学会用吉布斯自由能变化△G判断标准状况下等温等压化学反应的方向,利用 实际△Gm判断所给状况下反应进行的方向;学会通过吉布斯函数来判断化学反应控制 的温度以及实际发生化学反应的情况,根据计算,利用理论来指导化合物的合成以及选 择最优势的合成条件。 【教学内容】 2.1热力学第一定律 2.1.1热力学常用术语 2.12热力学第一定律:系统和环境,状态和状态函数,过程和过程变量,热和功: 热力学能和焓: 2.2热化学 2.2.1化学反应热效应:恒容过程和恒压过程
5 2. 气体分子运动论 【教学方法】 1. 通过多媒体课件与传统讲授相结合,让学生掌握理想气体状态方程及其应用,分 压定律和扩散定律。 2. 通过课堂讨论,加深学生对拉乌尔定律的认识。 3. 通过小组学习与课堂汇报,使学生理解学习共同体的作用并形成初步的团队协作 精神。 【复习思考】 1. 乙二醇的沸点是 197.9℃,乙醇的沸点是 78.3℃,用作汽车散热器水箱中的防冻 剂,哪一种物质较好?请简述理由。 2. 根据气体的分压定律,说明什么是气体的分体积定律。 第二章 化学热力学基础 【教学目标】 1. 掌握热力学的一些基本概念,如系统、环境、状态函数、强度性质、广延性质、 功、热及过程等。熟悉热力学标准状态的定义和意义,理解状态函数的基本特征; 2. 掌握用标准摩尔生成焓、标准摩尔燃烧焓计算化学反应热的方法,特别要掌握根 据盖斯定律或利用状态函数的基本特征,设计过程,计算化学反应热的方法及计算公式 的使用条件; 3. 学会用吉布斯自由能变化 ΔrGm θ 判断标准状况下等温等压化学反应的方向,利用 实际 ΔrGm 判断所给状况下反应进行的方向;学会通过吉布斯函数来判断化学反应控制 的温度以及实际发生化学反应的情况,根据计算,利用理论来指导化合物的合成以及选 择最优势的合成条件。 【教学内容】 2.1 热力学第一定律 2.1.1 热力学常用术语 2.1.2 热力学第一定律:系统和环境,状态和状态函数,过程和过程变量,热和功; 热力学能和焓; 2.2 热化学 2.2.1 化学反应热效应:恒容过程和恒压过程

2.2.2盖斯定律:热化学方程式 2.2.3生成热:生成焓与标准生成焓 2.2.4燃烧热:燃烧焓 2.2.5从键能估算反应热:化学反应热的有关计算 2.3化学反应的方向 2.31反应进行的方式 2.3.2反应进行的方向:反应方向的概念 2.33反应焓变对反应方向的影响 2.3.4状态函数一嫡:系统的混乱度,嫡,热力学第二定律,热力学第三定律 2.3.5吉布斯自由能:吉布斯自由能判据,标准摩尔生成吉布斯自由能 【重点】 1.掌握热力学第一定律及它对恒压只做体积功、恒容只做体积功过程的应用:盖斯 定律及化学反应热的计算;吉布斯自由能变化△Gm与化学反应方向的判断 2.状态函数,反应热的计算,吉布斯自由能,化学反应方向的判断 【难点】 1.盖斯定律及化学反应热的计算; 2.吉布斯自由能变化△Gm与化学反应方向的判断 【教学方法】 1.通过传统讲授与多媒体课件相结合,清晰阐释并帮助学生理解热力学第一定律与 热力学第二定律。 2.通过例题分析与讨论,引导学生学会计算反应吉布斯自由能,并能够判断化学反 应方向。 【复习思考】 1.什么是焓?非恒压过程是否有焓变?有的话,等于什么? 2.单斜硫和臭氧都是单质,它们的△rHm是否等于零?并说明理由? 第三章化学反应速率 【教学目标】 1.掌握反应速率的意义及速率方程表达式: 2.理解碰撞理论、过渡态理论; 6
6 2.2.2 盖斯定律:热化学方程式 2.2.3 生成热:生成焓与标准生成焓 2.2.4 燃烧热:燃烧焓 2.2.5 从键能估算反应热:化学反应热的有关计算 2.3 化学反应的方向 2.3.1 反应进行的方式 2.3.2 反应进行的方向:反应方向的概念 2.3.3 反应焓变对反应方向的影响 2.3.4 状态函数—熵:系统的混乱度,熵,热力学第二定律,热力学第三定律 2.3.5 吉布斯自由能:吉布斯自由能判据,标准摩尔生成吉布斯自由能 【重点】 1. 掌握热力学第一定律及它对恒压只做体积功、恒容只做体积功过程的应用;盖斯 定律及化学反应热的计算;吉布斯自由能变化 ΔrGm 与化学反应方向的判断 2. 状态函数,反应热的计算,吉布斯自由能,化学反应方向的判断 【难点】 1. 盖斯定律及化学反应热的计算; 2. 吉布斯自由能变化 ΔrGm 与化学反应方向的判断 【教学方法】 1. 通过传统讲授与多媒体课件相结合,清晰阐释并帮助学生理解热力学第一定律与 热力学第二定律。 2. 通过例题分析与讨论,引导学生学会计算反应吉布斯自由能,并能够判断化学反 应方向。 【复习思考】 1. 什么是焓?非恒压过程是否有焓变?有的话,等于什么? 2. 单斜硫和臭氧都是单质,它们的 ΔrHm θ 是否等于零?并说明理由? 第三章 化学反应速率 【教学目标】 1. 掌握反应速率的意义及速率方程表达式; 2. 理解碰撞理论、过渡态理论;

3.熟悉实验活化能及速率常数的计算: 4.理解对化学反应速率、基元反应、复杂反应、反应级数、反应分子数、活化能等 概念;熟悉一级反应及半衰期的计算,了解零级、二级、三级反应;能运用质量作用定 律对基元反应的反应速率进行有关的计算;能利用Arrhenius经验公式进行有关的计算; 5.掌握浓度、温度、催化剂对反应速率的影响。根据Arrhenius经验公式求算反应 的活化能及不同温度下的速率常数。 【教学内容】 3.1反应速率的概念 3.1.1平均速率 3.1.2瞬时速率 3.2反应速率和反应物浓度的关系:浓度对反应速率的影响,反应的分子数和反应 级数,速率常数,反应速率的质量作用定律 3.3反应机理:基元反应 34反应物浓度与时间的关系:零级,一级,二级反应 3.5化学反应速率理论简介:活化能,碰撞理论,过渡状态理论 3.6影响反应速率的因素:Arrhenius经验公式,表观活化能;温度对反应速率的 影响:催化剂对反应速率的影响 【重点】 l.Arrhenius经验公式与活化能和速率常数的计算,浓度、温度、催化剂对反应速 率的影响 2.反应级数,影响化学反应速率的因素 【难点】 1.Arrhenius经验公式与活化能和速率常数的计算 2.浓度、温度、催化剂对反应速率的影响 【教学方法】 1.通过传统讲授与讨论相结合,清晰阐释并帮助学生理解Arrhenius经验公式与活 化能和速率常数的计算。 2.通过多媒体课件与例题分析相结合,引导学生熟悉并理解浓度、温度、催化剂对 反应速率的影响。 【复习思考】 >
7 3. 熟悉实验活化能及速率常数的计算; 4. 理解对化学反应速率、基元反应、复杂反应、反应级数、反应分子数、活化能等 概念;熟悉一级反应及半衰期的计算,了解零级、二级、三级反应;能运用质量作用定 律对基元反应的反应速率进行有关的计算;能利用 Arrhenius 经验公式进行有关的计算; 5. 掌握浓度、温度、催化剂对反应速率的影响。根据 Arrhenius 经验公式求算反应 的活化能及不同温度下的速率常数。 【教学内容】 3.1 反应速率的概念 3.1.1 平均速率 3.1.2 瞬时速率 3.2 反应速率和反应物浓度的关系:浓度对反应速率的影响,反应的分子数和反应 级数,速率常数,反应速率的质量作用定律 3.3 反应机理:基元反应 3.4 反应物浓度与时间的关系:零级,一级,二级反应 3.5 化学反应速率理论简介:活化能,碰撞理论,过渡状态理论 3.6 影响反应速率的因素: Arrhenius 经验公式,表观活化能;温度对反应速率的 影响;催化剂对反应速率的影响 【重点】 1. Arrhenius 经验公式与活化能和速率常数的计算,浓度、温度、催化剂对反应速 率的影响 2. 反应级数,影响化学反应速率的因素 【难点】 1. Arrhenius 经验公式与活化能和速率常数的计算 2. 浓度、温度、催化剂对反应速率的影响 【教学方法】 1. 通过传统讲授与讨论相结合,清晰阐释并帮助学生理解 Arrhenius 经验公式与活 化能和速率常数的计算。 2. 通过多媒体课件与例题分析相结合,引导学生熟悉并理解浓度、温度、催化剂对 反应速率的影响。 【复习思考】

1.一般情况下,升高温度反应速度加快了,为什么?试用阿累尼乌斯公式说明? 第四章化学平衡 【教学目标】 1.理解平衡常数K的意义及其与吉布斯自由能(△rGm)的关系,△rGm=一RTnK, 利用公式计算平衡常数K或△Gm: 2.掌握化学反应等温式,Van't Hoff方程△rG=△rGm9+RTnQ的意义及其相关的计 算与应用。利用函数△Gm或△G判断标准态及非标准态下化学反应的方向性: 3.掌握Q/作为过程判据的方法: 4.掌握温度、压力、浓度、催化剂对化学平衡移动的影响以及平衡移动原理,能够 根据条件的变化判断化学反应的移动。 【教学内容】 4.1化学平衡状态:化学反应的可逆性和化学平衡 4.1.1经验平衡常数 4.1.2平衡常数和平横转化率 4.2化学反应进行的方向 4.2.1标准平衡常数,平衡常数与化学反应的程度 4.2.2标准平衡常数与化学反应的方向 4.3标准平衡常数与△rGm9的关系 4.3.1化学反应等温式 44化学平衡的移动:浓度、压强、温度对化学平衡的影响 【重点】 1.平衡常数K与吉布斯自由能(△rGm)的关系及相关计算,Van't Hoff方程△rG =△rGm9+RTlnQ的应用 2.化学反应方向的判据,化学平衡的移动 【难点】 1.平衡常数K与吉布斯自由能(△Gm)的关系及相关计算。 2.Van't Hoff方程△rG=△rGm9+RTnQ的应用。 【教学方法】 1.通过多媒体课件与传统讲授相结合,讲解Van't Hoff方程△rG=△rGm+RTInQ
8 1. 一般情况下,升高温度反应速度加快了,为什么?试用阿累尼乌斯公式说明? 第四章 化学平衡 【教学目标】 1. 理解平衡常数 Kθ 的意义及其与吉布斯自由能(ΔrGm θ)的关系,ΔrGm θ=-RTlnKθ, 利用公式计算平衡常数 Kθ 或 ΔrGm θ; 2. 掌握化学反应等温式,Van't Hoff 方程 ΔrG=ΔrGm θ+RTlnQ 的意义及其相关的计 算与应用。利用函数 ΔrGm θ 或 ΔrG 判断标准态及非标准态下化学反应的方向性; 3. 掌握 Q/Kθ 作为过程判据的方法; 4. 掌握温度、压力、浓度、催化剂对化学平衡移动的影响以及平衡移动原理,能够 根据条件的变化判断化学反应的移动。 【教学内容】 4.1 化学平衡状态:化学反应的可逆性和化学平衡 4.1.1 经验平衡常数 4.1.2 平衡常数和平横转化率 4.2 化学反应进行的方向 4.2.1 标准平衡常数,平衡常数与化学反应的程度 4.2.2 标准平衡常数与化学反应的方向 4.3 标准平衡常数 Kθ 与 ΔrGm θ 的关系 4.3.1 化学反应等温式 4.4 化学平衡的移动:浓度、压强、温度对化学平衡的影响 【重点】 1. 平衡常数 Kθ 与吉布斯自由能(ΔrGm θ)的关系及相关计算,Van't Hoff 方程 ΔrG =ΔrGm θ +RTlnQ 的应用 2. 化学反应方向的判据,化学平衡的移动 【难点】 1. 平衡常数 Kθ 与吉布斯自由能(ΔrGm θ)的关系及相关计算。 2. Van't Hoff 方程 ΔrG=ΔrGm θ+RTlnQ 的应用。 【教学方法】 1. 通过多媒体课件与传统讲授相结合,讲解 Van't Hoff 方程 ΔrG=ΔrGm θ+RTlnQ

的应用。 2.通过讨论与例题讲解,使学生熟练掌握平衡常数K与吉布斯自由能(△Gm)的 关系及相关计算。 【复习思考】 1.反应I2(g)一2I(g)气体混合处于平衡时: (1)升温时,平衡常数加大还是减小?为什么? (2)压缩气体时,I2(g)的解离度是增大还是减小? (3)恒容时充入N2气时,I2(g)的解离度是增大还是减小? (4)恒压时充入N2气时,I2(g)的解离度是增大还是减小? 第五章原子结构与元素周期律 【教学目标】 1.从氢原子光谱了解能级的概念: 2.了解原子核外电子运动的近代概念; 3.掌握四个量子数对核外电子运动状态的描述: 4.熟悉s、p、d原子轨道和电子云的形状和伸展方向: 5.掌握周期系内各元素原子的核外电子层结构的特征,电子排布规律,并结合原子 系数,熟悉元素性质周期性变化规律。 【教学内容】 51近代原子结构理论的确立 5.1.1原子结构模型 5.1.2氢原子光谱:能级的概念:量子化的概念 5.1.3玻尔理论 5.2微观粒子运动的特殊性 5.2.1微观粒子运动的波粒二象性 5.2.2不确定原理 5.2.3微观粒子运动的统计规律 5.3核外电子运动状态的描述 5.3.1薛定谔方程(只列出公式) 5.3.2四个量子数 9
9 的应用。 2. 通过讨论与例题讲解,使学生熟练掌握平衡常数 Kθ 与吉布斯自由能(ΔrGm θ)的 关系及相关计算。 【复习思考】 1. 反应 I2(g) 2I(g) 气体混合处于平衡时: (1) 升温时,平衡常数加大还是减小? 为什么? (2) 压缩气体时,I2(g)的解离度是增大还是减小? (3) 恒容时充入 N2 气时,I2(g)的解离度是增大还是减小? (4) 恒压时充入 N2 气时,I2(g)的解离度是增大还是减小? 第五章 原子结构与元素周期律 【教学目标】 1. 从氢原子光谱了解能级的概念; 2. 了解原子核外电子运动的近代概念; 3. 掌握四个量子数对核外电子运动状态的描述; 4. 熟悉 s、p、d 原子轨道和电子云的形状和伸展方向; 5. 掌握周期系内各元素原子的核外电子层结构的特征,电子排布规律,并结合原子 系数,熟悉元素性质周期性变化规律。 【教学内容】 5.1 近代原子结构理论的确立 5.1.1 原子结构模型 5.1.2 氢原子光谱:能级的概念;量子化的概念 5.1.3 玻尔理论 5.2 微观粒子运动的特殊性 5.2.1 微观粒子运动的波粒二象性 5.2.2 不确定原理 5.2.3 微观粒子运动的统计规律 5.3 核外电子运动状态的描述 5.3.1 薛定谔方程(只列出公式) 5.3.2 四个量子数