
本章主要内容 4.1概述 4.2液-液萃取相平衡 4.3液-液萃取过程的计算 4.4新型萃取技术 4.5液-液萃取设备 本章总结一联系图
本章主要内容 4.1 概述 4.2 液-液萃取相平衡 4.3 液-液萃取过程的计算 4.4 新型萃取技术 4.5 液-液萃取设备 本章总结-联系图

本章学习目的 通过本章的学习,掌握液-液相平衡在三角形相图上 的表示方法,会用三角形相图分析液液萃取过程中相及 组成的变化,能熟练应用三角形相图对萃取过程进行分 析、计算,了解萃取设备的类型及结构特点。 本章重点掌握内容 三角形液-液平衡相图,杠杆规则,萃取计算的三角 形坐标图解法 本章应掌握的内容三角形坐标图,萃取剂的选择 萃取计算的直角坐标图解法。 本章一般了解的内容 萃取过程的解析计算,回流萃取,超临界萃取,萃取 设备的类型、结构特点及选用。 重点和难点:三角形液液相平衡
本章学习目的 通过本章的学习,掌握液-液相平衡在三角形相图上 的表示方法,会用三角形相图分析液液萃取过程中相及 组成的变化,能熟练应用三角形相图对萃取过程进行分 析 、 计 算 , 了 解 萃 取 设 备 的 类 型 及 结 构 特 点 。 本章重点掌握内容 三角形液-液平衡相图,杠杆规则,萃取计算的三角 形坐标图解法 本章应掌握的内容 三角形坐标图,萃取剂的选择, 萃取计算的直角坐标图解法。 本章一般了解的内容 萃取过程的解析计算,回流萃取,超临界萃取,萃取 设备的类型、结构特点及选用。 重点和难点:三角形液液相平衡

4.1概述 1.萃取原理 萃取:在液体混合物(原料液)中加入一个与其基本 不相混溶的液体作为溶剂,造成第二相,利用原料液中各 组分在两个液相中的溶解度不同而使原料液混合物得以分 离的单元操作。亦称溶剂萃取,简称萃取或抽提。 它是一个分离液体混合物的单元操作。 选用的溶剂称为萃取剂,以S表示; 原料液中易溶于S的组分,称为溶质,以A表示; 难溶于S的组分称为原溶剂(或稀释剂),以B表示
4.1 概述 1.萃取原理 萃取:在液体混合物(原料液)中加入一个与其基本 不相混溶的液体作为溶剂,造成第二相,利用原料液中各 组分在两个液相中的溶解度不同而使原料液混合物得以分 离的单元操作。亦称溶剂萃取,简称萃取或抽提。 它是一个分离液体混合物的单元操作。 选用的溶剂称为萃取剂,以S表示; 原料液中易溶于S的组分,称为溶质,以A表示; 难溶于S的组分称为原溶剂(或稀释剂),以B表示
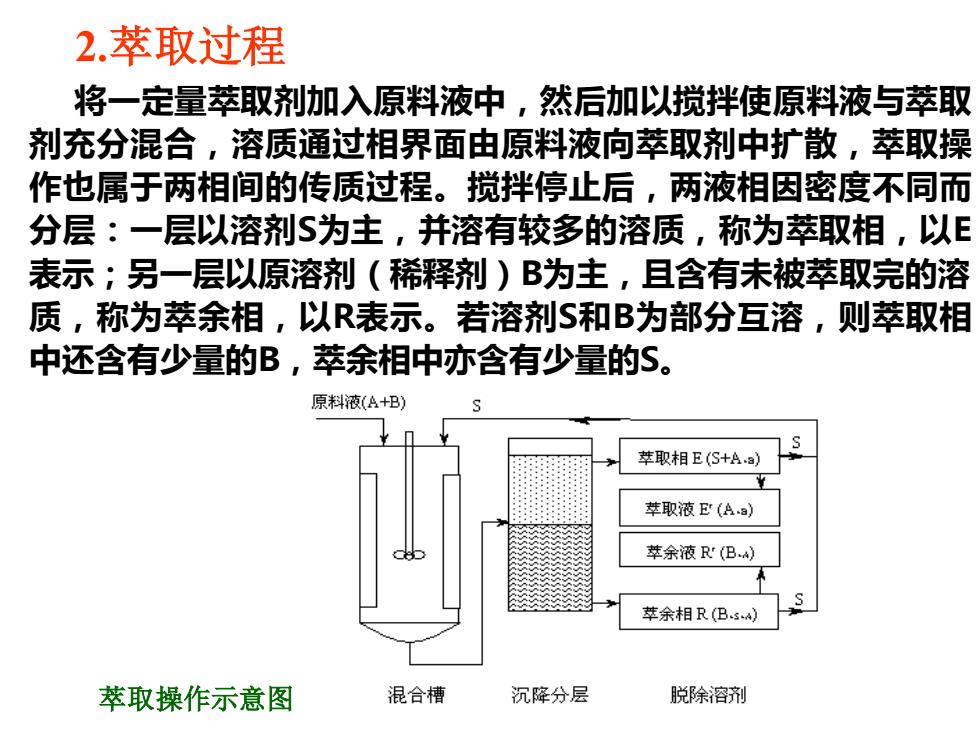
2.萃取过程 将一定量萃取剂加入原料液中,然后加以搅拌使原料液与萃取 剂充分混合,溶质通过相界面由原料液向萃取剂中扩散,萃取操 作也属于两相间的传质过程。搅拌停止后,两液相因密度不同而 分层:一层以溶剂$为主,并溶有较多的溶质,称为萃取相,以E 表示;另一层以原溶剂(稀释剂)B为主,且含有未被萃取完的溶 质,称为萃余相,以R表示。若溶剂S和B为部分互溶,则萃取相 中还含有少量的B,萃余相中亦含有少量的S。 原料液(A+B) 苹取相E(S+Aa) 萃取液E(Aa) 萃余液R(B) 萃余相R(Bs) 萃取操作示意图 混合槽 沉降分层 脱除溶剂
2.萃取过程 将一定量萃取剂加入原料液中,然后加以搅拌使原料液与萃取 剂充分混合,溶质通过相界面由原料液向萃取剂中扩散,萃取操 作也属于两相间的传质过程。搅拌停止后,两液相因密度不同而 分层:一层以溶剂S为主,并溶有较多的溶质,称为萃取相,以E 表示;另一层以原溶剂(稀释剂)B为主,且含有未被萃取完的溶 质,称为萃余相,以R表示。若溶剂S和B为部分互溶,则萃取相 中还含有少量的B,萃余相中亦含有少量的S。 萃取操作示意图

2.萃取过程(续) 由上可知,萃取操作并未得到纯净的组分,而是新 的混合液:萃取相E和萃余相R。为了得到产品A,并 回收溶剂以供循环使用,尚需对这两相分别进行分离。 通常采用蒸馏或蒸发的方法,有时也可采用结晶等其 它方法。脱除溶剂后的萃取相和萃余相分别称为萃取 液和萃余液,以和表示
2.萃取过程(续) 由上可知,萃取操作并未得到纯净的组分,而是新 的混合液:萃取相E和萃余相R。为了得到产品A,并 回收溶剂以供循环使用,尚需对这两相分别进行分离。 通常采用蒸馏或蒸发的方法,有时也可采用结晶等其 它方法。脱除溶剂后的萃取相和萃余相分别称为萃取 液和萃余液,以 E 和 表示 R

3.萃取的分类 (1)按组分数目分: √多元体系:原料液中有两个以上组分或溶剂为两种不互 溶的溶剂 √三元体系:原料液中含有两个组分,溶剂为单溶剂 (2)按有无化学反应分: √物理萃取:萃取过程中,萃取剂与原料液中的有关组分 不发生化学反应 √化学萃取 本章主要讨论三元体系的物理萃取
3.萃取的分类 (1)按组分数目分: ✓多元体系:原料液中有两个以上组分或溶剂为两种不互 溶的溶剂 ✓三元体系:原料液中含有两个组分,溶剂为单溶剂 (2)按有无化学反应分: ✓物理萃取:萃取过程中,萃取剂与原料液中的有关组分 不发生化学反应 ✓化学萃取 本章主要讨论三元体系的物理萃取

4.萃取操作的应用 对于一种液体混合物,究竟是采用蒸馏还是萃取加以分离, 主要取决于技术上的可行性和经济上的合理性。 一般地,在下列情况下采用萃取方法更为有利。 (1)原料液中各组分间的相对挥发度接近于1或形成恒沸物 若采用蒸馏方法不能分离或很不经济, (2)原料液中需分离的组分含量很低且为难挥发组分,若采 用蒸馏方法须将大量稀释剂汽化,能耗较大; (3)原料液中需分离的组分是热敏性物质,蒸馏时易于分解、 聚合或发生其它变化。 (4)其它,如多种金属物质的分离,核工业材料的制取,治 理环境污染等
4.萃取操作的应用 对于一种液体混合物,究竟是采用蒸馏还是萃取加以分离, 主要取决于技术上的可行性和经济上的合理性。 一般地,在下列情况下采用萃取方法更为有利。 (1) 原料液中各组分间的相对挥发度接近于1或形成恒沸物, 若采用蒸馏方法不能分离或很不经济; (2)原料液中需分离的组分含量很低且为难挥发组分,若采 用蒸馏方法须将大量稀释剂汽化,能耗较大; (3) 原料液中需分离的组分是热敏性物质,蒸馏时易于分解、 聚合或发生其它变化。 (4)其它,如多种金属物质的分离,核工业材料的制取,治 理环境污染等
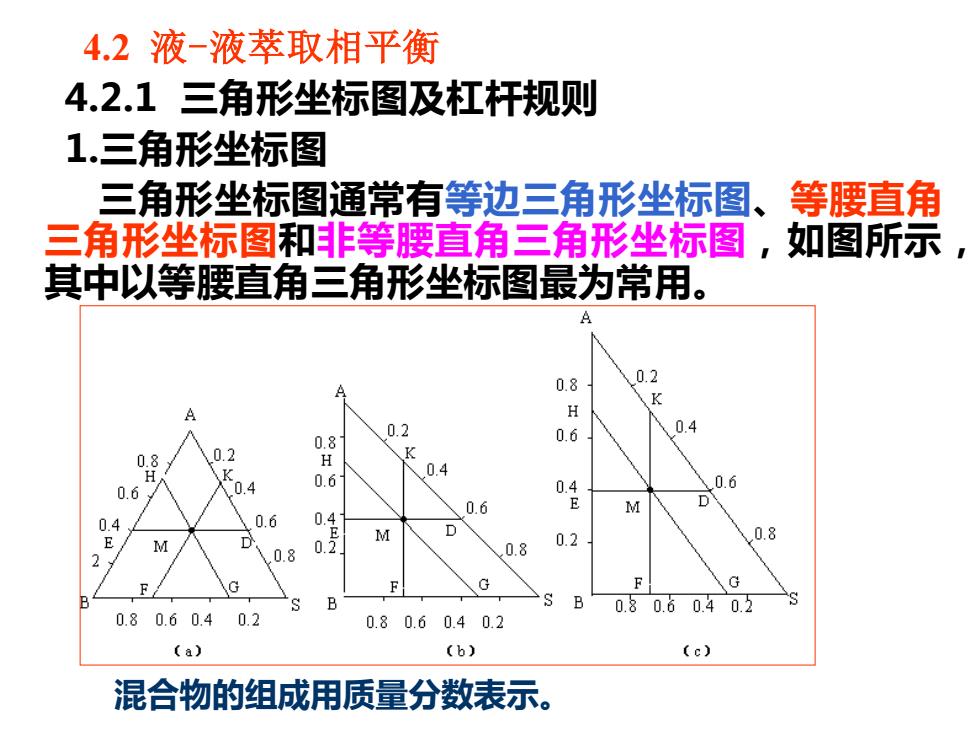
4.2液-液萃取相平衡 4.2.1三角形坐标图及杠杆规则 1.三角形坐标图 三角形坐标图通常有等边三角形坐标图、等腰直角 三角形坐标图和非等腰直角三角形坐标图,如图所示 其中以等腰直角三角形坐标图最为常用。 A 0.8 0.2 A H 0.2 0.8 0.6 0.4 0.8 0.2 H 0.4 0.6 .0.4 0. 0.4 0.6 0.6 E M 0.6 0.4 E 高 D 0.8 0号 M D 0.8 0.2 0.8 F F 0.80.60.40.2 0.80.60.4 0.2 0.80.60.40.2 (a) (b) (c) 混合物的组成用质量分数表示
4.2 液-液萃取相平衡 4.2.1 三角形坐标图及杠杆规则 1.三角形坐标图 三角形坐标图通常有等边三角形坐标图、等腰直角 三角形坐标图和非等腰直角三角形坐标图,如图所示, 其中以等腰直角三角形坐标图最为常用。 图11-1 三角形相图 混合物的组成用质量分数表示
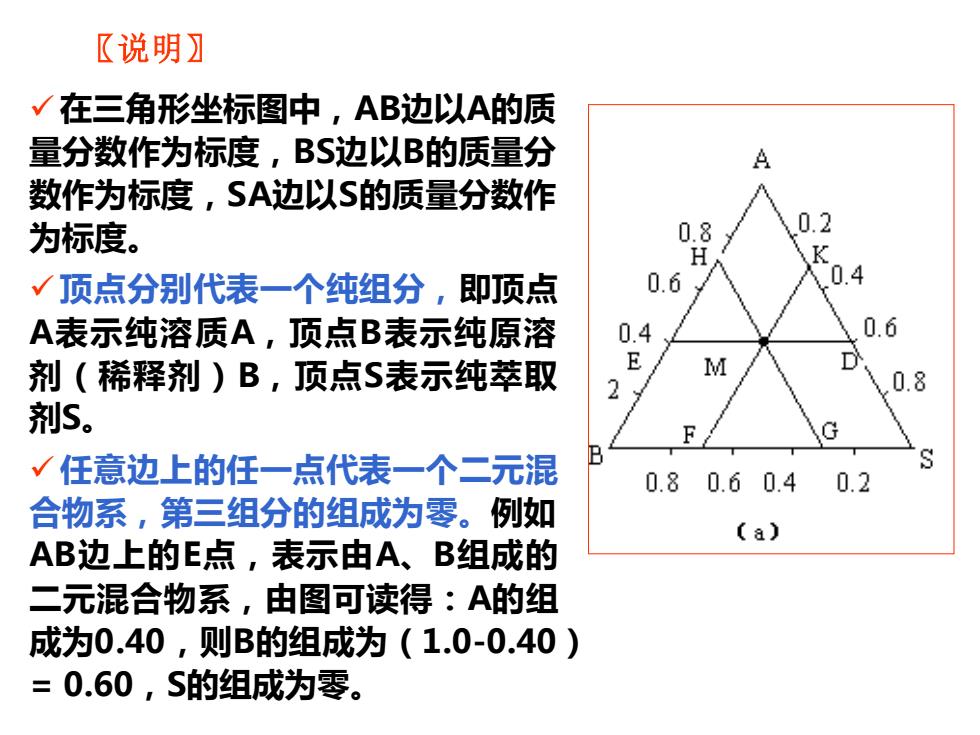
〖说明】 √在三角形坐标图中,AB边以A的质 量分数作为标度,BS边以B的质量分 A 数作为标度,SA边以S的质量分数作 为标度。 0.8 0.2 K √顶点分别代表一个纯组分,即顶点 0.6 .4 A表示纯溶质A,顶点B表示纯原溶 0.4 0.6 剂(稀释剂)B,顶点S表示纯萃取 E M 2 0.8 剂S。 √任意边上的任一点代表一个二元混 0.80.6 0.4 0.2 合物系,第三组分的组成为零。例如 (a) AB边上的E点,表示由A、B组成的 二元混合物系,由图可读得:A的组 成为0.40,则B的组成为(1.0-0.40) =0.60,S的组成为零
〖说明〗 ✓在三角形坐标图中,AB边以A的质 量分数作为标度,BS边以B的质量分 数作为标度,SA边以S的质量分数作 为标度。 ✓顶点分别代表一个纯组分,即顶点 A表示纯溶质A,顶点B表示纯原溶 剂(稀释剂)B,顶点S表示纯萃取 剂S。 ✓任意边上的任一点代表一个二元混 合物系,第三组分的组成为零。例如 AB边上的E点,表示由A、B组成的 二元混合物系,由图可读得:A的组 成为0.40,则B的组成为(1.0-0.40) = 0.60,S的组成为零

三角形坐标图的意义 √三角形坐标图内任一点代表一个三 元混合物系。如M点,其组成可按下 法确定:过点M分别作对边的平行线 0.2 ED、HG、KF,则由点E、G、K可 0.8 H K 直接读得A、B、S的组成分别为: 0.4 0.6 Xa=0.4、=0.3、K=0.3; 0.6 √在诸三角形坐标图中,等腰直角三 0 M D 0.8 角形坐标图可直接进行标绘,且读数 较为方便,故目前多采用等腰直角三 F 角形坐标图。 0.80.60.40.2 √实际应用时,一般首先由两直角边 (b) 的标度读得A、S的组成,再根据归 一化条件求得B的组成
三角形坐标图的意义 ✓三角形坐标图内任一点代表一个三 元混合物系。如M点,其组成可按下 法确定:过点M分别作对边的平行线 ED、HG、KF, 则由点 E、G、K 可 直接读得A、B、S的组成分别为: xA=0.4、xB=0.3、xS=0.3; ✓在诸三角形坐标图中,等腰直角三 角形坐标图可直接进行标绘,且读数 较为方便,故目前多采用等腰直角三 角形坐标图。 ✓实际应用时,一般首先由两直角边 的标度读得A、S的组成,再根据归 一化条件求得B的组成