
第二章气体吸收 2.1概述 2.2气体吸收的平衡关系 2.3气体吸收速率方程式 2.4低组成气体吸收的计算 2.5吸收系数 2.6其它吸收与解吸 本章总结一联系图
第二章 气体吸收 2.1 概述 2.2 气体吸收的平衡关系 2.3 气体吸收速率方程式 2.4 低组成气体吸收的计算 2.5 吸收系数 2.6 其它吸收与解吸 本章总结-联系图
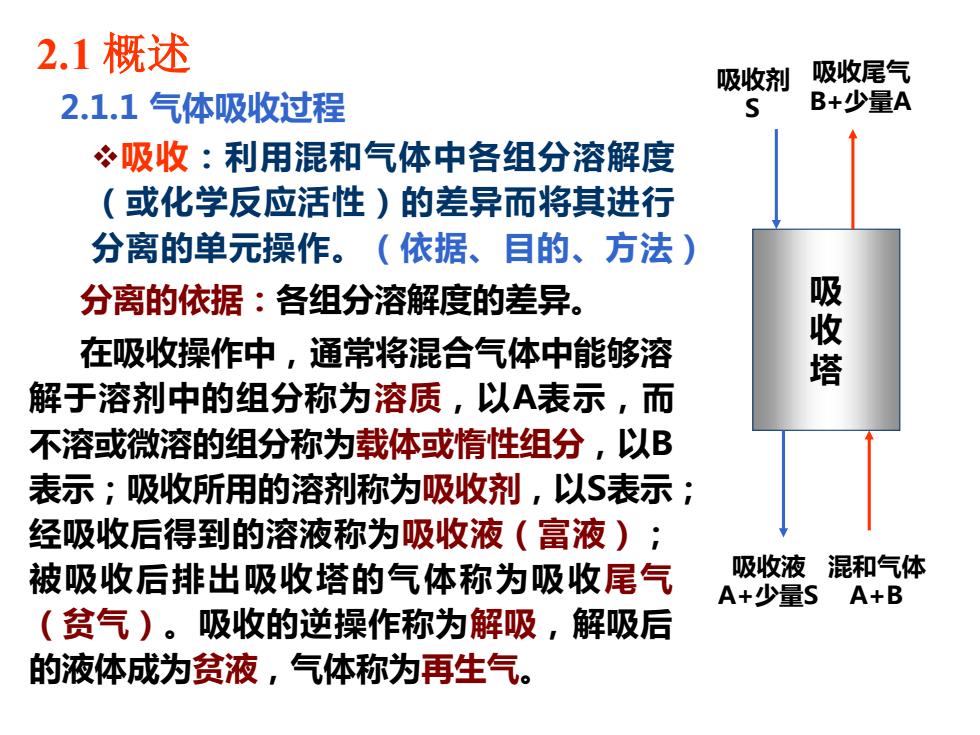
2.1概述 吸收剂 吸收尾气 2.1.1气体吸收过程 B+少量A 冬吸收:利用混和气体中各组分溶解度 (或化学反应活性)的差异而将其进行 分离的单元操作。(依据、目的、方法) 分离的依据:各组分溶解度的差异。 吸 在吸收操作中,通常将混合气体中能够溶 解于溶剂中的组分称为溶质,以A表示,而 不溶或微溶的组分称为载体或惰性组分,以B 表示;吸收所用的溶剂称为吸收剂,以$表示; 经吸收后得到的溶液称为吸收液(富液); 被吸收后排出吸收塔的气体称为吸收尾气 吸收液混和气体 A+少量SA+B (贫气)。吸收的逆操作称为解吸,解吸后 的液体成为贫液,气体称为再生气
2.1 概述 2.1.1 气体吸收过程 ❖吸收:利用混和气体中各组分溶解度 (或化学反应活性)的差异而将其进行 分离的单元操作。(依据、目的、方法) 分离的依据:各组分溶解度的差异。 在吸收操作中,通常将混合气体中能够溶 解于溶剂中的组分称为溶质,以A表示,而 不溶或微溶的组分称为载体或惰性组分,以B 表示;吸收所用的溶剂称为吸收剂,以S表示; 经吸收后得到的溶液称为吸收液(富液); 被吸收后排出吸收塔的气体称为吸收尾气 (贫气)。吸收的逆操作称为解吸,解吸后 的液体成为贫液,气体称为再生气。 吸 收 塔 吸收液 A+少量S 混和气体 A+B 吸收剂 S 吸收尾气 B+少量A

2.1.2气体吸收的分类 √按溶质与溶剂间是否发生显著化学反应分: 冬物理吸收:如水吸收二氧化碳 冬化学吸收:如硫酸吸收氨 √按被吸收组分数目分: 冬单组分吸收:如水吸收氯化氢气体 冬多组分吸收:如洗油处理焦炉气,苯、甲苯、二甲苯等 组分均溶解 √按吸收前后温度是否发生变化分: 等温吸收: 冬非等温吸收 √按溶质在气液两相中组成大小分: 冬低组成吸收:摩尔分数>0.1 ÷高组成吸收:摩尔分数≤0.1 本章重点讨论单组分低组成的等温物理吸收
2.1.2 气体吸收的分类 ✓按溶质与溶剂间是否发生显著化学反应分: ❖物理吸收:如水吸收二氧化碳 ❖化学吸收:如硫酸吸收氨 ✓按被吸收组分数目分: ❖单组分吸收:如水吸收氯化氢气体 ❖多组分吸收:如洗油处理焦炉气,苯、甲苯、二甲苯等 组分均溶解 ✓按吸收前后温度是否发生变化分: ❖等温吸收: ❖非等温吸收 ✓按溶质在气液两相中组成大小分: ❖低组成吸收:摩尔分数>0.1 ❖高组成吸收:摩尔分数≤0.1 本章重点讨论单组分低组成的等温物理吸收

2.1.3气体吸收的工业应用 √净化气体或精制气体。如用水脱除合成氨原料气中的C02, 用丙酮脱除石油裂解气中的乙炔等以除去气体中的有害成分, 便于下一步的反应顺利进行。 √制备液体产品。如用水吸收HC气体制备盐酸,用水吸收 NO2气体制硝酸,用水吸收NH3气制氨水,用稀硫酸吸收SO3 制浓硫酸等均属于吸收操作。 √回收有用物质。如用洗油从焦炉气中回收粗苯(苯、甲苯、 二甲苯)等。 √环境保护的需要。如用碱液吸收工业过程排放的废气中含有 的一些有害物质如SO2、H2S、NO、HF等
2.1.3 气体吸收的工业应用 ✓净化气体或精制气体。如用水脱除合成氨原料气中的CO2, 用丙酮脱除石油裂解气中的乙炔等以除去气体中的有害成分, 便于下一步的反应顺利进行。 ✓制备液体产品。如用水吸收HCl气体制备盐酸,用水吸收 NO2气体制硝酸,用水吸收NH3气制氨水,用稀硫酸吸收SO3 制浓硫酸等均属于吸收操作。 ✓回收有用物质。如用洗油从焦炉气中回收粗苯(苯、甲苯、 二甲苯)等。 ✓环境保护的需要。如用碱液吸收工业过程排放的废气中含有 的一些有害物质如SO2、H2S、NO、HF等

2.1.4吸收剂的选择 完成一个吸收过程需选择合适的溶剂,对吸收剂的要求是: √溶解度大。可提高吸收速率并减少吸收剂的耗用量。 √选择性好。对溶质有良好的溶解能力,而对其它组分不溶或 微溶,且便于再生,否则不能实现分离的目的。 √挥发度小,即在操作温度下蒸汽压小,基本不汽化。离开吸 收设备的气体被吸收剂所饱和,吸收剂挥发度愈大,损失量便 愈大。 √粘度低。可改善吸收设备内的流动状况,从而提高传质速率 和传热速率,有助于降低泵的功率,减小传质、传热阻力。 √其它。来源充分,价格低廉,无毒,无腐蚀性不易燃,不发 泡,化学性质稳定等。 2.1.5吸收流程(略)
2.1.4 吸收剂的选择 完成一个吸收过程需选择合适的溶剂,对吸收剂的要求是: ✓溶解度大。可提高吸收速率并减少吸收剂的耗用量。 ✓选择性好。对溶质有良好的溶解能力,而对其它组分不溶或 微溶,且便于再生,否则不能实现分离的目的。 ✓挥发度小,即在操作温度下蒸汽压小,基本不汽化。离开吸 收设备的气体被吸收剂所饱和,吸收剂挥发度愈大,损失量便 愈大。 ✓粘度低。可改善吸收设备内的流动状况,从而提高传质速率 和传热速率,有助于降低泵的功率,减小传质、传热阻力。 ✓其它。来源充分,价格低廉,无毒,无腐蚀性不易燃,不发 泡,化学性质稳定等。 2.1.5 吸收流程(略)

2.2气体吸收的相平衡关系 2.2.1气体在液体中的溶解度 在一定温度和压强下,当气体混合物与一定量的液体吸收剂 接触时,溶质组分便不断进入液相中,这一过程称为溶解即吸收。 而同时已被溶解的溶质也将不断摆脱液相的束缚重新回到气相, 该过程称为解吸。这两个过程互为逆过程并具有各自的速率,当 气液两相经过长时间的接触后,溶质的溶解速率与解吸速率达到 相等时,气液两相中溶质的浓度就不再因两相间的接触而变化, 这种状态称为相际动平衡,简称相平衡或平衡。 平衡状态下气相中的溶质分压称为平衡分压或饱和分压,液 相中的溶质组成称为平衡组成或饱和组成。 气体在液体中的溶解度,是指气体在液体中的饱和组成,常 以单位质量或体积的液体所含溶质的质量来表示。 气体的溶解度标明一定条件下吸收过程可能达到的极限程度
2.2 气体吸收的相平衡关系 2.2.1 气体在液体中的溶解度 在一定温度和压强下,当气体混合物与一定量的液体吸收剂 接触时,溶质组分便不断进入液相中,这一过程称为溶解即吸收。 而同时已被溶解的溶质也将不断摆脱液相的束缚重新回到气相, 该过程称为解吸。这两个过程互为逆过程并具有各自的速率,当 气液两相经过长时间的接触后,溶质的溶解速率与解吸速率达到 相等时,气液两相中溶质的浓度就不再因两相间的接触而变化, 这种状态称为相际动平衡,简称相平衡或平衡。 平衡状态下气相中的溶质分压称为平衡分压或饱和分压,液 相中的溶质组成称为平衡组成或饱和组成。 气体在液体中的溶解度,是指气体在液体中的饱和组成,常 以单位质量或体积的液体所含溶质的质量来表示。 气体的溶解度标明一定条件下吸收过程可能达到的极限程度
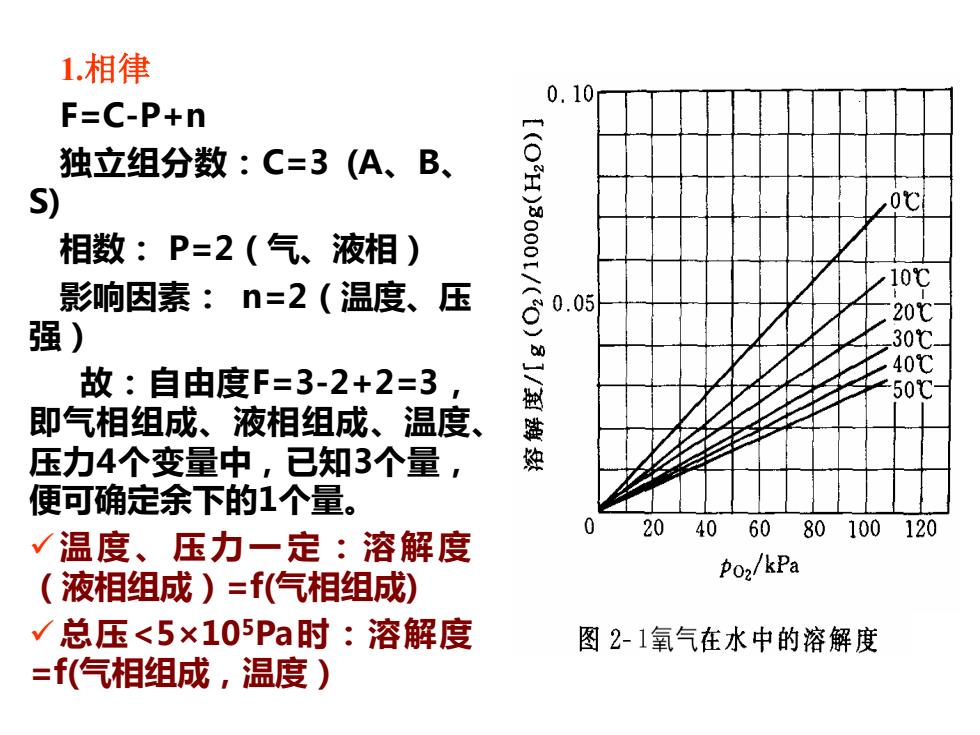
1.相律 0.10 F=C-P+n 独立组分数:C=3(A、B、 S) 相数:P=2(气、液相) [(OH)0001/( ,0℃ 影响因素:n=2(温度、压 强) g0.0l 故:自由度F=3-2+2=3 40℃ 50℃ 即气相组成、液相组成、温度、 压力4个变量中,已知3个量 便可确定余下的1个量。 0 20406080100120 √温度、压力一定:溶解度 (液相组成)=(气相组成) Po2/kPa √总压<5×105Pa时:溶解度 图2-1氧气在水中的溶解度 =f(气相组成,温度)
1.相律 F=C-P+n 独立组分数:C=3 (A、B、 S) 相数: P=2(气、液相) 影响因素: n=2(温度、压 强) 故:自由度F=3-2+2=3, 即气相组成、液相组成、温度、 压力4个变量中,已知3个量, 便可确定余下的1个量。 ✓温 度、压 力 一 定 : 溶 解 度 (液相组成)=f(气相组成) ✓总压<5×105Pa时:溶解度 =f(气相组成,温度)
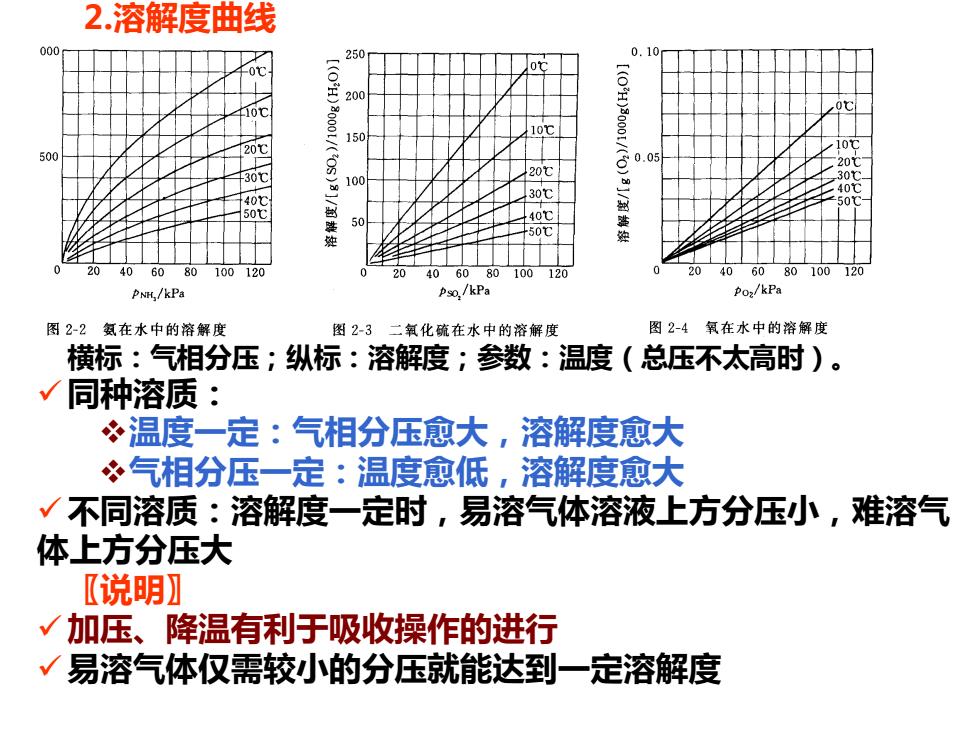
2.溶解度曲线 000 250 0.10 00 20 10℃ 150 10℃ 500 20℃ 30℃ 100 20℃ 40 30℃ 50t (0H)400g口/(V)5)9高牌盘热然 (0iaa00/()al/制换 So 40℃ 50℃ 406080100120 40 60 80 100120 20 406080100 120 PNH,/kPa Pso,/kPa Poz/kPa 图2-2氨在水中的溶解度 图23二氧化疏在水中的溶解度 图2-4氧在水中的溶解度 横标:气相分压;纵标:溶解度;参数:温度((总压不太高时)。 √同种溶质: ÷温度一定:气相分压愈大,溶解度愈大 ?气相分压一定:温度愈低,溶解度愈大 √ 不同溶质:溶解度一定时,易溶气体溶液上方分压小,难溶气 体上方分压大 〖说明】 √加压、降温有利于吸收操作的进行 √易溶气体仅需较小的分压就能达到一定溶解度
2.溶解度曲线 横标:气相分压;纵标:溶解度;参数:温度(总压不太高时)。 ✓同种溶质: ❖温度一定:气相分压愈大,溶解度愈大 ❖气相分压一定:温度愈低,溶解度愈大 ✓不同溶质:溶解度一定时,易溶气体溶液上方分压小,难溶气 体上方分压大 〖说明〗 ✓加压、降温有利于吸收操作的进行 ✓易溶气体仅需较小的分压就能达到一定溶解度

2.2.2亨利定律 随着对相平衡关系的研究,发现很多气体在浓度较小时其溶 解度曲线为通过坐标原点的直线,这一规律用亨利(Henry)定 律进行描述。 1.pe=Ex 称为吸收过程的相平衡方程一 亨利定律。 式中:P。一溶质A在气相中的平衡分压,kPa; X一溶质A在液相中的摩尔分率; E一亨利系数,kPa。 表明:当总压不高(<0.5MPa)时,在一定温度下气液两相 达到平衡时,稀溶液上方气相中溶质的平衡分压与液相中溶质 的摩尔分率成正比
2.2.2 亨利定律 随着对相平衡关系的研究,发现很多气体在浓度较小时其溶 解度曲线为通过坐标原点的直线,这一规律用亨利(Henry)定 律进行描述。 1. pe=Ex 称为吸收过程的相平衡方程 —— 亨利定律。 式中: pe— 溶质A在气相中的平衡分压,kPa x —— 溶质A E —— 亨利系数,kPa。 表明:当总压不高(<0.5MPa)时,在一定温度下气液两相 达到平衡时,稀溶液上方气相中溶质的平衡分压与液相中溶质 的摩尔分率成正比

〖说明〗 √理想溶液:拉乌尔定律: p。=px.E=pA √非理想溶液: E≠pA √低浓度气体吸收:E=常量 √难溶物系:E≠常量,但当P0.1MPa时,E=f(Pt) √E由实验测定确定:以P。对作图,当X一→0,P。的值即 为E。常见物系的E可查有关手册。 √对于一定的气体和一定的溶剂,E值随温度变化:t↑,E↑, 心,体现气体溶解度随温度升高而减小的变化趋势。 同一溶剂中: 冬易溶气体的E值很小 冬难溶气体的E值相对较大
〖说明〗 ✓理想溶液:拉乌尔定律: ✓非理想溶液: ✓低浓度气体吸收:E=常量 ✓难溶物系:E≠常量,但当P0.1MPa时,E=f(P,t) ✓E由实验测定确定:以pe/x对x作图,当x→0, pe/x的值即 为E。常见物系的E可查有关手册。 ✓对于一定的气体和一定的溶剂,E值随温度变化:t↑,E↑, x↓,体现气体溶解度随温度升高而减小的变化趋势。 ✓同一溶剂中: ❖易溶气体的E值很小 ❖难溶气体的E值相对较大。 e A A p = p x E = p A E p