
3.3理想间歇反应器中的均相可逆 反应 化学化工学院 化学反应工程 1王红军
化学化工学院 化学反应工程 1王红军 3.3理想间歇反应器中的均相可逆 反应

3.3.1可逆反应的特点 ad+bBcC 吉 净反应速率等于正反应和逆反应速率之差 (-r)=kCaCh-kzCc, a,B,y分别为正反应和逆反应级数。 当反应达到平衡时,净反应速率为零。 k2ce“CB 若反应物和产物对正反应和逆反应 速率都有影响,则 不( -)=kC4CRC-kCCC 化学化工学院 化学反应工程 2王红军
化学化工学院 化学反应工程 2王红军 1 2 1 2 1 2 ( ) , , , ( ) k k A A B C e Ae Be A A B C A B C aA bB cC r k C C k C C c C r k C C C k C C C + − = − = − = − 1 2 净反应速率等于正反应和逆反应速率之差 分别为正反应和逆反应级数。 当反应达到平衡时,净反应速率为零。 k k 若反应物和产物对正反应和逆反应 速率都有影响,则 3.3.1 可逆反应的特点
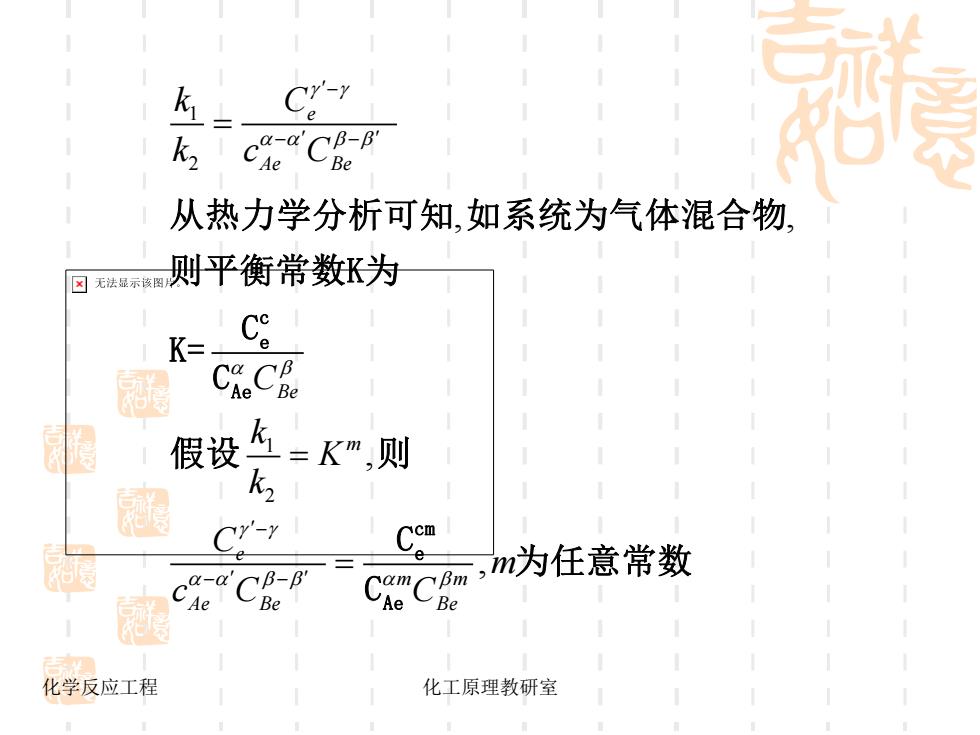
C-Y k2 从热力学分析可知,如系统为气体混合物, ☒无法显示该图 则平衡常数K为 K= CheCke 假设 =K,则 k2 Cr-r ca-a ,m为任意常数 Ae CaeC 化学反应工程 化工原理教研室
化学反应工程 化工原理教研室 1 2 1 2 , , , , e Ae Be Be m e m m Ae Be Be k C k c C C k K k C m c C C − − − − − − = = = c e Ae cm e Ae 从热力学分析可知 如系统为气体混合物 则平衡常数K为 C K = C 假设 则 C 为任意常数 C

a-a_(B-1_-y2=m a b 表明可逆反应中对任何反应组分而言的反应级数 之差与该反应的化学计量系数之比为定值。该式 可以作为验证可逆反应动力学方程测定结果的判定。 化学平衡常数与正逆反应速率常数的K=1关系,只 k 有在m=1时才是正确的。 化学反应工程 化工原理教研室
化学反应工程 化工原理教研室 2 ( ) ( ) ( ) m a b c k − − − = = = 1 表明可逆反应中对任何反应组分而言的反应级数 之差与该反应的化学计量系数之比为定值。该式 可以作为验证可逆反应动力学方程测定结果的判定。 k 化学平衡常数与正逆反应速率常数的K= 关系,只 有在m=1时才是正确的

对一级反应 A台R 5=-=C,kC即为: dt Ta=k C4o(1-X)-k2C40X 当达到平衡时,r4=0,即为: kCe-kCc=O,由此可见 K h=CReC4-CA k2 Che Che 1-XAe 该式表明:可逆反应的反应程度受平衡条件的限制,平 衡常数与反应温度和热效应间满足范霍夫方程。 化学反应工程 化工原理教研室
化学反应工程 化工原理教研室 对一级反应 1 2 1 0 2 0 1 2 Re 1 Re 0 2 , (1 ) 0, 0, 1 A A A R A A A A A A Ae A A Ae Ae Ae Ae A R dC r k C k C dt r k C x k C x r k C k C k C C C x K k C C x = − = − = − − = − = − = = = = − 即为: 当达到平衡时, 即为: 由此可见 该式表明:可逆反应的反应程度受平衡条件的限制,平 衡常数与反应温度和热效应间满足范霍夫方程

dInk AHo dT RT? -△H 如果AH与T无关,则:IK=ke7 对于吸热反应AH>0,T个,K个 对于放热反应△H<0,T个,K↓ 则平衡常数和平衡转化率的关系为: K 1 X Ae 1+K 1 k20 (E-E,RT k10 周 由此可见,可逆吸热反应的平衡转化率随温度升高 而升高,而可逆放热反应的平衡转化率随温度升高而 降低。 化学反应工程 化工原理教研室
化学反应工程 化工原理教研室 1 2 0 2 0 20 ( )/ 10 ln : 1 1 1 H RT Ae E E RT d k H dT RT k e K x K k e k − − = = = = + + 如果 H与T无关,则: K 对于吸热反应 H>0,T ,K 对于放热反应 H<0,T ,K 则平衡常数和平衡转化率的关系为 由此可见,可逆吸热反应的平衡转化率随温度升高 而升高,而可逆放热反应的平衡转化率随温度升高而 降低

3.3.2可逆反应的速率 A台P 反应速率式为:r4= dCi-kCx-kCn-kCx-k(Cx-CA) dt 平衡时,(-rA)=0,即(-rA)=0=kCe-k(C加-C),则 (-r4)=(k+k2)(CA-Ce) (-r)=(k+k2)Cao(xae-xA) 该式说明可逆反应速率的浓度效应与简单反应相 同,随反应物浓度的增加,反应速率单调上升。 化学反应工程 化工原理教研室
化学反应工程 化工原理教研室 3.3.2可逆反应的速率 1 2 1 2 1 2 1 2 1 2 0 : ( ) , ( ) 0, ( ) 0 ( ), ( ) ( )( ) ( ) ( ) ( ) A A A p A Ao A A A Ae Ao Ae A A Ae A A Ae A A P dC r k C k C k C k C C dt r r k C k C C r k k C C r k k C x x = − = − = − − − = − = = − − − = + − − = + − 反应速率式为 平衡时 即 则 该式说明可逆反应速率的浓度效应与简单反应相 同,随反应物浓度的增加,反应速率单调上升

温度对可逆反应反应速率的影响及最佳温度 一、温度对不同类型单反应速率的影响及最佳温 度 1、 不可逆反应 ■2、 可逆吸热反应 ·3、可逆放热反应 二 可逆放热反应的最佳温度曲线 國 化学反应工程 化工原理教研室
化学反应工程 化工原理教研室 温度对可逆反应反应速率的影响及最佳温度 ▪ 一、温度对不同类型单反应速率的影响及最佳温 度 ▪ 1、不可逆反应 ▪ 2、可逆吸热反应 ▪ 3、可逆放热反应 ▪ 二、可逆放热反应的最佳温度曲线

一、 温度对不同类型单反应速率的影响及最佳温度 ·1、不可逆反应: 绝大多数反应的速率常数随温度升高而增大,不可逆 单反应由于不存在化学反应平衡的限制,无论是放热反应 或吸热反应.无论反应进行的程度如何,都应该在尽可能 高的温度下进行反应,以尽可能提高反应速率.获得较高 的反应产率。 在实际生产中,要考虑以下问题: ()温度过高,催化剂活性下降或失活; (2)设备材质的选取 (③)热能的供应 (④个)伴有副反应时,会影响反应的选择性 化学反应工程 化工原理教研室
化学反应工程 化工原理教研室 一、温度对不同类型单反应速率的影响及最佳温度 ▪ 1、不可逆反应: 绝大多数反应的速率常数随温度升高而增大,不可逆 单反应由于不存在化学反应平衡的限制,无论是放热反应 或吸热反应.无论反应进行的程度如何,都应该在尽可能 高的温度下进行反应,以尽可能提高反应速率.获得较高 的反应产率。 在实际生产中,要考虑以下问题: ⑴ 温度过高,催化剂活性下降或失活; ⑵ 设备材质的选取 ⑶ 热能的供应 ⑷ 伴有副反应时,会影响反应的选择性

温度对不同类型单反应速率的影响及最佳温度 2、可逆吸热反应 ,tm "fo) =kfo K,f(y) f50y) 随温度的升高,k升高,K,升高, K,f(y) 也升高 总的结果,随温度的升高,总的反应速率提高。因此,对于 可逆吸热反应,也应尽可能在较高温度下进行,这样既有利 于提高平衡转化率,又可提高反应速率。同时,也应考虑 些因素的限制。 例如,天然气的蒸汽转化反应 CH4+HO→CO+H, 是可逆吸热反应,提高温度有利于提高反应速率并提高甲烷的平 衡转化率,但考虑到设备材质等条件限制,一般一段转化炉内温 度于800-850℃。 化工原理教研室
化学反应工程 化工原理教研室 一、温度对不同类型单反应速率的影响及最佳温度 2、可逆吸热反应 = − = − = − ( ) ( ) ( ) 1 ( ) ( ) ( ) ( ) ( ) 1 1 2 1 1 1 1 2 2 1 1 2 2 1 1 K f y f y k f y k f y k f y r k f y k f y k f y y A 随温度的升高,k1升高, 升高, 也升高 总的结果,随温度的升高,总的反应速率提高。因此,对于 可逆吸热反应,也应尽可能在较高温度下进行,这样既有利 于提高平衡转化率,又可提高反应速率。同时,也应考虑一 些因素的限制。 K y − ( ) ( ) 1 1 2 K f y f y y 例如,天然气的蒸汽转化反应 是可逆吸热反应,提高温度有利于提高反应速率并提高甲烷的平 衡转化率,但考虑到设备材质等条件限制,一般一段转化炉内温 度小于800-850℃。 CH4 + H2 O →CO+ H2