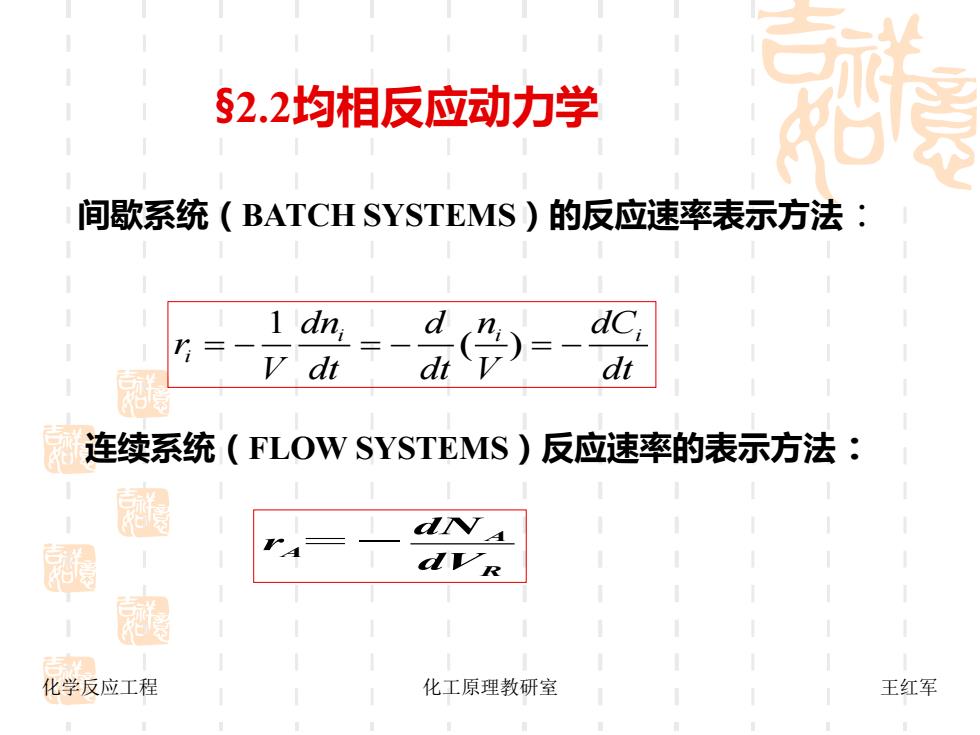
§2.2均相反应动力学 间歇系统(BATCH SYSTEMS)的反应速率表示方法: v dt di dt 连续系统(FLOW SYSTEMS)反应速率的表示方法: dNA 圈 dvR 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 间歇系统(BATCH SYSTEMS)的反应速率表示方法: 1 i i i i dn n dC d r V dt dt V dt = − = − ( ) = − 连续系统(FLOW SYSTEMS)反应速率的表示方法: =- A A R dN r dV §2.2均相反应动力学

§2.2.1均相与预混合 均相反应的前提:参与反应的所有物料达到分子尺 度上的均匀,如:均一的气相或液相(气相均相反应和液 相均相反应) 从工程的观点来看,均相反应的特点是反应系统已经 达到分子尺度的均匀混合,也就意味着排除了反应物和产 物之间的扩散传递问题。在实际反应器中,两种或两种以 上的反应物之间能否均一,是均相反应得以实现的可能性, 这就要求具有充分的预混合过程。 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 §2.2.1均相与预混合 ▪ 均相反应的前提:参与反应的所有物料达到分子尺 度上的均匀,如:均一的气相或液相(气相均相反应和液 相均相反应) ▪ 从工程的观点来看,均相反应的特点是反应系统已经 达到分子尺度的均匀混合,也就意味着排除了反应物和产 物之间的扩散传递问题。在实际反应器中,两种或两种以 上的反应物之间能否均一,是均相反应得以实现的可能性, 这就要求具有充分的预混合过程

§2.2.1均相与预混合 预混合问题:指物料在进行反应之前能否达到分子尺度上 的均匀问题。实现的方法:机械搅拌或者是高速流体造成 的射流混合。原理就是利用湍流将流体破碎成流体微团。 微团之间还要通过分子扩散达到分子尺度的均一。扩散同 时伴有反应的发生。若预混合过程内进行的反应可以忽略, 则为均相反应过程。反之则为非均相反应。 工程上实际的均相反应应当满足的条件为: 。(1)反应系统可以成为均相 黑 (2)预混合过程的时间远小于反应时间 國 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 §2.2.1均相与预混合 ▪ 预混合问题:指物料在进行反应之前能否达到分子尺度上 的均匀问题。实现的方法:机械搅拌或者是高速流体造成 的射流混合。原理就是利用湍流将流体破碎成流体微团。 微团之间还要通过分子扩散达到分子尺度的均一。扩散同 时伴有反应的发生。若预混合过程内进行的反应可以忽略, 则为均相反应过程。反之则为非均相反应。 工程上实际的均相反应应当满足的条件为: (1)反应系统可以成为均相; (2)预混合过程的时间远小于反应时间

§2.2.2 反应动力学表达式 特定反应体系 r=f(p,T,C) 实验测定结果表明,在多数情况下,浓度和温度单独地影 响反应速率,则: 调 r=k(T)f(C) 对于一定温度下的反应为f(T常数,用表示,即: 称为反应速率常数或温度效应 f(T)=k 圈 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 §2.2.2 反应动力学表达式 ▪ 特定反应体系 ▪ 实验测定结果表明,在多数情况下,浓度和温度单独地影 响反应速率,则: 对于一定温度下的反应为 常数,用 表示,即: 称为反应速率常数或温度效应 r f p,T ,C = ( ) r k T f C = ( ) ( ) f T( ) k f T k ( ) =

而《带可以表示成者组分浓度的幂通数死式,即得 f(C)=ΠCa 其中表示组分的反应级数 对于不可逆反应 DA+UgB=vL+UyM ”4=k.CCCC称为反应速率的微分式 其中a,bl,m为各组分的反应级数,a+b++m=n为反应的 总级数. 型 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 A B L M A B L M + = + a b l m A c A B L M r k C C C C = 而 常可以表示成各组分浓度的幂函数形式,即: 其中 表示组分的反应级数 对于不可逆反应 f C( ) ( ) i f C C = 称为反应速率的微分式 其中a,b,l,m为各组分的反应级数,a+b+l+m=n为反应的 总级数

注意:1、反应级数与化学计量系数的区别以及反应 级数的求解方法(反应级数并不等于化学计量系数,它 的大小需要由实验确定,只有基元反应的反应级数等 于其化学计量系数): 2、对于气相组分,反应物系的组成不仅可以 用摩尔浓度表示,而且可以用组分的分压、组分的摩 尔分率,加压下可用逸度表示。 和 圈 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 注意:1、反应级数与化学计量系数的区别以及反应 级数的求解方法(反应级数并不等于化学计量系数,它 的大小需要由实验确定,只有基元反应的反应级数等 于其化学计量系数); 2、对于气相组分,反应物系的组成不仅可以 用摩尔浓度表示,而且可以用组分的分压、组分的摩 尔分率,加压下可用逸度表示

§2.2.3反应速率的温度效应和反应活化能 Arrhenius公式 k=ko exp( Ink lnk=lnk。 E。 dInk E RT dT RT2 ko频率因子和指数因子, 1/T E 活化能 activation energy E物理意义 圈 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 §2.2.3反应速率的温度效应和反应活化能 ▪ Arrhenius公式 ▪ 频率因子和指数因子, ▪ 活化能 activation energy ▪ 物理意义 0 k k exp T = C g E (- ) R 0 ln k ln k T = C g E - R 1/T lnk 2 d k E ln dT RT = 0 k E E

§2.2.3反应速率的温度效应和反应活化能 活化能指为了使反应物分子激发成活化分子所 需的最小能量,反应物分子必须被激发成活化分 子才能发生化学反应,它是标志化学反应进行难 易程度的标志。 活化能的实验测定方法: lnk=lnk。 活化能与反应热效应的区别 墨 國 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 §2.2.3反应速率的温度效应和反应活化能 ▪ 活化能指为了使反应物分子激发成活化分子所 需的最小能量,反应物分子必须被激发成活化分 子才能发生化学反应,它是标志化学反应进行难 易程度的标志。 ▪ 活化能的实验测定方法: ▪ 活化能与反应热效应的区别 0 ln k ln k T = C g E - R
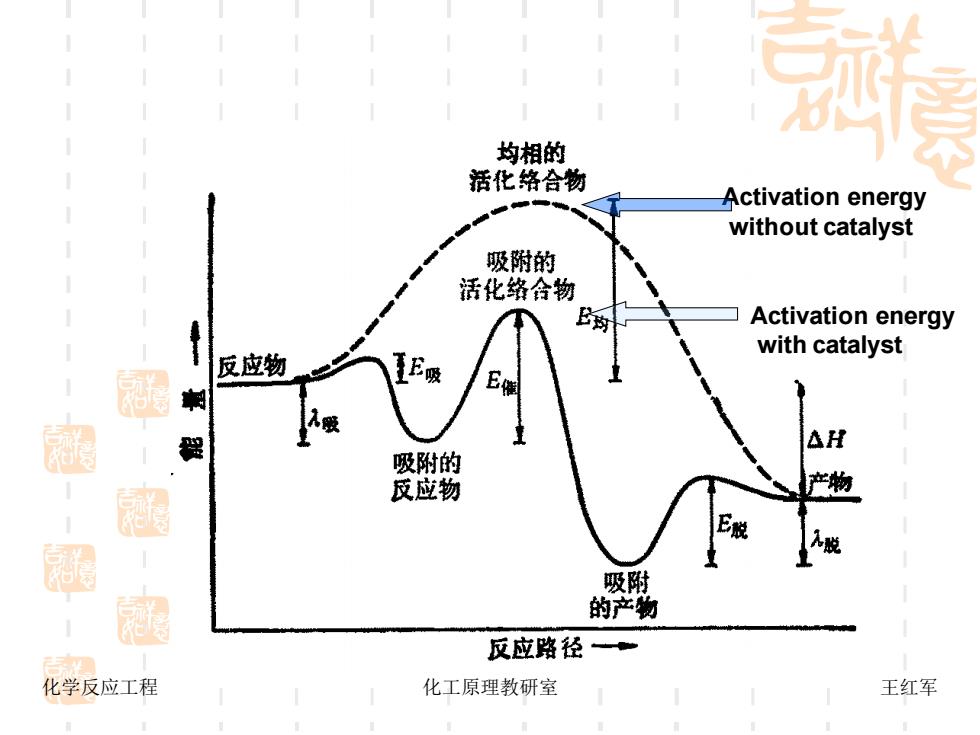
均相的 活化络合物 Activation energy without catalyst 吸附的 活化络会物 Activation energy with catalyst 反应物 超 程 △H 吸附的 -魅 反应物 产物 吸附 图 的产物 反应路径 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 Activation energy without catalyst Activation energy with catalyst

活化态与反应物能量差值称为活化能;产物 与反应物能量差值为热效应;当产物能位比反应 物能位高时,过程为吸热反应,反之为放热反应。 活化能与热效应之间是相互独立的,没有直 接的关系。 化学反应工程 化工原理教研室 王红军
化学反应工程 化工原理教研室 王红军 活化态与反应物能量差值称为活化能;产物 与反应物能量差值为热效应;当产物能位比反应 物能位高时,过程为吸热反应,反之为放热反应。 活化能与热效应之间是相互独立的,没有直 接的关系