
实验二常用实验动物的捉拿固定和给药方法 【实验目的】掌握常用动物小鼠、家兔的捉拿固定及给药方法 【实验材料】 1.器材:注射器(1ml、5ml)、注射针头(4.5号、6号、7号)、9号灌胃针、开口器、兔箱、鼠 笼、镊子、10号导尿管、酒精棉球 2.药品:生理盐水、苦味酸溶液 3.动物:小白鼠 、家兔 【方法步骤】 (一)小白鼠的捉拿固定和给药方法 1.小白鼠的捉拿固定方法 方法一(双手法):右手提起鼠尾放在粗糙物(如鼠笼盖)上面,向后轻拉鼠尾,用左手拇指 和食指捏住其双耳及头背部皮肤,无名指、小指将小鼠尾巴固定在掌心,便将小鼠完全固定。 方法二(单手法):先将拇指和食指抓住鼠尾,用小拇指、无名指和手掌压住尾根部,腾出的 拇指、食指及中指抓住小鼠双耳及头背部皮肤而固定。 2.给药方法 (1)灌用法用左手固定小鼠,将其腹部朝上,颈部拉直,右手用带灌胃针头注射器(事先吸取药 液),将针头从口角插入口腔,针头紧贴上颚进入食道。若遇阻力,应退出重新再进针 注意:切不可用力过猛,防止损伤或误入气管导致死亡。 (2)腹腔注射用左手将小鼠固定好后,将其腹部朝上,颈部拉直,右手持带有针头(5~6号)的注 射器,从耻骨联合上左下腹外侧向头端方向以3045°角刺入腹腔。可先刺入皮下2~3mm,再刺入腹 腔,以防药液外漏。进入腹腔先回抽,未见液体抽出,即可给药,拔针时旋转退针,以免药液外 溢。 注意:针头刺入部位不宜太深太高,以免刺破内脏:为避免药液外溢,拔针时旋转退针。 (3)皮下注射 两人合作法:一人左手抓住小鼠双耳及头部皮肤,右手拉住鼠尾,另一人左手提起小鼠背部皮 肤,右手持注射器,将针头刺入皮下。 一人操作法:左手小指和手掌夹住鼠尾,拇指和食指提起背部皮肤,右手持注射器给药。 (4)肌肉注射 两人合作法:一人左手抓住小鼠双耳及头部皮肤,右手拉住鼠尾,另一人左手拉直小鼠一后 肢,右手持注射器,将针头垂直刺入肌肉,注射部位多后大腿上部外侧,回抽无血,方可给药,然 后迅速拔针
实验二 常用实验动物的捉拿固定和给药方法 【实验目的】掌握常用动物小鼠、家兔的捉拿固定及给药方法 【实验材料】 1.器材:注射器(1ml、5ml)、注射针头(4.5号、6号、7号)、9号灌胃针、开口器、兔箱、鼠 笼、镊子、10号导尿管、酒精棉球 2.药品:生理盐水、苦味酸溶液 3.动物:小白鼠 、家兔 【方法步骤】 (一)小白鼠的捉拿固定和给药方法 1.小白鼠的捉拿固定方法 方法一(双手法):右手提起鼠尾放在粗糙物(如鼠笼盖)上面,向后轻拉鼠尾,用左手拇指 和食指捏住其双耳及头背部皮肤,无名指、小指将小鼠尾巴固定在掌心,便将小鼠完全固定。 方法二(单手法):先将拇指和食指抓住鼠尾,用小拇指、无名指和手掌压住尾根部,腾出的 拇指、食指及中指抓住小鼠双耳及头背部皮肤而固定。 2.给药方法 (1)灌胃法 用左手固定小鼠,将其腹部朝上,颈部拉直,右手用带灌胃针头注射器(事先吸取药 液),将针头从口角插入口腔,针头紧贴上颚进入食道。若遇阻力,应退出重新再进针。 注意:切不可用力过猛,防止损伤或误入气管导致死亡。 (2)腹腔注射 用左手将小鼠固定好后,将其腹部朝上,颈部拉直,右手持带有针头(5~6号)的注 射器,从耻骨联合上左下腹外侧向头端方向以30~45o角刺入腹腔。可先刺入皮下2~3mm,再刺入腹 腔,以防药液外漏。进入腹腔先回抽,未见液体抽出,即可给药,拔针时旋转退针,以免药液外 溢。 注意:针头刺入部位不宜太深太高,以免刺破内脏;为避免药液外溢,拔针时旋转退针。 (3)皮下注射 两人合作法:一人左手抓住小鼠双耳及头部皮肤,右手拉住鼠尾,另一人左手提起小鼠背部皮 肤,右手持注射器,将针头刺入皮下。 一人操作法:左手小指和手掌夹住鼠尾,拇指和食指提起背部皮肤,右手持注射器给药。 (4)肌肉注射 两人合作法:一人左手抓住小鼠双耳及头部皮肤,右手拉住鼠尾,另一人左手拉直小鼠一后 肢,右手持注射器,将针头垂直刺入肌肉,注射部位多后大腿上部外侧,回抽无血,方可给药,然 后迅速拔针

一人操作法:左手将小鼠固定好后,将小鼠一后肢压在无名指下,将其后腿外侧暴露,右手持 注射器,将针头垂直刺入肌肉,回抽无血,方可给药,然后迅速拔针。 注意:回抽见有血液,说明刺破血管或在血管中,给药途径发生变化,所以要拔出,重新操 作。 (5)尾静脉注射法: 将小鼠置于特制的固定笼内,暴露鼠尾部,用酒精棉球擦拭鼠尾,待血管扩张并清晰可见,用左 手固定鼠尾尖部,右手持注射器,平行进针刺入血管,缓慢给药。如推注有阻力且局部肿胀变白, 说明针头不在血管内,应拔针后重新进针。 注意:小鼠尾巴上有四根血管,背侧和腹侧为动脉,左右两根为静脉穿刺时,穿刺时宜从近尾 尖部13处静脉开始,以便重复向上移位注射。 (二)家兔的捉拿固定和给药方法 1.家兔的正确捉拿周定 一般用左手抓住家兔颈背部皮肤,轻轻提起,再有右手托住其臀部。注意错误抓法:单手抓住家 兔双耳将其拎起,原因是这种捉拿方法由于家兔挣扎和自身的重量可能使其双耳的耳缘静脉及毛细 血管被损伤,使药液不能注入静脉或注入静脉的药量不准确。提髂抓法,容易损伤家兔肾脏。 2.家兔的给药方法 (1)灌胃法 两人合作,用兔箱固定兔身,一人左手固定兔头,右手将开口器从一侧嘴角插入,压住兔舌,并 由外向内翻转开口器,使兔舌伸直,另一人取灌胃管从开口器中央的小孔插入食道约15℃m。如插入 气管,家兔则剧烈挣扎、呼吸苦难,应拔出重插。也可将导尿管外端浸入水中,不见气泡则表示插 在胃内。插好后把注射器接在导尿管上,将药液推入。再注入少量空气,使导尿管中所有的药液进 入胃内。灌胃结束后,先慢慢抽出导尿管,再取出开口器。(2)耳缘静脉注射法 将兔置于兔箱内,选好耳缘静脉,拔除局部的毛,用酒精棉球涂擦,并用食指轻弹耳壁,使血管 扩张。用左手的食指和中指夹住耳根部,拇指和无名指夹住耳尖部拉直,右手将抽好药液的注射器 针头平行刺入血管,用拇指和食指固定针头和兔耳,将药液推入。如针头在血管内,推注轻松,并 可见血液被药液冲走:如针头不在血管内,则推注有阻力,并且耳局部肿胀和变白,应立即拔出重 新注射。注射完毕,则用手指或干棉球压在针眼上,再拔出针头,并继续按压片刻,防止出血。 (3)腹腔注射操作同小鼠,唯针头可稍大(6-7号),给药量可稍多。 (4)皮下注射操作同小鼠,唯针头可稍大(6-7号),给药量可稍多。, (5)肌肉注射操作同小鼠,唯针头可稍大(67号),给药量可稍多
一人操作法:左手将小鼠固定好后,将小鼠一后肢压在无名指下,将其后腿外侧暴露,右手持 注射器,将针头垂直刺入肌肉,回抽无血,方可给药,然后迅速拔针。 注意:回抽见有血液,说明刺破血管或在血管中,给药途径发生变化,所以要拔出,重新操 作。 (5)尾静脉注射法: 将小鼠置于特制的固定笼内,暴露鼠尾部,用酒精棉球擦拭鼠尾,待血管扩张并清晰可见,用左 手固定鼠尾尖部,右手持注射器,平行进针刺入血管,缓慢给药。如推注有阻力且局部肿胀变白, 说明针头不在血管内,应拔针后重新进针。 注意:小鼠尾巴上有四根血管,背侧和腹侧为动脉,左右两根为静脉穿刺时,穿刺时宜从近尾 尖部1/3处静脉开始,以便重复向上移位注射。 (二)家兔的捉拿固定和给药方法 1.家兔的正确捉拿固定 一般用左手抓住家兔颈背部皮肤,轻轻提起,再有右手托住其臀部。注意错误抓法:单手抓住家 兔双耳将其拎起,原因是这种捉拿方法由于家兔挣扎和自身的重量可能使其双耳的耳缘静脉及毛细 血管被损伤,使药液不能注入静脉或注入静脉的药量不准确。提髂抓法,容易损伤家兔肾脏。 2.家兔的给药方法 (1)灌胃法 两人合作,用兔箱固定兔身,一人左手固定兔头,右手将开口器从一侧嘴角插入,压住兔舌,并 由外向内翻转开口器,使兔舌伸直,另一人取灌胃管从开口器中央的小孔插入食道约15cm。如插入 气管,家兔则剧烈挣扎、呼吸苦难,应拔出重插。也可将导尿管外端浸入水中,不见气泡则表示插 在胃内。插好后把注射器接在导尿管上,将药液推入。再注入少量空气,使导尿管中所有的药液进 入胃内。灌胃结束后,先慢慢抽出导尿管,再取出开口器。(2)耳缘静脉注射法 将兔置于兔箱内,选好耳缘静脉,拔除局部的毛,用酒精棉球涂擦,并用食指轻弹耳壁,使血管 扩张。用左手的食指和中指夹住耳根部,拇指和无名指夹住耳尖部拉直,右手将抽好药液的注射器 针头平行刺入血管,用拇指和食指固定针头和兔耳,将药液推入。如针头在血管内,推注轻松,并 可见血液被药液冲走;如针头不在血管内,则推注有阻力,并且耳局部肿胀和变白,应立即拔出重 新注射。注射完毕,则用手指或干棉球压在针眼上,再拔出针头,并继续按压片刻,防止出血。 (3)腹腔注射 操作同小鼠,唯针头可稍大(6~7号),给药量可稍多。 (4)皮下注射 操作同小鼠,唯针头可稍大(6~7号),给药量可稍多。, (5)肌肉注射 操作同小鼠,唯针头可稍大(6~7号),给药量可稍多
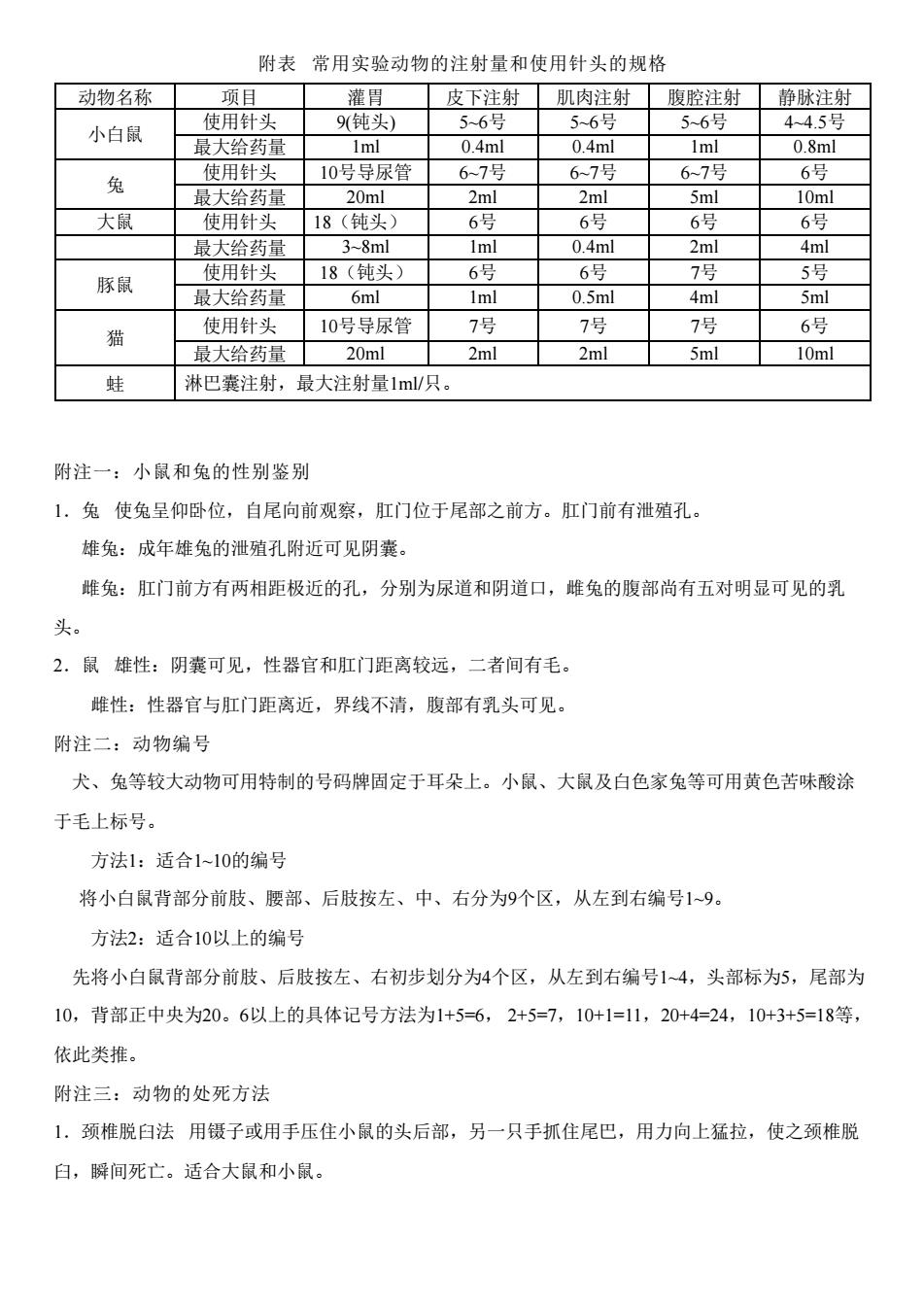
附表常用实验动物的注射量和使用针头的规格 动物名称厂 项目 灌胃■皮下注射肌肉注射腹腔注射静脉注射 使用针头 9(钝头) 5~6号 5-6号 5-6号 4-4.5号 小白鼠 最大给药量 Iml 0.4ml 0.4ml 1ml 0.8ml 使用补斗 67号 6号 兔 10号导尿管 67号 6-7号 最大给药量 20ml 2ml 2ml 5ml 10ml 大鼠 使用针头 18(钝头) 6号 6号 6号 6号 最大给药量 3-8ml 1ml 0.4ml 2ml 4ml 使用针头 18(钝头) 豚鼠 6号 6号 7号 5号 最大给药量 6ml 0.5ml 4ml 5ml 使用针头 10号导尿管 7号 7号 猫 7号 6号 最大给药量 20ml 2ml 2ml 5ml 10ml 蛙 淋巴囊注射,最大注射量1m/只。 附注一:小鼠和兔的性别鉴别 1.兔使兔呈仰卧位,自尾向前观察,肛门位于尾部之前方。肛门前有泄殖孔。 雄兔:成年雄兔的泄殖孔附近可见阴囊。 雌兔:肛门前方有两相距极近的孔,分别为尿道和阴道口,雌兔的腹部尚有五对明显可见的乳 头。 2.鼠雄性:阴囊可见,性器官和肛门距离较远,二者间有毛。 雌性:性器官与肛门距离近,界线不清,腹部有乳头可见。 附注二:动物编号 犬、兔等较大动物可用特制的号码牌固定于耳朵上。小鼠、大鼠及白色家兔等可用黄色苦味酸涂 于毛上标号。 方法1:适合1-10的编号 将小白鼠背部分前肢、腰部、后肢按左、中、右分为9个区,从左到右编号19。 方法2:适合10以上的编号 先将小白鼠背部分前肢、后肢按左、右初步划分为4个区,从左到右编号14,头部标为5,尾部为 10,背部正中央为20.6以上的具体记号方法为1+5=6,2+5=7,10+1=11,20+4=24,10+3+5=18等, 依此类推。 附注三:动物的处死方法 1.颈椎脱白法用镊子或用手压住小鼠的头后部,另一只手抓住尾巴,用力向上猛拉,使之颈椎脱 白,瞬间死亡。适合大鼠和小鼠
附表 常用实验动物的注射量和使用针头的规格 动物名称 项目 灌胃 皮下注射 肌肉注射 腹腔注射 静脉注射 小白鼠 使用针头 9(钝头) 5~6号 5~6号 5~6号 4~4.5号 最大给药量 1ml 0.4ml 0.4ml 1ml 0.8ml 兔 使用针头 10号导尿管 6~7号 6~7号 6~7号 6号 最大给药量 20ml 2ml 2ml 5ml 10ml 大鼠 使用针头 18(钝头) 6号 6号 6号 6号 最大给药量 3~8ml 1ml 0.4ml 2ml 4ml 豚鼠 使用针头 18(钝头) 6号 6号 7号 5号 最大给药量 6ml 1ml 0.5ml 4ml 5ml 猫 使用针头 10号导尿管 7号 7号 7号 6号 最大给药量 20ml 2ml 2ml 5ml 10ml 蛙 淋巴囊注射,最大注射量1ml/只。 附注一:小鼠和兔的性别鉴别 1.兔 使兔呈仰卧位,自尾向前观察,肛门位于尾部之前方。肛门前有泄殖孔。 雄兔:成年雄兔的泄殖孔附近可见阴囊。 雌兔:肛门前方有两相距极近的孔,分别为尿道和阴道口,雌兔的腹部尚有五对明显可见的乳 头。 2.鼠 雄性:阴囊可见,性器官和肛门距离较远,二者间有毛。 雌性:性器官与肛门距离近,界线不清,腹部有乳头可见。 附注二:动物编号 犬、兔等较大动物可用特制的号码牌固定于耳朵上。小鼠、大鼠及白色家兔等可用黄色苦味酸涂 于毛上标号。 方法1:适合1~10的编号 将小白鼠背部分前肢、腰部、后肢按左、中、右分为9个区,从左到右编号1~9。 方法2:适合10以上的编号 先将小白鼠背部分前肢、后肢按左、右初步划分为4个区,从左到右编号1~4,头部标为5,尾部为 10,背部正中央为20。6以上的具体记号方法为1+5=6, 2+5=7,10+1=11,20+4=24,10+3+5=18等, 依此类推。 附注三:动物的处死方法 1.颈椎脱臼法 用镊子或用手压住小鼠的头后部,另一只手抓住尾巴,用力向上猛拉,使之颈椎脱 臼,瞬间死亡。适合大鼠和小鼠

2.空气栓塞法用注射器将空气急速注射入静脉(耳静脉、尾静脉),可迅速使动物死亡。小鼠注 入0.3-0.5ml,兔为10-20ml
2.空气栓塞法 用注射器将空气急速注射入静脉(耳静脉、尾静脉),可迅速使动物死亡。小鼠注 入0.3~0.5ml,兔为10~20 ml