
通用化学实验技术 物质的合成技术 实验55.肉桂酸的合成 55.1实验目的 (1)了解肉桂酸的制备原理和方法 (2)熟悉和掌握水蒸气蒸馏、重结晶和回流等基本操作 技术。 55.2实验原理 CH.C K2C03 CH-CHCOOH CH3COOH 140~180℃ 该反应是一个可逆反应。本实验采用了使乙酸酐过量,反应产 物与无水碳酸钾反应放出二氧化碳,使平衡向生成肉桂酸的方向移 动。 2024年11月18日星期一 返回本章首页
通用化学实验技术 2024年11月18日星期一 物质的合成技术 实验55. 肉桂酸的合成 55.1实验目的 (1)了解肉桂酸的制备原理和方法 (2)熟悉和掌握水蒸气蒸馏、重结晶和回流等基本操作 技术。 55.2实验原理 CHO O CH3C O CH3C O + K2CO3 CH=CHCOOH + CH3COOH 140~180℃ 该反应是一个可逆反应。本实验采用了使乙酸酐过量,反应产 物与无水碳酸钾反应放出二氧化碳,使平衡向生成肉桂酸的方向移 动

通用化学实验技术 55.3操作流程(或要点 肉桂酸 肉桂酸钠 苯甲醛 165~175℃ 苯甲醛 乙酸酐 (1)热水, 稍冷 苯甲醛 乙酸酐 乙酸钠 无水碳酸钾 碳酸钾 (2)加Na2CO3 碳酸钾 乙酸 碳酸钠 肉桂酸钠 肉桂酸 水蒸气蒸馏 乙酸钠 (1)脱色 滤液 加HCI 乙酸 除去苯甲醛 碳酸钾 冷却,结晶 (2)过滤 酸化 氯化钾 抽滤 碳酸钠 氯化钠 重结晶提纯 肉桂酸粗产品 肉桂酸产品,称重,计算产率。 一页
通用化学实验技术 55.3 操作流程(或要点) 苯甲醛 乙酸酐 无水碳酸钾 165~175℃ 肉桂酸 苯甲醛 乙酸酐 碳酸钾 乙酸 ⑴热水,稍冷 ⑵加Na2CO3 肉桂酸钠 苯甲醛 乙酸钠 碳酸钾 碳酸钠 水蒸气蒸馏 除去苯甲醛 肉桂酸钠 乙酸钠 碳酸钾 碳酸钠 加HCl 酸化 ⑴脱色 ⑵过滤 滤液 肉桂酸 乙酸 氯化钾 氯化钠 冷却,结晶 抽滤 肉桂酸粗产品 重结晶提纯 肉桂酸产品,称重,计算产率

通用化学实验枝术 附:产率计算: 实际产量 产率= ×100% 理论产量 例如:用20g环己酮和催化剂硫酸一起加热,可得到12g环己烯 试计算它的百分产率? OH +H20 相对分子质量 100 82 20g 理论产量 理论产量=20×82÷100=16.4g 实际产量 产率 ×100%=12÷16.4=73% 理论产量 上一页 返回本章首页
通用化学实验技术 附:产率计算: 产率= 实际产量 理论产量 ×100% 例如:用20g环己酮和催化剂硫酸一起加热,可得到12g环己烯, 试计算它的百分产率? + H2O OH H2 SO4 相对分子质量 100 82 20g 理论产量 理论产量=20×82÷100=16.4g 产率= 实际产量 理论产量 ×100% =12÷16.4=73%

通用化学实验技术 在合成中产率通常不可能达到理论值,主要原因如下: (1)在一定条件下,化学反应建立了平衡,反应物不可能完全转化 为产物。 (2)对有机反应,在发生主反应的同时,常伴有副反应的发生, 使一部分原料消耗在副产物中。 (3)分离纯化过程中引起的损失。 55,4注意事项 (1)在此反应温度下,加热时间过长,会发生部分脱羧产生 不饱和烃副产物,并进而生成树脂状物,反应温度高于200℃, 这种现象更为明显。所以在实验过程中要特别注意温度的控制。 (2)肉桂酸有顺反异构体,但Perkin反应制得的是反式异构体, 熔点135.6℃
通用化学实验技术 在合成中产率通常不可能达到理论值,主要原因如下: ⑴在一定条件下,化学反应建立了平衡,反应物不可能完全转化 为产物。 ⑵对有机反应,在发生主反应的同时,常伴有副反应的发生, 使一部分原料消耗在副产物中。 ⑶分离纯化过程中引起的损失。 55.4 注意事项 (1) 在此反应温度下,加热时间过长,会发生部分脱羧产生 不饱和烃副产物,并进而生成树脂状物,反应温度高于200℃, 这种现象更为明显。所以在实验过程中要特别注意温度的控制。 (2) 肉桂酸有顺反异构体,但Perkin反应制得的是反式异构体, 熔点135.6℃

通用化学实验技术 55.5思考题 (1)用无水醋酸钾作缩合剂,回流结束后加入固体碳酸钠使 溶液呈中性,此时溶液中有那几种化合物,各以什么形式存在? (2)在Perkin,反应中,用羧酸盐代替酸酐,会得到两种不同 的芳基丙烯酸,为什么? 上一页 返回本章首页
通用化学实验技术 55.5思考题 (1) 用无水醋酸钾作缩合剂,回流结束后加入固体碳酸钠使 溶液呈中性,此时溶液中有那几种化合物,各以什么形式存在? (2) 在Perkin反应中,用羧酸盐代替酸酐,会得到两种不同 的芳基丙烯酸,为什么?

通用化学实验技术 实验561-溴丁烷的合成 56.1实验目的 (1)了解由醇和氢卤酸制备卤代烃的原理和方法。 (2)学习气体吸收装置的基本操作。 (3)巩固回流、萃取、液体干燥和普通蒸馏等基本操作技术 56.2实验原理 主反应: NaBr H2SO4>HBr NaHSO4 HBr CH3CH2CH2CH2OH CH3CH2CH2CH2Br H2O b.p. 118.0℃ 101.6℃ 上一页 返回本章首页
通用化学实验技术 实验56 1-溴丁烷的合成 56.1实验目的 (1)了解由醇和氢卤酸制备卤代烃的原理和方法。 (2)学习气体吸收装置的基本操作。 ⑶巩固回流、萃取、液体干燥和普通蒸馏等基本操作技术 56.2实验原理 NaBr + H2 SO4 HBr + NaHSO4 HBr + CH3CH2CH2CH2OH CH3CH2CH2CH2Br + H2O b.p. 118.0℃ 101.6℃ 主反应:

通用化学实验技术 该反应是一个可逆反应。本实验采用了使乙醇过量、及时 蒸出产物的方法提高产率。 主要的副反应有: CH3CH2CH2CH2OH 0 CH3CH2CH-CH2+H20 2CH3CH2CH2CH2OH SO4-CH3CH2CH2CH2OCH2CH2CH2CH+H2O △ HBr+H2S04△→Br2+SO2+2H20 556.3操作流程 上一页 返回本章首页
通用化学实验技术 该反应是一个可逆反应。本实验采用了使乙醇过量、及时 蒸出产物的方法提高产率。 556.3 操作流程 主要的副反应有: HBr+ H2 SO4 CH3CH2CH2CH2OH H2 SO4 CH3CH2CH=CH2 + H2O 2CH3CH2CH2CH2OH H2 SO4 CH3CH2CH2CH2OCH2CH2CH2CH3 + H2O Br2 + SO2 + 2H2O
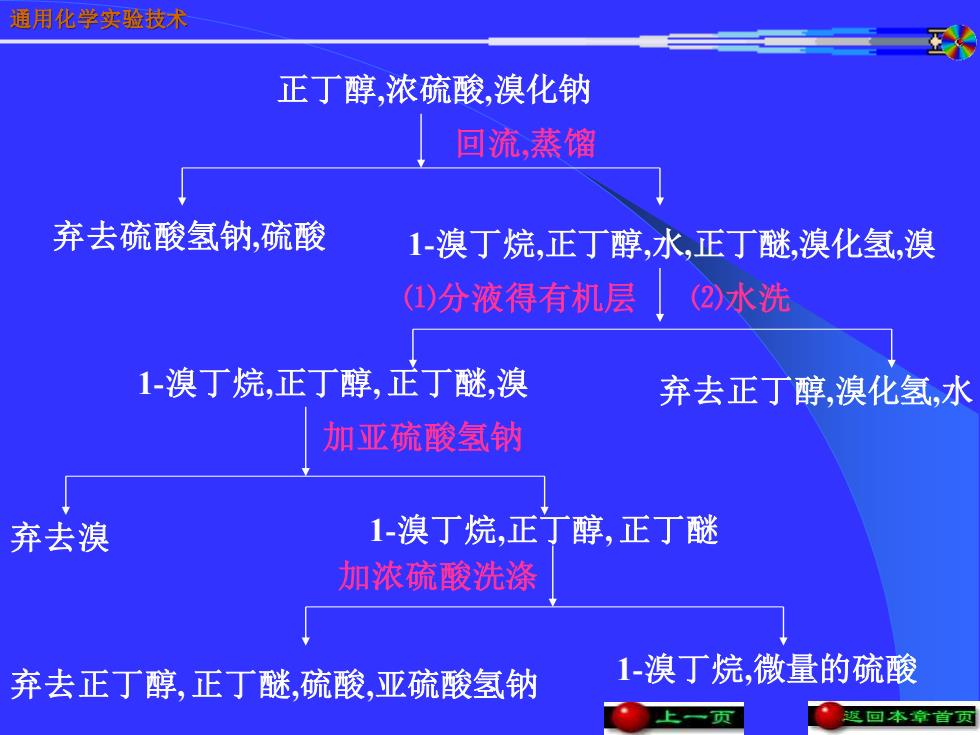
通用化学实验技术 正丁醇,浓硫酸,溴化钠 回流,蒸馏 弃去硫酸氢钠,硫酸 1-溴丁烷,正丁醇,水,正丁醚,溴化氢,溴 (1)分液得有机层 (2水洗 1-溴丁烷,正丁醇,正丁醚,溴 弃去正丁醇,溴化氢,水 加亚硫酸氢钠 弃去溴 1-溴丁烷,正丁醇,正丁醚 加浓硫酸洗涤 弃去正丁醇,正丁醚,硫酸,亚硫酸氢钠 1-溴丁烷,微量的硫酸 【上一页 ●回本章首页
通用化学实验技术 正丁醇,浓硫酸,溴化钠 回流,蒸馏 1-溴丁烷,正丁醇, 正丁醚,溴 加亚硫酸氢钠 1-溴丁烷,正丁醇,水,正丁醚,溴化氢,溴 加浓硫酸洗涤 1-溴丁烷,微量的硫酸 ⑴分液得有机层 ⑵水洗 弃去硫酸氢钠,硫酸 弃去正丁醇,溴化氢,水 弃去溴 1-溴丁烷,正丁醇, 正丁醚 弃去正丁醇, 正丁醚,硫酸,亚硫酸氢钠

通用化学实验枝术 1-溴丁烷,微量的硫酸 先用水洗 后用碳酸氢钠洗,再用水洗 硫酸氢钠,水 1-溴丁烷,微量的水 干燥,蒸馏 1-溴丁烷,称重,计算产率 上一页 返回本章首页
通用化学实验技术 1-溴丁烷,微量的水 干燥,蒸馏 先用水洗 后用碳酸氢钠洗,再用水洗 1-溴丁烷,微量的硫酸 硫酸氢钠, 水 1-溴丁烷,称重,计算产率

通用化学实验技术 56.4注意事项 ()浓硫酸遇水剧烈防热,有时会导致溶液沸腾而溅出,因此 混合浓硫酸时一定要在振摇并冷却下加入水中,不可倒过来加。 (②)要严格控制反应温度以减少副产物的生成; (3)1-溴丁烷是否蒸完,可从三个方面判断:蒸出液是否由浑浊 变澄清;反应瓶中油层是否消失;取一试管收集几滴刚蒸出的 流出液,加水后摇动,观察有无油珠出现。如无,表明流出液中 已无有机物质。 (4)在蒸馏前,必须将正丁醇除净。因正丁醇和溴丁烷可形共 沸物,蒸馏时难以除去。 上一页 【退回本章首页
通用化学实验技术 56.4 注意事项 ⑴浓硫酸遇水剧烈防热,有时会导致溶液沸腾而溅出,因此 混合浓硫酸时一定要在振摇并冷却下加入水中,不可倒过来加。 (2) 要严格控制反应温度以减少副产物的生成; (3) 1-溴丁烷是否蒸完,可从三个方面判断:蒸出液是否由浑浊 变澄清;反应瓶中油层是否消失;取一试管收集几滴刚蒸出的 流出液,加水后摇动,观察有无油珠出现。如无,表明流出液中 已无有机物质。 (4) 在蒸馏前,必须将正丁醇除净。因正丁醇和溴丁烷可形共 沸物,蒸馏时难以除去