
实验39食醋总酸量的测定一—酸碱滴定法 39.1实验目的 ()掌握液体样品的取样和分析结果的一般表示方法。 (2)熟练掌握碱式滴定管、移液管和容量瓶的使用
实验39 食醋总酸量的测定——酸碱滴定法 39.1 实验目的 ⑴ 掌握液体样品的取样和分析结果的一般表示方法。 ⑵ 熟练掌握碱式滴定管、移液管和容量瓶的使用

39.2实验原理 食醋中的酸组分主要是乙酸(Ka=1.8X10-5),还含 有少量其它有机酸,这些酸都可以用强碱直接滴定,总 酸量由滴定时消耗的总碱量换算为乙酸的含量表示。 反应式:CHC00H+Na0H=CH3C00Na+H20 化学计量点:pH≈8.7 指示剂:酚酞 计量关系:n(CH3C00H)=n(NaOH)
39.2 实验原理 食醋中的酸组分主要是乙酸(Ka =1.8X10-5),还含 有少量其它有机酸,这些酸都可以用强碱直接滴定,总 酸量由滴定时消耗的总碱量换算为乙酸的含量表示。 反应式:CH3COOH + NaOH = CH3COONa + H2O 化学计量点: pH ≈ 8.7 指示剂: 酚酞 计量关系: n(CH3COOH) = n(NaOH)
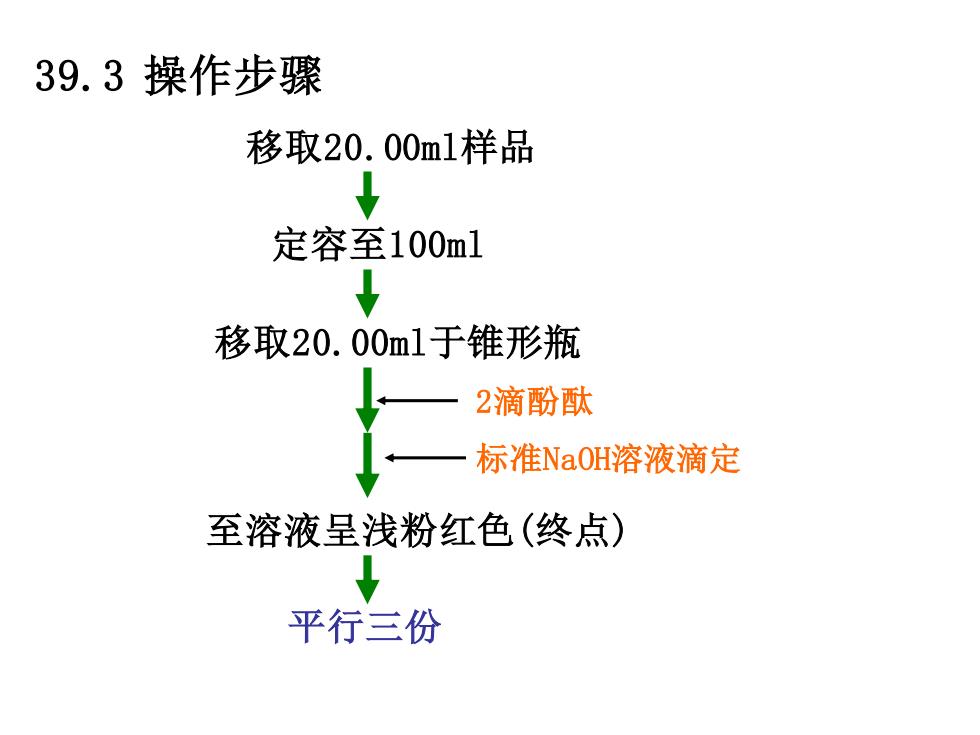
39.3操作步骤 移取20.00m1样品 定容至100ml ↓ 移取20.00m1于维形瓶 2滴酚酞 标准NaOH溶液滴定 至溶液呈浅粉红色(终点) 平行三份
39.3 操作步骤 移取20.00ml样品 定容至100ml 移取20.00ml于锥形瓶 2滴酚酞 标准NaOH溶液滴定 至溶液呈浅粉红色(终点) 平行三份

计算公式: 食醋总酸量(gL-)=c(a0·Na0四·MAc)。100.0 20.00·10-3 20.00 39.4注意事项 (1)要用专用的移液管移取样品。 (2)液体样品的组分含量常用g·L1为单位表示
计算公式: c(NaOH)•V(NaOH)•M(HAc) 100.0 食醋总酸量(g•L-1) = —————————— • ——— 20.00 • 10-3 20.00 39.4 注意事项 (1) 要用专用的移液管移取样品。 (2)液体样品的组分含量常用 g•L-1为单位表示

39.5思考题 (1)液体样品的组分含量通常用什么方式表示? (2)食醋的主要成分是什么?为什么用NaOH滴定所得 的分析结果称为食醋的总酸量? (3)若待测的样品为红醋,你该怎么办? (4)今有HAc含量约为3%的样品要用0.1000mo1L1 NaOH滴定,请拟定样品取用量、定容体积和每次滴定时 稀释液取用量的实验方案。 39.6在线答疑 e-mail:ade12s@126.com
39.5 思考题 ⑴ 液体样品的组分含量通常用什么方式表示? ⑵ 食醋的主要成分是什么?为什么用NaOH滴定所得 的分析结果称为食醋的总酸量? ⑶ 若待测的样品为红醋,你该怎么办? ⑷ 今有HAc含量约为3%的样品要用0.1000mol•L-1 NaOH滴定,请拟定样品取用量、定容体积和每次滴定时 稀释液取用量的实验方案。 39.6 在线答疑 e-mail: ade12s@126.com