
仪器分析(含实验) 《仪器分析实验》 实验26自动电位滴定 Auto-Potential Titration Analysis For Short:APTA
《仪器分析实验》 实验26 自动电位滴定 Auto-Potential Titration Analysis For Short:APTA 仪器分析(含实验)
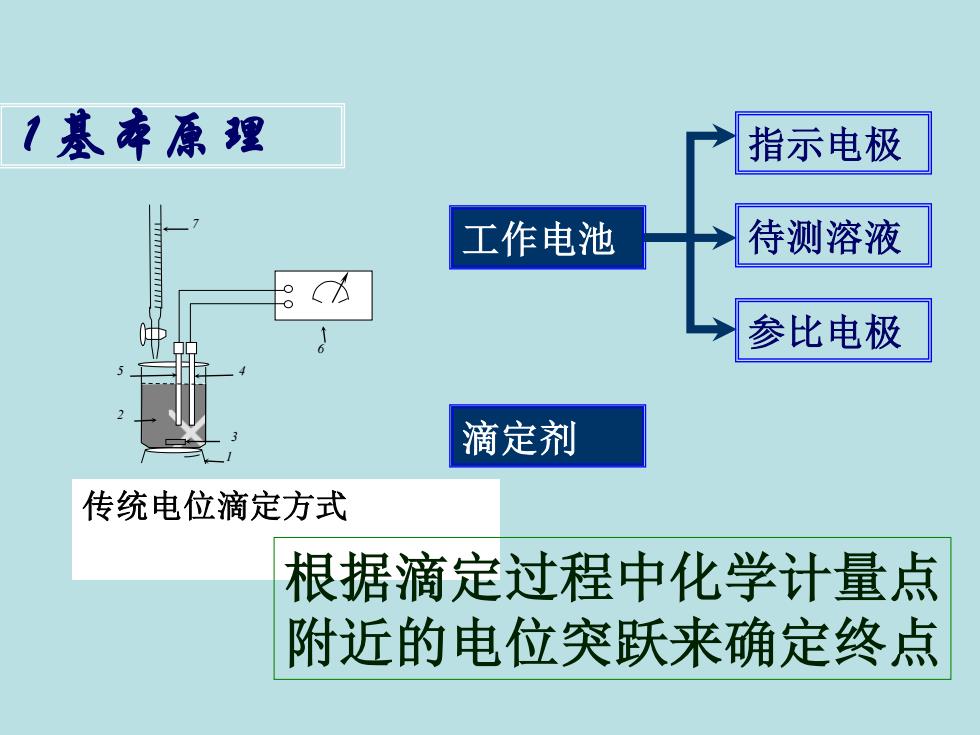
1基本原理 指示电极 工作电池 待测溶液 参比电极 滴定剂 传统电位滴定方式 根据滴定过程中化学计量点 附近的电位突跃来确定终点
1 基本原理 6 7 4 3 5 2 传统电位滴定方式 1 工作电池 指示电极 参比电极 待测溶液 滴定剂 根据滴定过程中化学计量点 附近的电位突跃来确定终点

特点:与直接电位法相比 测量电位变化,算出化学计量点体积 准确度和精密度高 E并没有直接用来计算待测物的c
特点:与直接电位法相比 测量电位变化,算出化学计量点体积 准确度和精密度高 E并没有直接用来计算待测物的c

特点:与指示剂滴定法相比 ()可用于滴定突跃小或不明显的滴定反应; (2)可用于有色或浑浊试样的滴定; (3)装置简单、操作方便,可自动化; (④)常采用等步长滴定 △V相同 电位突跃代替了指示剂的变色 准确度提高/适用范围更广/自动化
特点:与指示剂滴定法相比 (1) 可用于滴定突跃小或不明显的滴定反应; (2) 可用于有色或浑浊试样的滴定; (3) 装置简单、操作方便,可自动化; (4) 常采用等步长滴定 电位突跃代替了指示剂的变色 准确度提高/适用范围更广/自动化 ΔV相同

2.玻璃电极 ·玻璃电位的产生不是由于电子的得失或转移,而是由于 H+在溶液和硅胶层界面间进行迁移,改变界面上电荷的 分布产生了相界电位,膜内外的相界电位差就是膜电位。 ·玻璃膜电极具有内参比电极,如Ag-AgCl电极,因此整个 玻璃膜电极的电位,应是内参比电极电位与膜电位之和, 即 E玻=EAgCI/Ag+E
2. 玻璃电极 • 玻璃电位的产生不是由于电子的得失或转移,而是由于 H+在溶液和硅胶层界面间进行迁移,改变界面上电荷的 分布产生了相界电位,膜内外的相界电位差就是膜电位。 • 玻璃膜电极具有内参比电极,如Ag-AgCl电极,因此整个 玻璃膜电极的电位,应是内参比电极电位与膜电位之和, 即

玻璃电极 绝缘套 玻璃电极是最早也是最广泛应用的离了 选择性电极,主要构成部分(见右图)是一个 玻璃泡,泡的下半部是由SO基质中加入 Na0和少量CO经烧结而成的玻璃薄膜,膜厚 Ag-AgCl 约30~100μm,泡内装有p川一定的缓冲溶 电极 液(内参比溶液),其中插入一支很-氯化银 电极作内参比电极。 内部缓冲溶液 玻璃膜
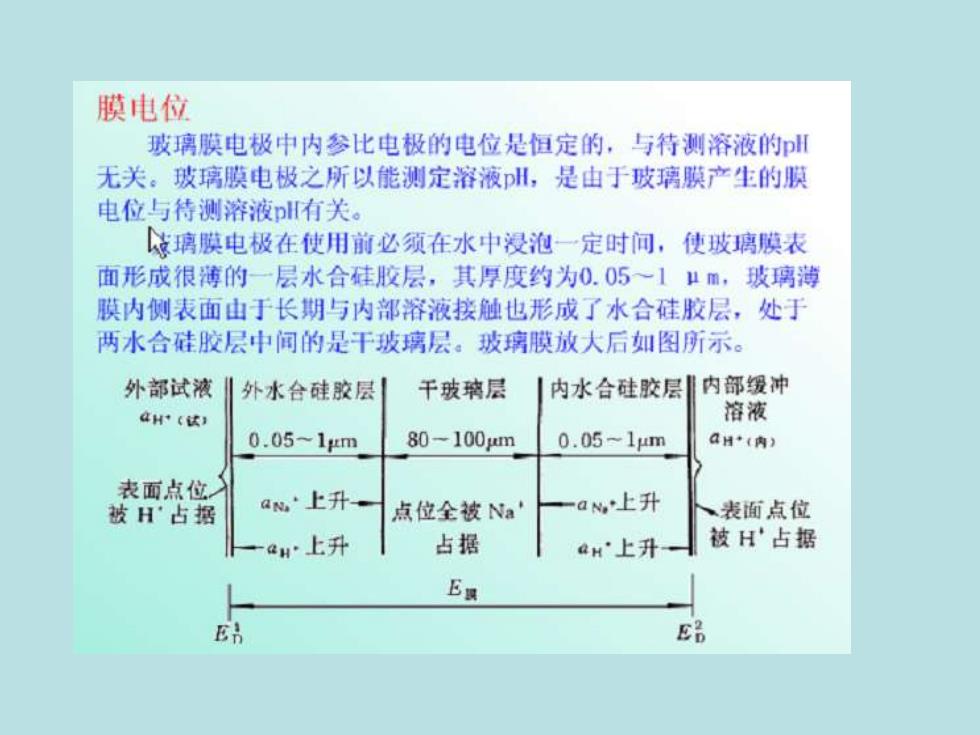
膜电位 玻璃膜电极中内参比电极的电位是恒定的,与待测溶液的 无关。玻璃膜电极之所以能测定溶液川,是由于玻璃膜产生的膜 电位与待测溶液plH有关。 城璃膜电极在使用前必须在水中浸泡一定时问,使玻璃膜表 面形成很薄的一层水合硅胶层,其厚度约为0.05~1μm,玻璃满 膜内侧表面由于长期与内部溶液接触也形成了水合硅胶层,处于 两水合硅胶层中间的是干玻璃层。玻璃膜放大后如图所示。 外部试液‖外水台硅胶层 干玻璃层 内水合硅胶层引内部缓冲 dHr(这 溶液 0.05-1m 80-100um 0.05-1μm aH(内) 表面点位 被H'占据 a·上升一 点位全被Na' 一aM上升 、表面点位 一aH上升 占据 aH'上升 被H占据 Ea En E品

当玻璃膜电极浸入待测溶液中时,玻璃膜处于川+活度一定的 内参比溶液和试液之间,膜外水合硅胶层与试液间产生相界电位 E:膜内水合硅胶层与内部缓冲液间产生相界电位。这种跨越 玻璃膜两个溶液之间产生的电位差称为膜电位懒。膜电位的大小 仅与试液中有关,可用能斯特公式表示 E膜=K+0.0591ga+(试) 亦即 E膜=K-0.059pl试 式中K为常数,它是由玻璃膜电极本身决定的。上式说明,在一定 温度下,玻璃膜电极的膜电位与试液的H成线性关系

·用玻璃膜电极测定H的优点是不受溶液中氧化剂或还 原剂的影响,玻璃膜电极不易因杂质的作用而中毒 能在胶体溶液和有色溶液中使用。其缺点是本身具有 很高的内阻,可达数百兆欧,必须辅以电子放大装置 才能测定,其电阻又随温度变化,一般只能在5~60℃ 使用。酸度过高(pH9)将分别产生 测定误差一“酸差”和“钠差”。 玻璃膜电极不仅可用于溶液H的测定,在适当改变玻 璃膜的组成后,可制作成pNa、pK、pAg等玻璃电极, 可用于Na+、K+、Ag+等离子的活度测定
• 用玻璃膜电极测定pH的优点是不受溶液中氧化剂或还 原剂的影响,玻璃膜电极不易因杂质的作用而中毒, 能在胶体溶液和有色溶液中使用。其缺点是本身具有 很高的内阻,可达数百兆欧,必须辅以电子放大装置 才能测定,其电阻又随温度变化,一般只能在5~60 ℃ 使用。酸度过高(pH9)将分别产生 测定误差—“酸差”和“钠差” 。 • 玻璃膜电极不仅可用于溶液pH的测定,在适当改变玻 璃膜的组成后,可制作成pNa、pK、pAg等玻璃电极, 可用于Na+ 、K+ 、Ag+等离子的活度测定
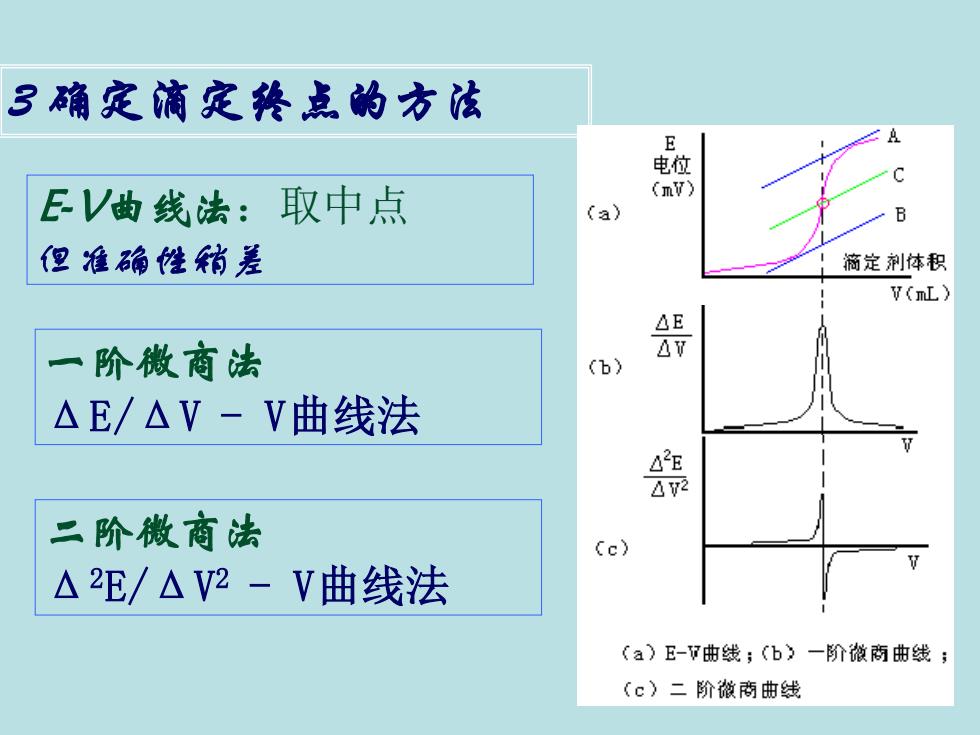
3确定滴定终点的方法 电 EV曲线法:取中点 (mV) (a) B 但准确性稍差 商定剂体积 t(L) 阶微商法 AV (b) △E/△V-V曲线法 42厘 2 二阶微商法 (c) △2E/△V2-V曲线法 (a)E-7曲线;(b一阶撤两曲线; (c)二阶撤商曲线
3 确定滴定终点的方法 E-V曲线法:取中点 但准确性稍差 一阶微商法 ΔE/ΔV - V曲线法 二阶微商法 Δ2E/ΔV2 - V曲线法