
径门太 厦门大学精品课程 仪器分析(含实验) 《仪器分析》课程 第九章 原子发射光谱法 Chapter Nine Atomic Emission Spectroscopy For Short:AES
《仪器分析》课程 厦门大学精品课程 仪器分析(含实验) 第九章 原子发射光谱法 Atomic Emission Spectroscopy For Short:AES Chapter Nine
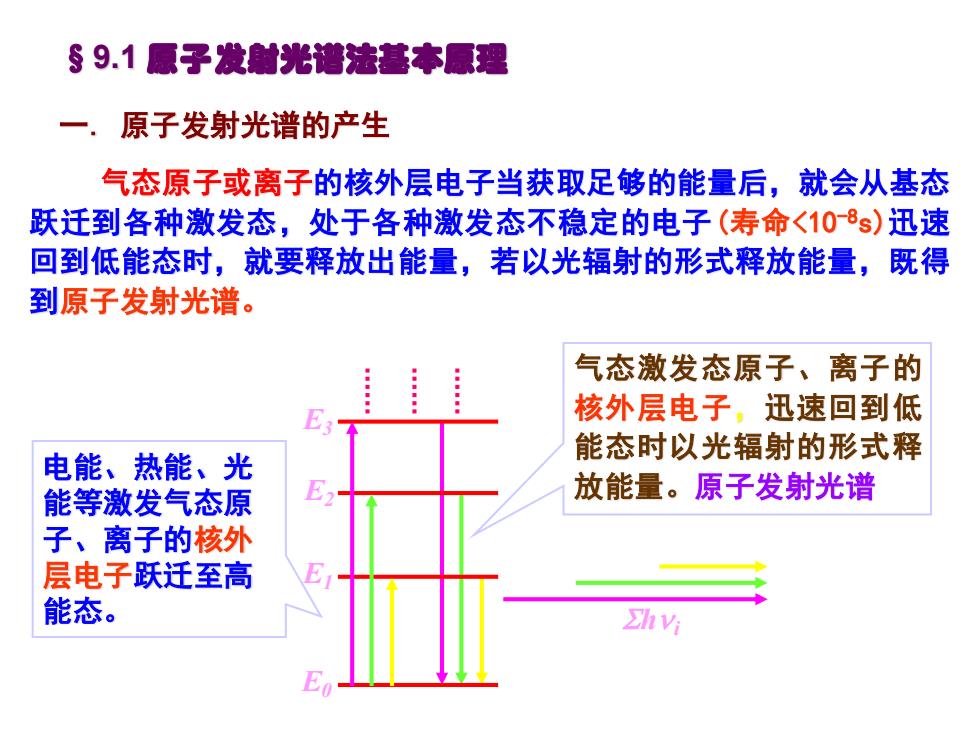
§9.1原子发射光谱法基本原理 一.原子发射光谱的产生 气态原子或离子的核外层电子当获取足够的能量后,就会从基态 跃迁到各种激发态,处于各种激发态不稳定的电子(寿命<108s)迅速 回到低能态时,就要释放出能量,若以光辐射的形式释放能量,既得 到原子发射光谱。 气态激发态原子、离子的 E31 核外层电子,迅速回到低 电能、热能、光 能态时以光辐射的形式释 能等激发气态原 放能量。原子发射光谱 子、离子的核外 层电子跃迁至高 能态。 Chvi
气态原子或离子的核外层电子当获取足够的能量后,就会从基态 跃迁到各种激发态,处于各种激发态不稳定的电子(寿命<10-8s)迅速 回到低能态时,就要释放出能量,若以光辐射的形式释放能量,既得 到原子发射光谱。 §9.1 原子发射光谱法基本原理 一. 原子发射光谱的产生 电能、热能、光 能等激发气态原 子、离子的核外 层电子跃迁至高 能态。 E2 E0 E1 E3 h i 气态激发态原子、离子的 核外层电子,迅速回到低 能态时以光辐射的形式释 放能量。原子发射光谱

二.原子核外电子的壳层结构 1.单价电子原子 主量子数(n):描述核外电子是在那个电子壳层上运动。 n=1、2、3、4、5、6、7、●●0●●0●0 符号:K、L、M、N、O、P、2,●●oo●ee● 角量子数():描述核外电子云的形状。 1=0、1、2、3、4、●e●●●●●0 符号:S,p,d,f,g,0 eReeee 磁量子数(m):描述核外电子云沿磁场方向的分量。 m1=0,tl,士2,士3,●OCOCOO,士l 自旋量子数(m,):描述核外电子云自旋方向。 m,=±1/2 Na: (1s)2(2s)2(2p)(3s)1 (3s)1n=3 1=0 m1=0m,=+1/2
主量子数( n ):描述核外电子是在那个电子壳层上运动。 n = 1、 2、 3、 4、 5、 6、7、•••••••• 符号: K、L、M、N、O、P、Q、•••••••• 二. 原子核外电子的壳层结构 1.单价电子原子 角量子数(l ):描述核外电子云的形状。 l = 0、1、 2、 3、 4、•••••••• 符号: s、p、d、 f、 g、•••••••• 磁量子数(ml ):描述核外电子云沿磁场方向的分量。 m l = 0、1、 2、 3、••••••••、 l 自旋量子数(ms ):描述核外电子云自旋方向。 m s = 1/2 Na: (1s)2 (2s)2 (2p)6 (3s)1 (3s)1 n = 3 l = 0 m l = 0 m s =+1/2

2.多价电子的原子 主量子数(n): n=1、2、3、4、5、6、7、oe●e●e●e 总角量子数(L): L=∑l, 对于2个价电子:L=(l1+2)、(l1+l21)、●●●,(lr2) 总自旋量子数(S: S=0、±1、±2、土3、·●●,±m,(m,为整数) S=±1/2、±3/2、±5/2、●e,±m,(m,为分数) 光谱的多重性(0: M=2S+1 内量子数(:光谱支项 J=L+S、●e●,L-S (L≥2S) J=S+L、e,S-L (S>L)
主量子数(n): n =1、 2、 3、 4、 5、 6、7、•••••••• 2.多价电子的原子 总自旋量子数(S): S = 0、1、2 、3、 •••、 m s (m s为整数) S = 1/2、3/2 、5/2、•••、 m s (m s为分数) 总角量子数(L): L = l , 对于2个价电子:L = ( l1+ l2 )、 ( l1+ l2 -1)、•••、 ( l1 - l2 ) 光谱的多重性(M): M=2S+1 内量子数(J):光谱支项 J = L+S、•••、 L-S (LS ) J = S+L、•••、 S-L (S >L)
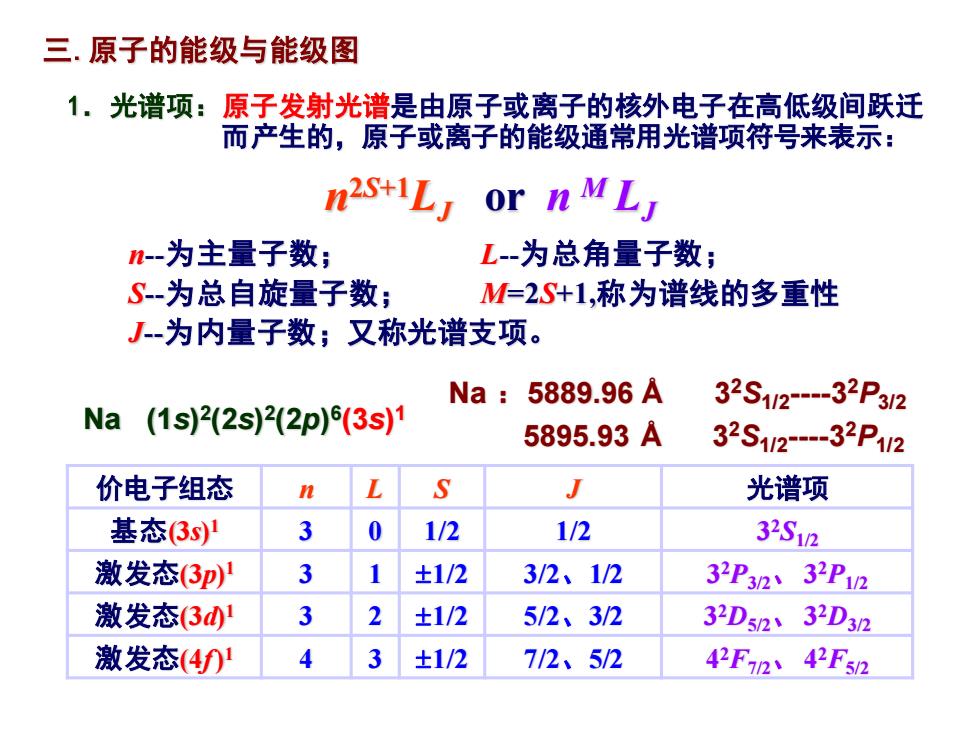
三.原子的能级与能级图 1.光谱项:原子发射光谱是由原子或离子的核外电子在高低级间跃迁 而产生的,原子或离子的能级通常用光谱项符号来表示: n2s+iL or n ML n-为主量子数; L-为总角量子数; S-为总自旋量子数; M=2S+1,称为谱线的多重性 J-为内量子数;又称光谱支项。 Na:5889.96A 32S112-32P312 Na (1s22s)22p)(3s)1 5895.93A 32S12-32P1/2 价电子组态 S J 光谱项 基态3s 3 0 1/2 1/2 32S12 激发态(3p)1 3 ±1/2 3/2、1/2 32P32、32P12 激发态31 3 2 ±1/2 5/2、3/2 32Ds232D32 激发态(4)1 ±1/2 7/2、5/2 42F72、42F52
1.光谱项:原子发射光谱是由原子或离子的核外电子在高低级间跃迁 而产生的,原子或离子的能级通常用光谱项符号来表示: 三.原子的能级与能级图 n 2S+1LJ or n M LJ n-为主量子数; L-为总角量子数; S-为总自旋量子数; M=2S+1,称为谱线的多重性 J-为内量子数;又称光谱支项。 价电子组态 n L S J 光谱项 基态(3s) 1 3 0 1/2 1/2 3 2S1/2 激发态(3p) 1 3 1 1/2 3/2、1/2 3 2P3/2、 3 2P1/2 激发态(3d) 1 3 2 1/2 5/2、3/2 3 2D5/2、 3 2D3/2 激发态(4f) 1 4 3 1/2 7/2、5/2 4 2F7/2、 4 2F5/2 Na (1s) 2 (2s) 2 (2p) 6 (3s) 1 Na :5889.96 Å 3 2S1/2 -3 2P3/2 5895.93 Å 3 2S1/2 -3 2P1/2
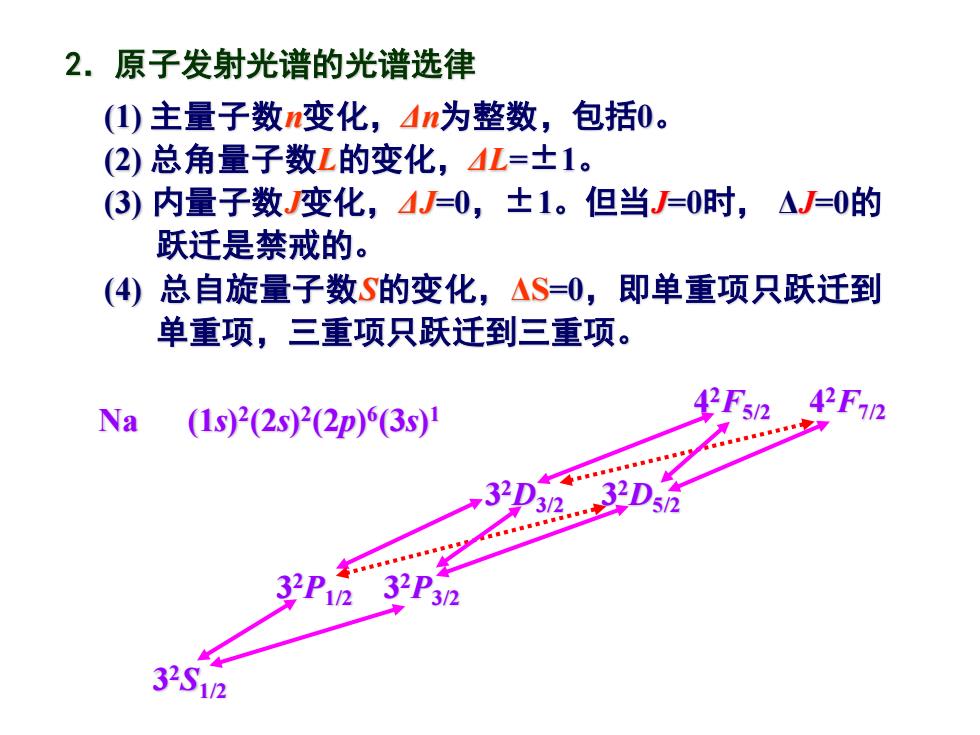
2.原子发射光谱的光谱选律 (1)主量子数n变化,n为整数,包括0。 (2)总角量子数L的变化,L=±1。 (3)内量子数变化,4J=0,±1。但当J=0时,△J=0的 跃迁是禁戒的。 (4)总自旋量子数S的变化,△S=0,即单重项只跃迁到 单重项,三重项只跃迁到三重项。 Na(1s)2(2s)2(2p)(3s1 42F5/2 42F12 3 32D 32D 32P12 32P 3/2 32S12
(1) 主量子数n变化,Δn为整数,包括0。 (2) 总角量子数L的变化,ΔL=±1。 (3) 内量子数J变化,ΔJ=0,±1。但当J=0时, ΔJ=0的 跃迁是禁戒的。 (4) 总自旋量子数S的变化,ΔS=0,即单重项只跃迁到 单重项,三重项只跃迁到三重项。 2.原子发射光谱的光谱选律 Na (1s) 2 (2s) 2 (2p) 6 (3s) 1 3 2S1/2 3 2P1/2 3 2P3/2 3 2D3/2 3 2D5/2 4 2F5/2 4 2F7/2
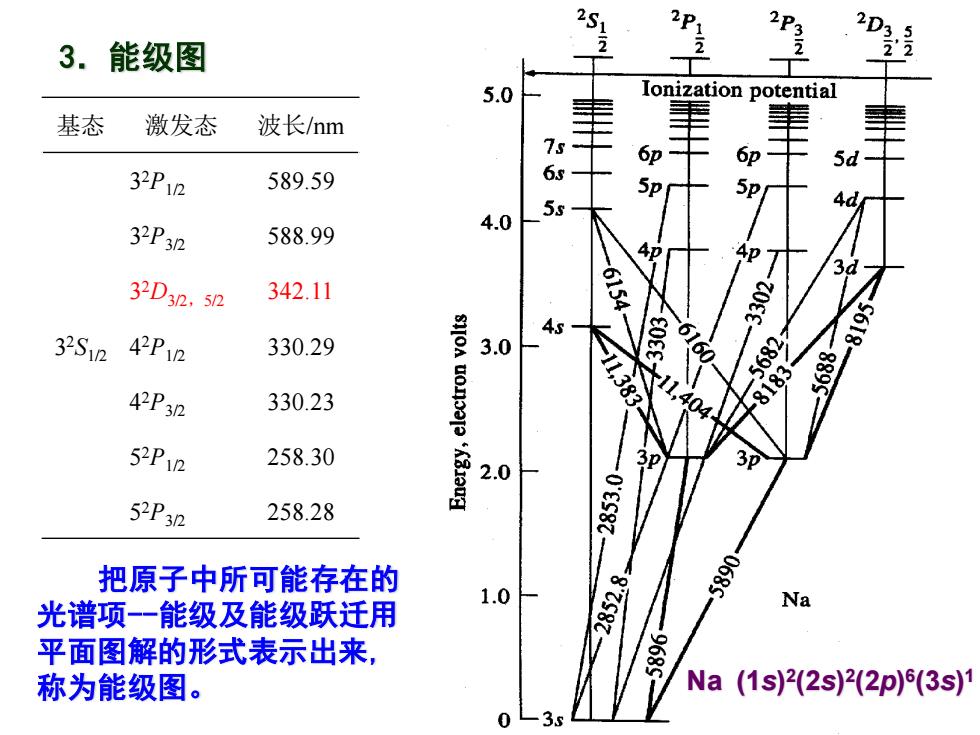
2S1 2P 3.能级图 2 2D3.5 5.0 Ionization potential 基态 激发态 波长/nm 75 OD- 6p 32P1n 589.59 6 Sp 5p 5s 32P32 588.99 4.0 4D7 32D32,52 342.11 61 4s- 32S12 42P12 330.29 3.0 2 42P3n 330.23 8183 52P12 258.30 3p 2.0 3p 52P3n 258.28 1-8882 把原子中所可能存在的 1.0 光谱项-一能级及能级跃迁用 Na 平面图解的形式表示出来, 称为能级图。 Na(1s)2(2s)2(2p)(3s)1
3.能级图 把原子中所可能存在的 光谱项-能级及能级跃迁用 平面图解的形式表示出来, 称为能级图。 Na (1s) 2 (2s) 2 (2p) 6 (3s) 1 基态 激发态 波长/nm 3 2S1/2 3 2P1/2 589.59 3 2P3/2 588.99 3 2D3/2,5/2 342.11 4 2P1/2 330.29 4 2P3/2 330.23 5 2P1/2 258.30 5 2P3/2 258.28
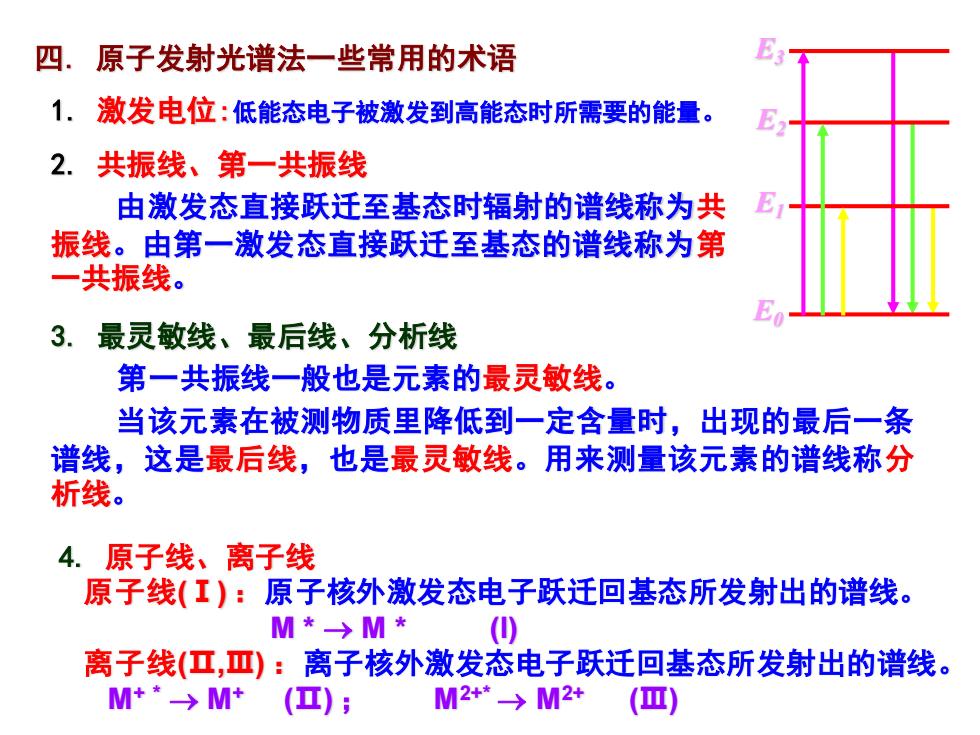
四.原子发射光谱法一些常用的术语 1.激发电位:低能态电子被激发到高能态时所需要的能量。 2.共振线、第一共振线 由激发态直接跃迁至基态时辐射的谱线称为共 振线。由第一激发态直接跃迁至基态的谱线称为第 一共振线。 E 3.最灵敏线、最后线、分析线 第一共振线一般也是元素的最灵敏线。 当该元素在被测物质里降低到一定含量时,出现的最后一条 谱线,这是最后线,也是最灵敏线。用来测量该元素的谱线称分 析线。 4.原子线、离子线 原子线(I):原子核外激发态电子跃迁回基态所发射出的谱线。 M*→M* () 离子线(工,Ⅲ):离子核外激发态电子跃迁回基态所发射出的谱线。 M+*→M*(); M2+-→M2+ (Ⅲ)
2. 共振线、第一共振线 由激发态直接跃迁至基态时辐射的谱线称为共 振线。由第一激发态直接跃迁至基态的谱线称为第 一共振线。 1. 激发电位:低能态电子被激发到高能态时所需要的能量。 四. 原子发射光谱法一些常用的术语 4. 原子线、离子线 原子线(Ⅰ) :原子核外激发态电子跃迁回基态所发射出的谱线。 M * → M * (I) 离子线(Ⅱ,Ⅲ) :离子核外激发态电子跃迁回基态所发射出的谱线。 M+ * → M+ (Ⅱ) ; M2+* → M2+ (Ⅲ) 3. 最灵敏线、最后线、分析线 第一共振线一般也是元素的最灵敏线。 当该元素在被测物质里降低到一定含量时,出现的最后一条 谱线,这是最后线,也是最灵敏线。用来测量该元素的谱线称分 析线。 E2 E0 E1 E3

五.原子发射谱线强度与试样中元素浓度的关系 Ei 1.谱线强度及其影响因素 在高温下,处于热力学平衡状态时,单位体积的基 态原子数N与激发态原子数N,之间遵守Boltzmann分布 定律: Ni=Nog:/go e-EilkT (1) Eo 9:、90一激发态和基态的统计权重 E一激发电位 k 一Boltzmann常数 T一温度K 9=2J+1=4 5889.96A5895.93A 平均:5893A Na 32P32 E=3.37×10-19J 32S1/2 32P1/2 T=2500K:N/N0=5.72×105 90=2J41=2 9=2J+1=2 T=7000K:N/No=0.031
五.原子发射谱线强度与试样中元素浓度的关系 E0 Ei Ni = N0 gi /g0 e -Ei/kT (1) 在高温下,处于热力学平衡状态时,单位体积的基 态原子数N0与激发态原子数Ni 之间遵守Boltzmann分布 定律: gi 、g0—激发态和基态的统计权重 Ei —激发电位 k —Boltzmann常数 T —温度K 1. 谱线强度及其影响因素 3 2S1/2 3 2P3/2 3 2P1/2 Na g0=2J+1=2 gi=2J+1=2 gi=2J+1=4 5889.96 Å 5895.93 Å 平均:5893 Å E = 3.37 10-19J T=7000K: Ni / N0 = 0.031 T=2500K: Ni / N0 = 5.7210-5

在0←→i两能级间跃迁,谱线强度可表示为: A为跃迁几率 I=NiA;h (2) )为发射谱线的频率 (1)代入(2)得:N=Nog/8 e-EVKT (1) Ii=g:/go e-EkT A:ho:No 此式为谱线强度的基本公式。 再考虑到蒸发平衡: M一一蒸发出的原子数 k 蒸发速率常数 N=kCl6 6 逸出速率常数 C 试样中浓度 再在考虑到电离平衡: N0=(1-o)N 电离度 Ii=1g:/goe-Ei/kTA:hv;(1-a)k/51 C ◆逸出速率常数 主要的影响因素:◆跃迁几率 ◆激发电位 ◆统计权重 ◆激发温度 ◆蒸发速率常数 ◆电离度 当以上的影响因素恒定时: I=A]C
在0 i 两能级间跃迁,谱线强度可表示为: Ii= NiAi hυi (2) Ai 为跃迁几率 υi 为发射谱线的频率 (1)代入(2)得: Ni = N0 gi /g0 e -Ei/kT (1) Ii = gi /g0 e -Ei/kTAihυiN0 此式为谱线强度的基本公式。 再考虑到蒸发平衡: Nt =kC/ N t——蒸发出的原子数 k ——蒸发速率常数 ——逸出速率常数 C ——试样中浓度 再在考虑到电离平衡: N0=(1-)Nt ——电离度 Ii =[ gi /g0 e -Ei/kTAihυi (1-)k/] C ◆跃迁几率 ◆统计权重 ◆逸出速率常数 ◆蒸发速率常数 ◆电离度 主要的影响因素: I 当以上的影响因素恒定时: i =[ A] C ◆激发电位 ◆激发温度