
仪器分析(含奥验) 《仪器分析》课程 第三章 电位分桥法 Chapter Three Potentiometric Analysis
《仪器分析》课程 Chapter Three Potentiometric Analysis 第三章 电位分析法 仪器分析(含实验)

第二章电位分析法 电位分析(Potentiometric Analysis)分 为电位法(Potentiometry)和电位滴定 (Potentiometric Titration)两种 ■电位法:测量某一电极的电位,通过能 斯特公式直接获取待测离子浓度 根据滴定过程中的电位变化,依据所消 耗的滴定剂的量进行计算
第二章 电位分析法 ◼ 电位分析(Potentiometric Analysis)分 为电位法(Potentiometry)和电位滴定 (Potentiometric Titration)两种 ◼ 电位法:测量某一电极的电位,通过能 斯特公式直接获取待测离子浓度 ◼ 根据滴定过程中的电位变化,依据所消 耗的滴定剂的量进行计算

Potentiometric Methods Basis of method The difference between the E values for two halves of a cell give rise to E If one half reaction is known and held constant,we can measure the concentration of species on the other side
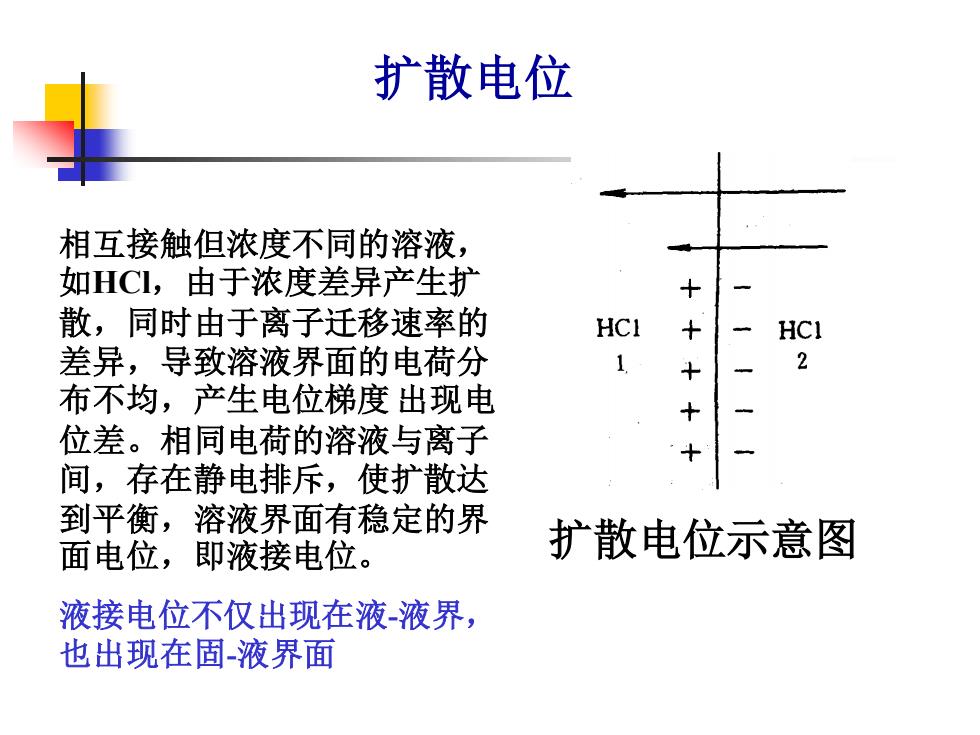
扩散电位 相互接触但浓度不同的溶液, 如HCI,由于浓度差异产生扩 + 散,同时由于离子迁移速率的 HCI + HCI 差异,导致溶液界面的电荷分 1 十 2 布不均,产生电位梯度出现电 位差。相同电荷的溶液与离子 + 间,存在静电排斥,使扩散达 到平衡,溶液界面有稳定的界 面电位,即液接电位。 扩散电位示意图 液接电位不仅出现在液-液界, 也出现在固液界面
扩散电位示意图 相互接触但浓度不同的溶液, 如HCl,由于浓度差异产生扩 散,同时由于离子迁移速率的 差异,导致溶液界面的电荷分 布不均,产生电位梯度 出现电 位差。相同电荷的溶液与离子 间,存在静电排斥,使扩散达 到平衡,溶液界面有稳定的界 面电位,即液接电位。 液接电位不仅出现在液-液界, 也出现在固-液界面 扩散电位
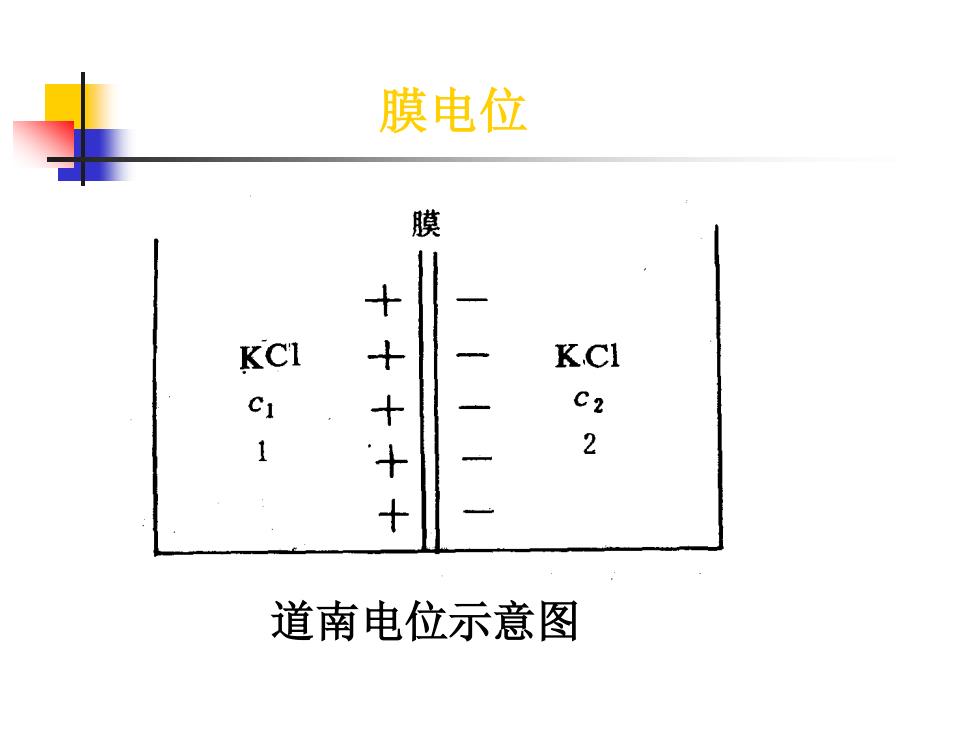
膜电位 膜 KCI KCl CI ++++ C2 2 道南电位示意图
道南电位示意图 膜电位

·道南电位的产生在于其选择性或强制性 引起界面两端离子浓度的差别,从而产 生双电层结构,而有电位差 RT In p阳p1-p2= a+2 a+0) RT D-F In d-)
◼ 道南电位的产生在于其选择性或强制性 引起界面两端离子浓度的差别,从而产 生双电层结构,而有电位差

三、膜电位 各种类型的离子选择电极的响应机理虽各有特点,但其电位产生的基本原因都是相似的,即 关键都在于膜电位,如图16-3所示。在敏感膜与溶液两 相间的界面上,由于离子扩散,产生相间电位(道南电位); 在膜相内部,膜内外的表面和膜本体的两个界面上尚有扩 内参比电极 散电位产生(严格地说,膜内部的扩散电位并无明显的分 内参比溶液a内 界线,图中为了方便而人为画出),其大小应该相同。 在图16-3中,若敏感膜仅对阳离子M+有选择性响 应,当电极浸入含有该离子的溶液中时,在膜内外的两个 膜本体 敏感膜 界面上,均产生道南型的相间电位: E道,外=1+RT aM(外 zF (16-14) aM(外) 待测溶液a州 图16-3膜电位及离子 Ea两-:+ 4M(内) 界(16-15) 选择电极的作用示意图 aM(内) 式中aM为液相中M+的活度,aM为膜相中M+的活度,之为离子的电荷数。通常敏感膜内外 表面的性质可以看成是相同的,即k1=k2,aM内)=aM外),且E扩,外=E扩,内,故膜电位为: E膜=E道外+E扩,外一E新内-E道,内= F In m (16-16) aM(内) 由于内参比溶液中M+的活度不变,为常数,所以 E限=常数+器na (16-17)

架的网络中存在体积较小但活动能力较强的阳离子,主要是一价的钠离子,并由它起导电作用。 溶液中的氢离子能进入网络并代替钠离子的点位,但阴离子却被带负 电荷的硅氧载体所排斥;高价阳离子也不能进出网络。所以考宁015 玻璃膜对氢离子具有选择性。 当玻璃膜浸泡在水中时,由于硅氧结构与氢离子的键合强度远大 于其与钠离子的键合强度(约为1014倍),因此发生如下的离子交换 反应: H*+NaGl-Na*+H*Gl7 使得玻璃膜表面的点位在酸性或中性溶液中基本上全为氢离子所占据 而形成一个类似硅酸(HG1)的水化胶层,平衡后厚度为104~105 mm。而在水化胶层的内部,氢离子的数目渐次减少,钠离子的数目则 相应地增加;在玻璃膜的中部,则仍是干玻璃区域,其点位全为钠离子 所占有。 HO在水化胶层表面与溶液的界面上进行扩散,于是破坏了界面 附近原来正负电荷分布的均匀性,在两相界面形成双电层结构,从而产 生道南电位。另外,在内、外水化胶层与干玻璃层之间,还存在着扩散 电位。根据式(16-16,17,18),玻璃电极的电位与试液pH有如下关 图16-4复合式 pH玻璃电极 系式(25℃): 1.玻璃敏感膜:2.陶 瓷赛:3.充填侧口:4 E孩=表+ina时 内参比电极;5.内参 比溶液;6.参比电 至送示-0.0592pH为0于(16-20) 极体系 这类用考宁015玻璃制成的pH玻璃电极,只能适用于pH1~10溶液的测量。当试液的 pH大于10时,测得的pH比实际数值要低,这种现象称为“碱差”。它来源于钠离子的扩散作 用,即钠离子重新进人玻璃膜的硅氧网络,并与氢离子交换而占有少数点位,故又被称为“钠差”。 如用L2O代替N2O制作玻璃膜,由于锂玻璃的硅氧网络中的空间较小,钠离子的半径较大,不 易进入膜相内与氢离子进行交换,因而避免了钠离子的干扰。实践证明,这种电极可用于测量 pH1~13.5的溶液

离子选择性电极 1 敏感膜选择性电极一般满足以下条件; 微溶性 ■导电性 ■可与待测离子或分子选择性响应
离子选择性电极 ◼ 敏感膜选择性电极一般满足以下条件; ◼ 微溶性 ◼ 导电性 ◼ 可与待测离子或分子选择性响应

离子选择性电极 最早的pH电极出现在1906年,1943年出 现Na+电极,上世纪五十年代建立了离子 选择性电极的膜电位理论,出现商品化 产品,1966年出现F离子选择性电极 ■离子选择性电极主要包括(1)敏感膜, 是最关键部分(2)内参溶液,含有与膜 及内参电极响应的离子(3)内参电极, 一 般用AgAgCI
离子选择性电极 ◼ 最早的pH电极出现在1906年,1943年出 现Na+电极,上世纪五十年代建立了离子 选择性电极的膜电位理论,出现商品化 产品,1966年出现F-离子选择性电极 ◼ 离子选择性电极主要包括(1)敏感膜, 是最关键部分(2)内参溶液,含有与膜 及内参电极响应的离子(3)内参电极, 一般用Ag|AgCl