
议器分行含奥验】 《仪器分析》课程 第团章 电解与库仑分析法
《仪器分析》课程 第四章 电解与库仑分析法 仪器分析(含实验)

§4一1电解分析法 基本概念 1.电解:借助外加电源的作用实现化学反应向着 非自发方向进行的过程,也是电解池中通过电流 的过程。 2.电解分析(Electrolytic Analysis) 1)电重量法(Electrolytic gravimetry):直接称量电 极上析出物质的质量 2)电解分离法(Electrolytic sepraration):使用电 解手段进行物质的分离 3.库仑分析((Coulometry):根据电解过程中所 消耗的电量求得被测物的含量→电量分析法 4.特点:无论由重量法还是库仑分析,不需要基 准物质和标准溶液
一、基本概念 1.电解:借助外加电源的作用实现化学反应向着 非自发方向进行的过程,也是电解池中通过电流 的过程。 2. 电解分析(Electrolytic Analysis) 1) 电重量法(Electrolytic gravimetry):直接称量电 极上析出物质的质量 2) 电解分离法(Electrolytic sepraration):使用电 解手段进行物质的分离 3.库仑分析(Coulometry):根据电解过程中所 消耗的电量求得被测物的含量电量分析法 4.特点:无论由重量法还是库仑分析,不需要基 准物质和标准溶液。 §4—1 电解分析法

§4—2发展历史 ■1800年意大利物理学家伏打成功制造伏打堆电 池。同年英国化学家卡里斯尔(A.Carlisle)和 尼柯尔森(W.Nicholson)利用伏打电池实现 了水的电解。 利用电流进行电量分析的最早尝试是电解分析 法。1864年,吉布斯首次利用这种方法测定铜。 铜的快速电解测定获得成功,促进这种分析方 法进一步扩展到其它金属。 1873年汉内(J.B.Hanney)测定汞 ■ 1877年G.Parodie测定Zn,Pb. Riche测定Mn ■1878年G.F.Smith测定Cd
§4—2 发展历史 ◼ 1800年意大利物理学家伏打成功制造伏打堆电 池。同年英国化学家卡里斯尔(A.Carlisle)和 尼柯尔森(W.Nicholson)利用伏打电池实现 了水的电解。 ◼ 利用电流进行电量分析的最早尝试是电解分析 法。1864年,吉布斯首次利用这种方法测定铜。 ◼ 铜的快速电解测定获得成功,促进这种分析方 法进一步扩展到其它金属。 ◼ 1873年汉内(J.B.Hanney) 测定汞 ◼ 1877年G.Parodie 测定Zn, Pb. Riche测定Mn ◼ 1878年G.F.Smith 测定Cd

对影响电解测定法的各种因素,在1818年 A.Calassen.之前,人们为改善电解分析法的质 量,着重于电解液的性质如改变溶剂、加入适 当电解质等方法。而Classen第一个利用仪器装 置系统观察了电流的大小,电流密度以及外加 电压对电解质量的影响,并发现电解溶液和电 解过程中搅拌电解液对电解速度有极大改善。 1889年,N.Klobukhov提出采用旋转阳极进行 搅拌。 1896年,H.Paweck使用网状杯形黄铜阴电极取 代坩埚状电极,提高效率。 1899年,C.Winkler使用圆柱形网状铂电极, 阳极为螺旋形铂丝,一直沿用至今
◼ 对影响电解测定法的各种因素,在1818年 A.Calassen之前,人们为改善电解分析法的质 量,着重于电解液的性质如改变溶剂、加入适 当电解质等方法。而Classen第一个利用仪器装 置系统观察了电流的大小,电流密度以及外加 电压对电解质量的影响,并发现电解溶液和电 解过程中搅拌电解液对电解速度有极大改善。 ◼ 1889年,N.Klobukhov提出采用旋转阳极进行 搅拌。 ◼ 1896年,H.Paweck使用网状杯形黄铜阴电极取 代坩埚状电极,提高效率。 ◼ 1899年,C.Winkler使用圆柱形网状铂电极, 阳极为螺旋形铂丝,一直沿用至今

§4一3电解分析的基本原理 一、分解电压 利用Pt电极电解1MHCI Cu2++2e=Cu↓ 阴极H(1M)+e→1/2H2 P大气压) 阳极C1-(1M)→1/2Cl2+eP2大气压) 2H20=4Ht+02+4e 负极→阴极→还原反应 正极→阳极→氧化反应
§4—3 电解分析的基本原理 一、分解电压 利用Pt电极电解1M HCl Cu2+ + 2e = Cu↓ 阴极 H+ (1M)+e →1/2 H2 (P1大气压) 阳极 Cl—(1M)→1/2Cl2+e (P2大气压) 2H2O = 4H+ + O2 + 4e— 负极阴极还原反应 正极阳极氧化反应
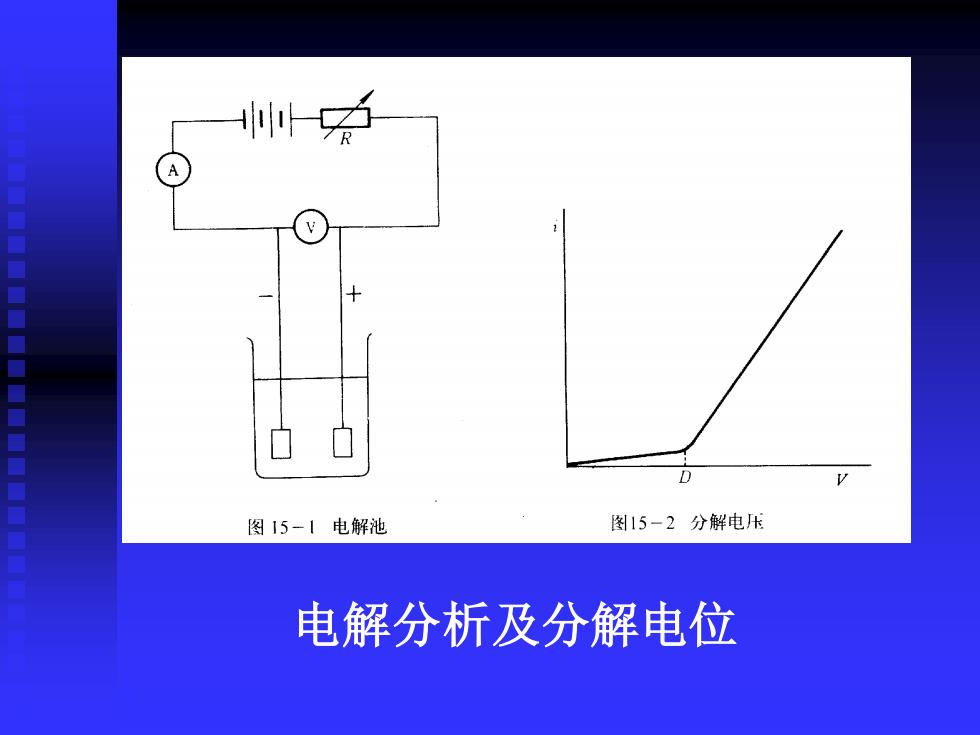
图15-1电解池 图15-2分解电压 电解分析及分解电位
电解分析及分解电位

AB,外加电压很小,几乎没有电流通过,V↑, 略↑ CD,外加电压增至一定数值,随V个急剧↑ C点即分解电压,电解物质在两电极上产 生迅速、连续不断的电极反应时可需的 最小外加电压,对可逆过程而言,其数 据等于它本身所构成的自发电动势
AB, 外加电压很小,几乎没有电流通过,V↑, i略↑ CD, 外加电压增至一定数值,i随V↑急剧↑ C点即分解电压,电解物质在两电极上产 生迅速、连续不断的电极反应时可需的 最小外加电压,对可逆过程而言,其数 据等于它本身所构成的自发电动势

E分=E反=E阳一E霸 而外加电压为V外=卫分+R Cu2++2e Cu p平=p°+RT/nF)lnCu2+1 P阴=p平反应处于平衡状态 P阴<p平ICu2+]减少,析出Cu 析出电位就是平衡时的电极电位 在阴极上,析出电位愈正者,愈易还原,而在 阳极上析出电位愈负者,愈易氧化
E分 = E反 = E阳 — E阴 而外加电压为 V外 = E分 + iR Cu2+ + 2e = Cu φ平 = φø+ (RT/nF)ln[Cu2+ ] φ阴 = φ平 反应处于平衡状态 φ阴﹤φ平 [Cu2+ ]减少,析出Cu 析出电位就是平衡时的电极电位 在阴极上,析出电位愈正者,愈易还原,而在 阳极上析出电位愈负者,愈易氧化

如:Cu,Pb,Cd,Zn E(V) Cu2++2e=Cu (s) +0.337 Pb2++2e Pb (s) 0.126 Zn2++2e=Zn (s) 0.763 Cd2++2e=Cd (s) -0.403 02,C2 2H20=02+4Ht+4e +1.229 2CI Cl,2 e +1.359 故:分解电压=电解池的反电动势=阳极平衡电 位一阴极平衡电位→(可逆) E分=9析(阳)一9析(阴)
如:Cu, Pb, Cd, Zn Eº(V) Cu2+ + 2e = Cu(s) +0.337 Pb2+ + 2e = Pb (s) 0.126 Zn2++2e=Zn(s) 0.763 Cd2++2e=Cd(s) -0.403 O2,Cl2 2H2O = O2+ 4H++ 4e - +1.229 2Cl- = Cl2 + 2 e +1.359 故:分解电压=电解池的反电动势=阳极平衡电 位—阴极平衡电位→(可逆) E分 =φ析(阳)—φ析(阴)

二、极化现象及过电位 ■ 极化:电极电位偏离其平衡值。 过电位:外加电压超过可逆电池电动势的值 口 F+|1ena9a9平)>0 mb=pe9平)<0 V分=9ap=l9平y9c平+(4ale) =V分理十门 所以V外=V分+R=V分理)+十R
二、极化现象及过电位 ◼ 极化:电极电位偏离其平衡值。 ◼ 过电位:外加电压超过可逆电池电动势的值η η=ηa +∣ηc∣ ηa=φa - φa(平)﹥0 ηb = φc - φc(平)﹤0 V分= φa - φc=[ φa(平) - φc(平) ]+(ηa -ηc ) = V分(理)+ η 所以V外=V分+ iR = V分(理)+ η+ iR