
第二章:无机非全属材料的结构 8g668516.6kV×38.8K'1:8gmm 80756615.0kVX5.g8k6:66wm
第二章:无机非金属材料的结构

2.1、不同层次上的陶瓷结构含义 1)微观结构(原子、分子尺度上) 指:键,晶体类型,缺陷类型及浓度等 ·固体材料是原子(离子、分子)排列、聚合而成,不但取决于原 子本性(物质组成),还和排列、聚合方式有关(晶体结构) ·晶体的性质是由晶体的组成和结构决定的,而组成和结构之间由 存在密切的内在联系。 2)显微结构 烧结体的晶粒大小、分布,粒界,气孔、裂纹等
2.1、不同层次上的陶瓷结构含义 1)微观结构( 原子、分子尺度上) 指:键,晶体类型,缺陷类型及浓度等 固体材料是原子(离子、分子)排列、聚合而成,不但取决于原 子本性(物质组成),还和排列、聚合方式有关(晶体结构) 晶体的性质是由晶体的组成和结构决定的,而组成和结构之间由 存在密切的内在联系。 2)显微结构 烧结体的晶粒大小、分布,粒界,气 孔、裂纹等 2

2.1、化学键 1化学键种类 >离子键:阳离子和阴离子通过静电引力结合; 1))结构严紧;2)无方向性和饱和性 3)离子晶体键能大,熔点、沸点高,硬度大、脆,延展性差。 >共价键:当两种电负性相差很小或相等的原子结合时,由双方原子各提供一定数量的电子组成共用电 子对,通过这些共用电子对把原子联系起来,这种键称为共价键。 1)fr,0φ)结构疏松,电子轨道 2)有方向性和饱和性,种类决定堆积形状,SP2(三角形),SP(四面体) 3)共价键晶体(原子晶体)具有高的硬度和低的导电性。 >金属键(电子键):每个金属原子都贡献出价电子,形成由整个金属晶体所共有的电子云。 导电性、导热性、延展性 >氢键 (小的氢核被相邻分子的并不共有的电子吸引) >范德华力(物理键):分子正负电荷中心不重合,使分子之间产生吸引力。是各种键中健力最弱的一种
2.1、化学键 1 化学键种类 离子键:阳离子和阴离子通过静电引力结合; 1)f=f(r) 结构严紧;2)无方向性和饱和性 3)离子晶体键能大,熔点、沸点高,硬度大、脆,延展性差。 共价键 :当两种电负性相差很小或相等的原子结合时,由双方原子各提供一定数量的电子组成共用电 子对,通过这些共用电子对把原子联系起来,这种键称为共价键。 1) f=f(r, ) 结构疏松,电子轨道 2)有方向性和饱和性,种类决 定堆积形状, SP2 (三角形),SP3 (四面体) 3)共价键晶体(原子晶体)具有高的硬度和低的导电性。 金属键 (电子键):每个金属原子都贡献出价电子,形成由整个金属晶体所共有的电子云。 导电性、导热性、延展性 氢键 (小的氢核被相邻分子的并不共有的电子吸引) 范德华力 (物理键):分子正负电荷中心不重合,使分子之间产生吸引力。是各种键中键力最弱的一种
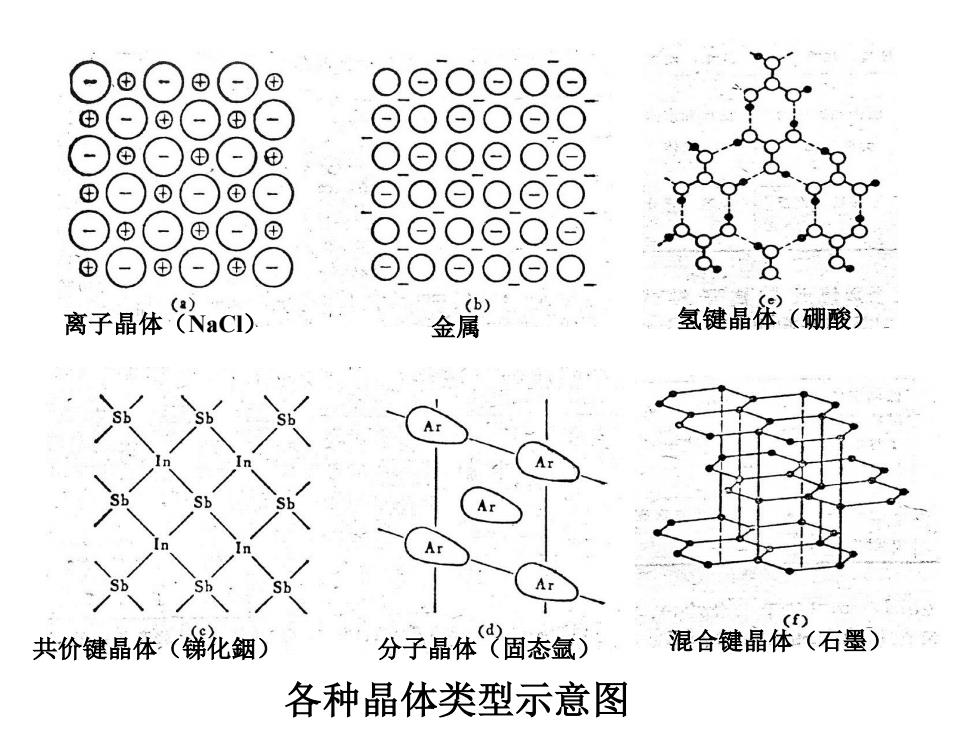
田 O⊙O⊙O⊙ ⊕ ⊙ ⊕ ⊕ 田 O ⊕ ⊕ ⊕ ⊕ () b) e) 离子晶体NaC) 金属 氢键晶体(硼酸) (f) 共价键晶体(佛化细〉 分子晶体(固态氩) 混合键晶体(石墨) 各种晶体类型示意图
离子晶体(NaCl) 金属 氢键晶体(硼酸) 共价键晶体(锑化銦) 分子晶体(固态氩) 混合键晶体(石墨) 各种晶体类型示意图 4
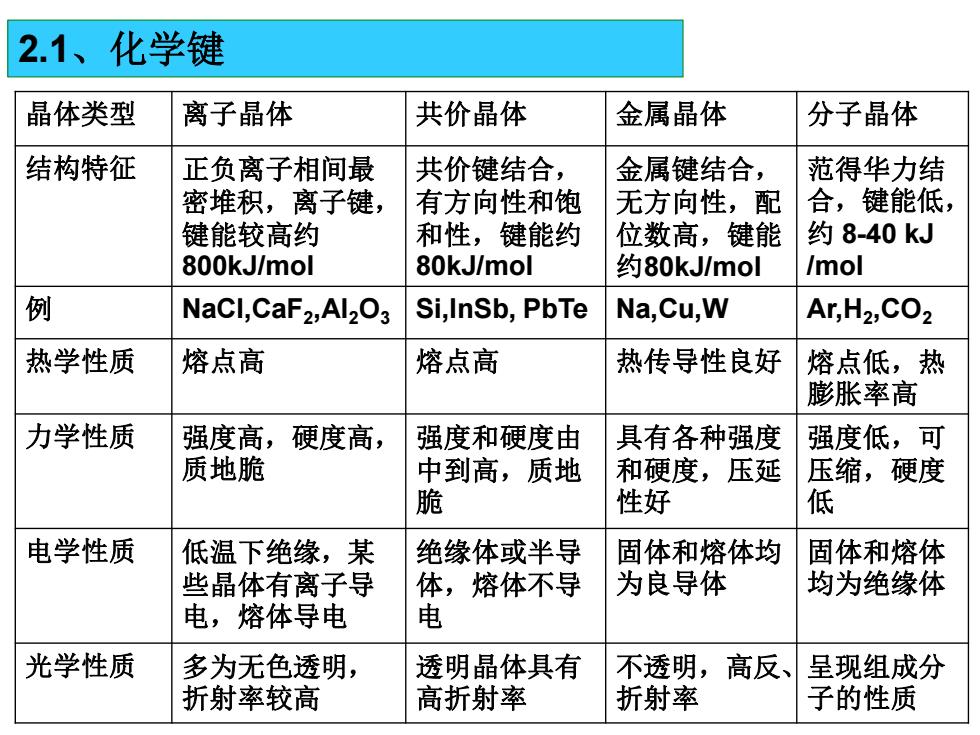
2.1、化学键 晶体类型 离子晶体 共价晶体 金属晶体 分子晶体 结构特征 正负离子相间最 共价键结合, 金属键结合, 范得华力结 密堆积,离子键, 有方向性和饱 无方向性,配 合,键能低, 键能较高约 和性,键能约 位数高,键能 约8-40kJ 800kJ/mol 80kJ/mol 约80kJ/mol /mol 例 NaCl,CaF2,Al2O3 Si,InSb,PbTe Na,Cu,W Ar,H2,CO2 热学性质 熔点高 熔点高 热传导性良好 熔点低,热 膨胀率高 力学性质 强度高, 硬度高, 强度和硬度由 具有各种强度 强度低,可 质地脆 中到高,质地 和硬度,压延 压缩,硬度 脆 性好 低 电学性质 低温下绝缘,某 绝缘体或半导 固体和熔体均 固体和熔体 些晶体有离子导 ,熔体不导 为良导体 均为绝缘体 电,熔体导电 电 光学性质 多为无色透明, 透明晶体具有 不透明,高反、 呈现组成分 折射率较高 高折射率 折射率 子的性质
晶体类型 离子晶体 共价晶体 金属晶体 分子晶体 结构特征 正负离子相间最 密堆积,离子键, 键能较高约 800kJ/mol 共价键结合, 有方向性和饱 和性,键能约 80kJ/mol 金属键结合, 无方向性,配 位数高,键能 约80kJ/mol 范得华力结 合,键能低, 约 8-40 kJ /mol 例 NaCl,CaF2 ,Al2O3 Si,InSb, PbTe Na,Cu,W Ar,H2 ,CO2 热学性质 熔点高 熔点高 热传导性良好 熔点低,热 膨胀率高 力学性质 强度高,硬度高, 质地脆 强度和硬度由 中到高,质地 脆 具有各种强度 和硬度,压延 性好 强度低,可 压缩,硬度 低 电学性质 低温下绝缘,某 些晶体有离子导 电,熔体导电 绝缘体或半导 体,熔体不导 电 固体和熔体均 为良导体 固体和熔体 均为绝缘体 光学性质 多为无色透明, 折射率较高 透明晶体具有 高折射率 不透明,高反、 折射率 呈现组成分 子的性质 2.1、化学键
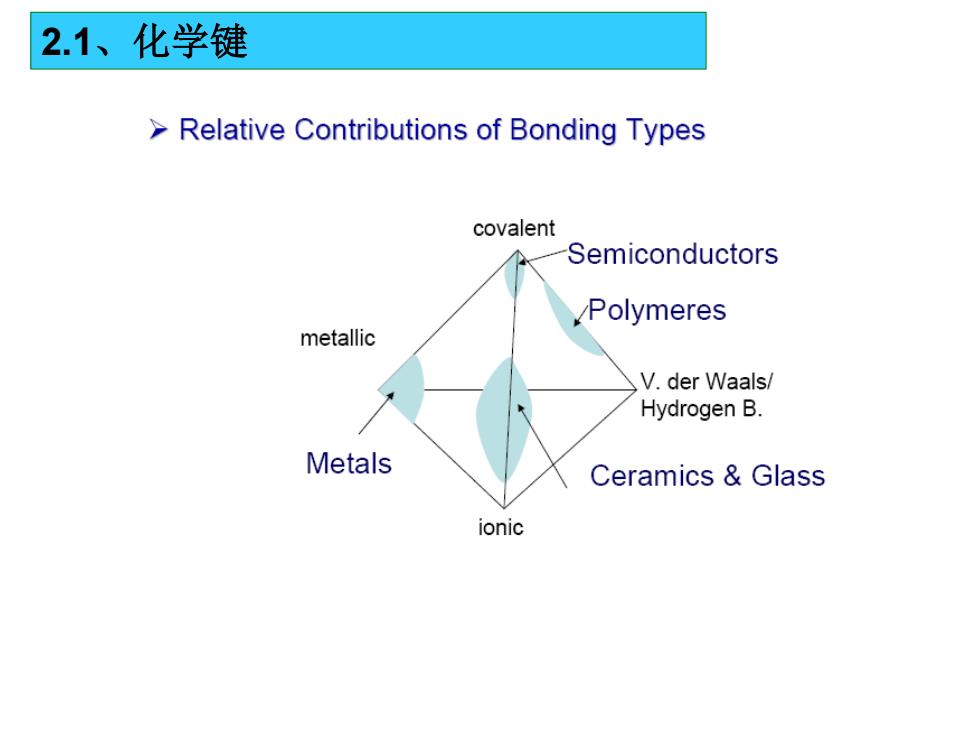
2.1、化学键 Relative Contributions of Bonding Types covalent Semiconductors Polymeres metallic V.der Waals/ Hydrogen B. Metals Ceramics Glass ionic
2.1、化学键
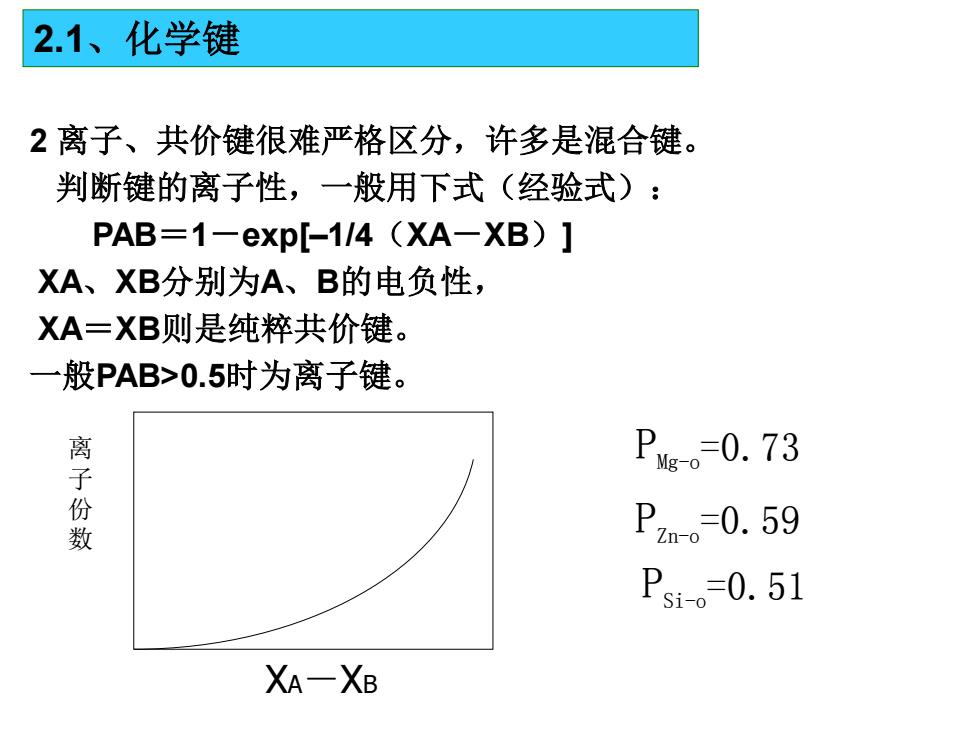
2.1、化学键 2离子、共价键很难严格区分,许多是混合键。 判断键的离子性,一般用下式(经验式): PAB=1-exp[-1/4 (XA-XB)] XA、XB分别为A、B的电负性, A=XB则是纯粹共价键。 一般PAB>0.5时为离子键。 离 Pg。-0.73 份数 Pzm。-0.59 Psi。-0.51 XA一XB
2 离子、共价键很难严格区分,许多是混合键。 判断键的离子性,一般用下式(经验式): PAB=1-exp[–1/4(XA-XB)] XA、XB分别为A、B的电负性, XA=XB则是纯粹共价键。 一般PAB>0.5时为离子键。 离 子 份 数 XA-XB PMg-o=0.73 PZn-o=0.59 PSi-o=0.51 2.1、化学键
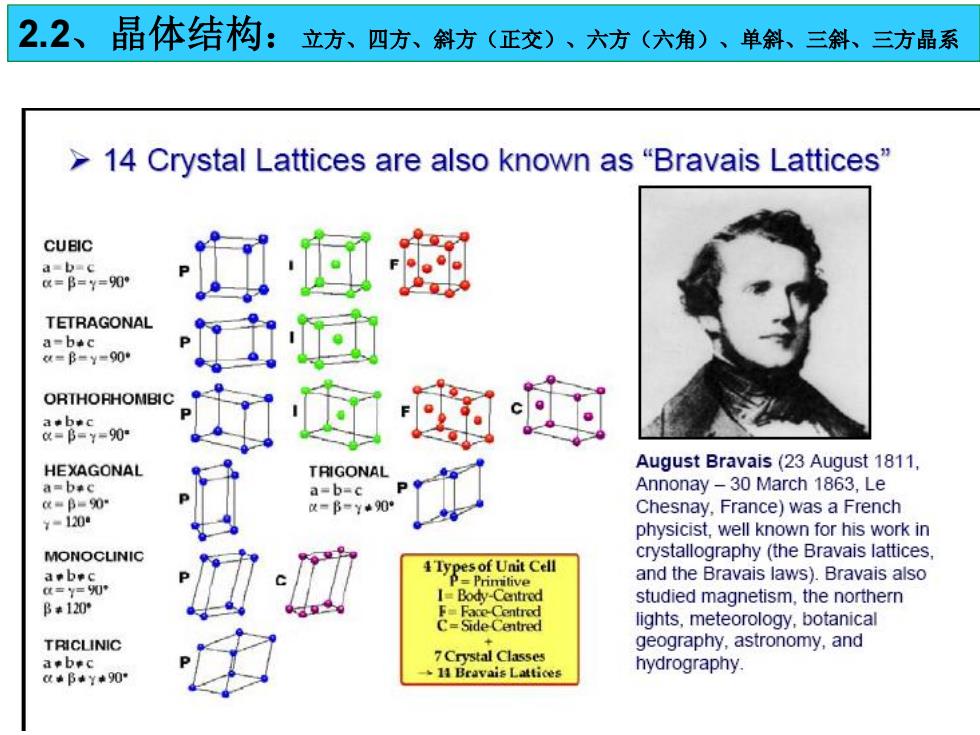
22、晶体结构:立方、四方、斜方(正交)、六方(六角)、单斜、三斜、三方晶系 >14 Crystal Lattices are also known as "Bravais Lattices" CUBIC abac a=B=y=90° TETRAGONAL a-bec u=B=y=900 ORTHORHOMBIC -90 HEXAGONAL TRIGONAL August Bravais(23 August 1811, amb¥c a-b-c Annonay-30 March 1863,Le a=B=90 =B=y90 Chesnay,France)was a French ¥=1200 physicist,well known for his work in MONOCUINIC crystallography (the Bravais lattices. a.bec Types of Unit Cell and the Bravais laws).Bravais also t=y=0严 I=Body-Centred B*120 studied magnetism,the northern F=Face-Centred C-SideCentred lights,meteorology,botanical TRICLINIC geography,astronomy,and a.bec 7Crystal Classes hydrography. *B*Y*90 11 Bravais Lattices
2.2、晶体结构:立方、四方、斜方(正交)、六方(六角)、单斜、三斜、三方晶系
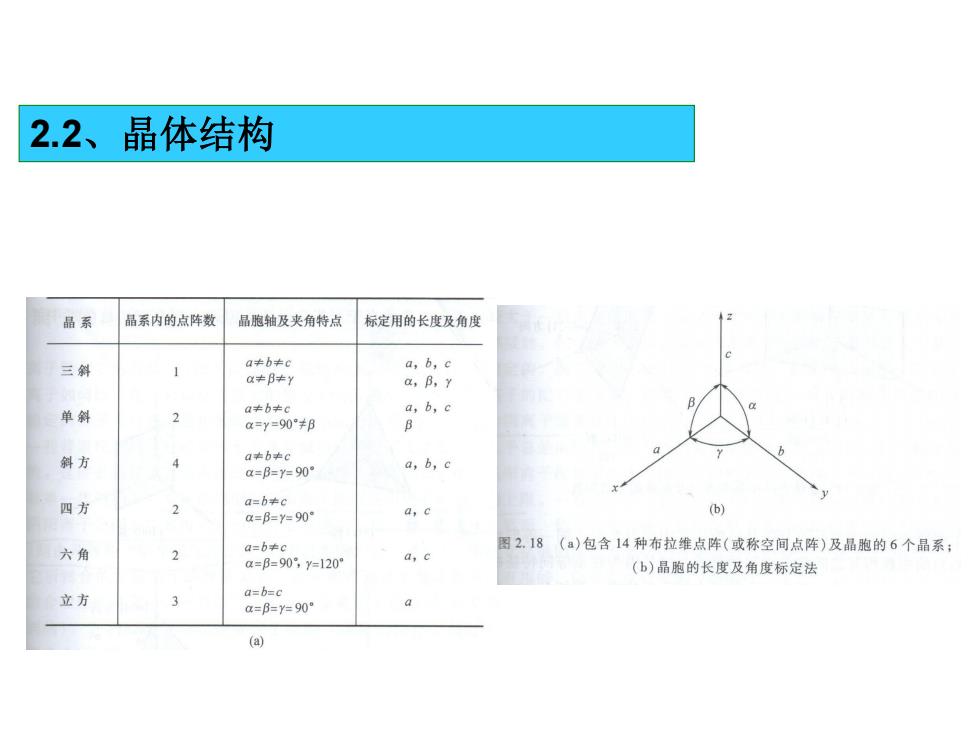
2.2、晶体结构 晶系 晶系内的点阵数 晶胞轴及夹角特点 标定用的长度及角度 三斜 a≠b≠c a,b,c a≠B+y a,B,y 单斜 a≠b*c a,b,c a=y=90°≠B B 斜方 a≠b中c a=B=y=90 a,b,c 四方 a=b≠c 2 a=B=y=90 a,c (b) 六角 a=bc 图2.18()包含14种布拉维点阵(或称空间点阵)及晶胞的6个晶系: 2 a=B=90°,y=120 a,c (b)晶胞的长度及角度标定法 立方 a=b=c a=f=y=90° (a)
2.2、晶体结构

2.2、晶体结构 最稳定的晶体结构: 1)满足每个)原子大小;b)价键数;c)价键的方向等 2)原子堆积最紧密 3)能量最低的状态:最大的静电引力及最小的静电斥力 晶体结构确定的粗略步骤: 1)阴离子堆积类型-面心立方、体心立方、六方最密堆积 2)阳离子配位数(阴阳离子半径大小比)一根据阴阳离子价态推出阴离子配位数 3)阴阳离子多体面以怎样的形式连接共点、共面、共棱
最稳定的晶体结构: 1)满足每个a)原子大小;b)价键数;c)价键的方向等 2)原子堆积最紧密 3)能量最低的状态:最大的静电引力及最小的静电斥力 2.2、晶体结构 1)阴离子堆积类型-面心立方、体心立方、六方最密堆积 2)阳离子配位数( 阴阳离子半径大小比)-根据阴阳离子价态推出 阴离子配位数 3)阴阳离子多体面以怎样的形式连接-共点、共面、共棱 晶体结构确定的粗略步骤: