
LY/T1222-1999 前 言 本标准是对GB/T7842一1987《森林土壤溶液中氧含量的测定》的修订,在修订中,对不符合国家 法定计量单位标准的单位、不符合全国科学名词审定委员会公布的土壤学名词的名词予以修改:在编写 上,按GB/T1.1-1993的要求执行。 本标准采用碘量法,该法适用于土壤积水地段野外采集土裹溶液中氧含量样品带回实验室进行测 定。 自本标准实糖之日起,原GB/T7842-1987作疲, 本标准由中国林业科学研究院林业研充所归口。 本标准起草单位:中国林业科学研充院林业研究所森林士壤研究室。 本标准主要起草人张万属、杨光溢、暑南、张萍。 44
LY/T 1222-1999 前 言 本标准是对GB/T 7842-1987(森林土壤溶液中氧含里的测定》的修订。在修订中,对不符合国家 法定计t单位标准的单位、不符合全国科学名词审定委员会公布的土镶学名词的名词予以修改;在编写 上,按GB/T 1. 1-1993的要求执行. 本标准采用碘t法,该法适用于土坡积水地段野外采集土堪溶液中氧含盆样品带回实验室进行测 定 。 自本标准实施之 日起 ,原 GB/T 7842-1987作废。 本标准由中国林业科学研究院林业研究所归 口。 本标准起草单位:中国林业科学研究院林业研究所森林土坡研究室。 本标准主要起 草人 :张万儒 、杨光挂 、屠星南 、张萍

中华人民共和国林业行业标准 森林土壤溶液中氧含量的测定 LY/T1222-1999 Determination of oxygen content in forest soll solution 1范图 本标准规定了采用碘量法测定森林土篾溶液中氧含量的方法。 本标准透用于森林土壤溶液中氧含量的测定。 2方法要点 土壤水中的溶解氧在氢氧化的存在的条件下加二氯化锰(MCl,)溶液,二氟化锰即被氧化为三价 的锰化合物[Mn(OH),]沉淀,其反应式为 4MnCl:+0:+8NaOH+2H.O-4Mn(OH),++8NaCl 然后用盐酸将三价锰化合物沉淀溶解,此时三价伍(M+)即与碘化钾起作用,使病离子(【)氧化变为 分子(1:),其反应式为: 6HCl+2Mn(OHD,+2K1→2MnCL,+l:+2KC+6H0 陕分子(L,)在含量上与水中之氧分于O:的含量相当,产生的陕分子用硫代硫酸钠标准溶减滴定,其 反应式为: 1+2Na S:O-NaS,O+2Nal 1moll,相当于1 mol Na:S:O,由以上反应得知,1 mol NaS,0,相当于1molO,. 3试剂 3.1800gL二氯化锰溶液:称取80g二氟化锰(MC1,·4H,O)溶于100mL赶去二氧化碳气体 (C0)的水中,待其溶解后,用干操滤纸过选,贮囊于棕色试剂瓶中。 3.2氢氧化钠、碘化钾混合溶液(480 g NaOH+100gKI/L):称取48g氢氧化钠溶于100mL赶去二 氧化碳气体(C0)的水中,加入10g碘化钾,搅掉到全部溶解为止, 330.0100molL代疏酸钠标准溶液:称取2.48g琉代硫酸钠(Na,S0,:5H,0)溶于20mL新 鲜煮湾赶去二氧化碳气体(CO,)并冷却的水中,如入0.02g碳酸钠防止溶液分解以及0,01g碘化汞防 止溶液发莓,待完全溶解,用水定容至1L,放置于棕色瓶中数日后,用重络酸卿标准溶液标定。标定方 法如下, 精确称取在130℃过3h的重络酸钾0.1000g,加人30mL水使其溶解,再加5mL浓盐酸及 10mL150g/L碳化钾溶液,充分混合,效置暗处5min,用水稀释至200mL松后用待标定的疏代硫酸 钠溶液滴定至溶液由标红色褪至淡黄色,立即加人1mL10g/L淀粉海液,继续滴定到蓝色退去,溶液 无色(稍带绿色)即为年点,记录硫代酸钠标准溶液的用量,按式(1)计算其浓度: c=7×0.04904 4……(1) 式中:c一硫代硫酸钠的浓度,mol/L 国家林业局1999-07-15批准 1999-11-01实施
中华人民共和国林业行业标准 森林土壤溶液中氧含皿的测定 LY/T 1222-1999 Determination of oxygen content in forest soil solution 范囤 本标 准规定了采用碘t法测定森林土壤 溶液中氧含t的方法 。 本 标准适用于森林土壤溶液 中氧含量 的测定. 2 方法要点 土壤水中的溶解氧在氢氧化钠存在的条件下加二氛化锰(MnCl, )溶液,二抓化锰即被氧化为三价 的锰化合物[Mn (OH),]沉淀,其反应式为: 4MnCl,+0, +8NaOH+ 214,0 - >4Mn (OH) 3十+8NaCl 然后用盐酸将三价锰化合物沉淀溶解 ,此时三价锰(Mn")即与碘化钾起作用,使碘离子(I-)氧化变为 碘分子(1z),其反应式为: 6HCI+2Mn(OH),令+2KI - 2MnCl,+I,+2KCl+614,0 碘分子‘I,,在含量上与水中音氧分子(10,{的含”“,产生的碘分子用硫代硫酸钠标准溶液滴定,其 反应式 为: I:十2Na,S,0a - 'Na,S,O1+2Nal 1 mol合1,相当于1 mol Na,S20,,由以上反应得知,1 mol Na,S,O,相当于1 mol专0 3 试 剂 3. 1 800 g/L二抓化锰溶液:称取 80 g二抓化锰(MnCI, " 414,0)溶于100 mL赶去二氧化碳气体 (CO,)的水中,待其溶解后,用干燥滤纸过滤,贮藏于棕色试剂瓶中。 3.2 氢氧化钠、碘化钾混合溶液(480 g NaOH+100 g KI/L):称取48 g氢氧化钠溶于100 mL赶去二 氧化碳气体(C0,)的水中,加人10g碘化钾,搅拌到全部溶解为止。 3. 3 0. 010 0 mol/L硫代硫酸钠标准溶液:称取2. 48 g硫代硫酸钠(Na,Sz03·51,0)溶于200 ml,新 鲜煮沸赶去二氧化碳气体(Cq)并冷却的水中,加人。. 02 g碳酸钠防止溶液分解以及。. 01 g碘化汞防 止溶液发霉,待完全溶解,用水定容至 1L,放置于棕色瓶中数日后,用重铬酸钾标准溶液标定.标定方 法如 下: 精确称取在 130,C烘过 3h的重铬酸钾 。.1000g,加人 30 mL水使其溶解,再加 5 mL浓盐酸及 10 mL 150 g/L碘化钾溶液,充分混合,放置暗处5 min,用水稀释至 200 mL然后用待标定的硫代硫酸 钠溶液滴定至溶液由棕红色褪至淡黄色,立即加人 1 mL 10 g/L淀粉溶液,继续滴定到蓝色退去,溶液 呈无色(稍带绿色)即为终点,记录硫代硫酸钠标准溶液的用量,按式(1)计算其浓度: 刀 之 V X 0.049 04 .........… … 。...·.… … (1 ) 式中:c 硫代硫酸钠的浓度,mol/L ; 国家林业 局 1999一07一15批准 1999一11一01实施 45
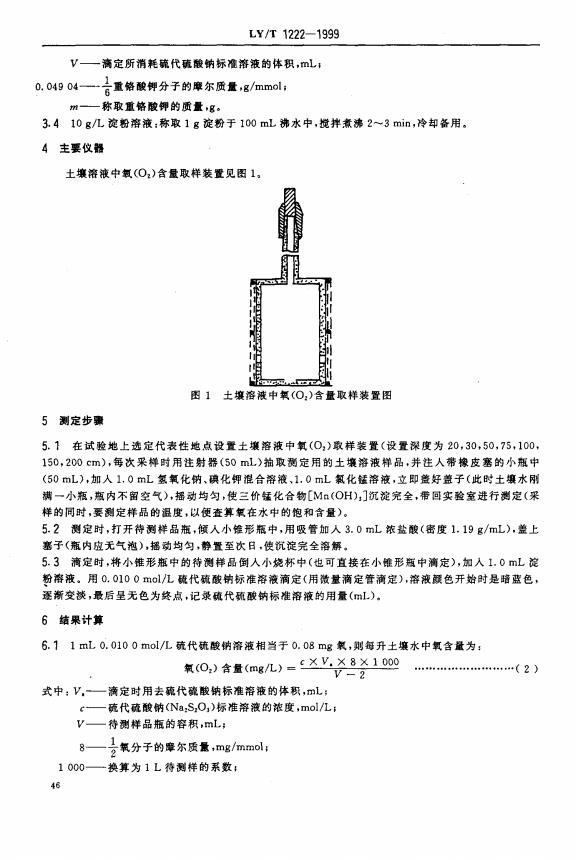
LY/T1222-1999 V一滴定所消耗硫代酸钠标准液的体积,mL 0.04904一重格酸钾分子的摩尔质量,g/mmol 一称取重结酸钾的质量,g 3.410g/L淀粉液:称取1g淀粉于100mL沸水中,搅拌煮沸2~3min,冷却备用。 4主要仪器 土壤溶液中氧(O,)含量取样装置见图1, 困1土壤溶被中氧(0,)含量取样装置 5测定步骤 5.1在试验地上选定代表性地点设置土壤溶液中氧(0,)取样装置(设受深度为20,30,50,75,100 150,200cm),每次采样时用注射器(50mL)抽取测定用的土壤游液样品,并注人带橡皮塞的小瓶中 (50mL),加人1,0mL氢氧化钠、碘化钾谁合溶液,1.0mL氯化锰存液,立即普好整子(此时土壤水刚 满一小瓶,瓶内不留空气),摇动均匀,使三价锰化合物[M(OH):]沉淀完全,带回实验毫进行测定(采 样的同时,要测定样品的温度,以便查算氧在水中的饱和含量) 5.2测定时,打开待测样品瓶,倾人小锥形瓶中,用吸管如人3.0mL浓盐酸(密度1.19g/mL),盖上 塞子(瓶内应无气泡),摇动均匀,静置至次日,使沉淀完全溶解。 5.3滴定时,将小推形瓶中的待测样品倒人小烧杯中(也可直接在小锥形瓶中滴定),加入1.0mL淀 粉溶液。用0.0100mo1/L硫代硫酸钠标准溶液滴定(用微量滴定管滴定),溶液颜色开始时是暗蓝色 逐渐交淡,最后呈无色为终点,记录斑代硫酸钠标准溶液的用量(mL), 6结果计算 6.11mL0.0100mol/L硫代硫酸钠溶液相当于0.08mg氧,则每升土壤水中氧含量为: 氣(0,)含量(mg几)=X.8X100 式中:V,—滴定时用去硫代酸钠标准溶液的体积,mL c一硫代硫酸钠(NaS,O,)标准溶液的浓度,mol/L: V一待测样品瓶的容积,mL; 8 一氧分子的摩尔质量,mg/mmol: 1000一换算为1L待测样的系数: 48
LY/T 1222-1999 V— 滴定所消耗硫代硫酸钠标准溶液的体积,mL; 0.049 04-枷。。分子的,尔质$ ,g/mmol; 勿— 称取重铬酸钾的质$,g. 3.4 10 g/L淀粉溶液:称取 1g淀粉于 100 mL沸水中,搅拌煮沸2^-3 min,冷却备用。 4 主要仪器 土坡溶液中氧(Oz)含量取样装里见图1, 图 1 土壤溶液 中氧 (0,)含量取样装置 图 5 测定步骤 5. 1 在试验地上选定代表性地点设置土壤溶液中氧(0,)取样装置(设置深度为 20,30,50,75,100, 150,200 cm),每次采样时用注射器(50 mL)抽取测定用的土镶洛液样品,并注人带橡皮塞的小瓶中 (50 mL),加人 1. 0 mL氢氧化钠、碘化钾混合溶液、1. 0 mL抓化锰溶液,立即盖好盖子(此时土壤水刚 满一小瓶,瓶内不留空气),摇动均匀,使三价锰化合物〔Mn(OH),〕沉淀完全,带回实验室进行测定(采 样的同时,要测定样品的温度,以便查算氧在水中的饱和含量)。 5.2 测定时,打开待测样品瓶,倾人小锥形瓶中,用吸管加人3. 0 mL浓盐酸(密度 1. 19 g/mL),盖上 塞子(瓶内应无气泡),摇动均匀,静置至次日,使沉淀完全溶解。 5.3 滴定时,将小锥形瓶中的待测样品倒人小烧杯中(也可直接在小锥形瓶中滴定),加人 1. 0 mL淀 攀溶液。用。. 010 0 mol/L硫代硫酸钠标准溶液滴定(用微量滴定管滴定),溶液颜色开始时是暗蓝色, 逐渐变淡,最后呈无色为终点,记录硫代硫酸钠标准溶液的用量(mL). 6 结果计算 6.1 1 mL 0.010 0 mol/L硫代硫酸钠溶液相当于0. 08 mg氧,则每升土壤水中氧含量为: 氧(0,)含量(mg/L)= cXV.X 8X 1000 V 一 2 ......…… ,.·····……(2) 式中:V.- 滴定时用去硫代硫酸钠标准溶液的体积,mL; c— 硫代硫酸钠(Na2Si00 )标准溶液的浓度,mol /L ; V 待测样 品瓶的容积 ,mL; 8一枷杆的,尔质I , mg/mmol ; 000— 换算为1L待测样的系数;

LY/m1222-1999 2—氧化锰溶液和氢氧化钠,碘化钾混合溶液的用量,L。 6.2氧的体积(mL) g0,)含量mLL)=cxV.X5-59X100… ……(3) 式中:5.59一1mL0.0100mol/L硫代硫酸钠标准溶液相当于5.59mL氧. 6.3氧的饱和度(%) 氧的饱和度(%)=意×100 …(4) 式中,B -每升水样中氧(O)含量,mg几 B 一同一温度下氧在水中的饱和含量(见表1),mg/儿, 表1氧在水中的溶解度(即炮和含量B) mg/L .c024680121416182022 B14.5713.713.0312.411.811.2610.7810.289.859.459.108.74
LY/T 1222-1999 6.2 2 氧化锰溶液和组氧化钠、碘化钾混合溶液的用f,mL, 氧的体积(mL) 氧(O,)含f (mL/L)= cXV,X 5.59X 1 000 V 一 2 … 。.....… … 。..… “.“。(3 ) 式中:5. 59- 1 mL 0. 010 0 mol/L硫代硫酸钠标准溶液相当于 5.59 mL氧。 6.3 氧的饱 和度 (%) B 氧的饱和度(%)= -BI 式中:B— 每升水样中氧(O,)含最,mg/L= x 100 … 。....… … 。… 。.… … ( 4 ) B'— 同一温度下氧在水中的饱和含A(见表 1),mg/L, 表 1 氧在水 中的溶解度 (即饱 和含$ B') mg/L