
食品论坛 http://bbs.foodmate.net 第五章 食品毒理学实验基础 以科学研究为目的而进行科学饲养繁殖的动物称为实验动物。实验动物学作为在现代科 学带动崛起的一门以生命科学为主体,以医学、生物为核心的综合性独立的新兴学科,正以 崭新的面貌,异乎寻常的速度,影响着整个生命科学各领域,成为生命科学研究的奠基学科 和重要支撑条件,因而受到世界各国政府和科学家的重视,甚至作为衡量一个国家生物科学 水平高低的标志之一。 食品毒理学的很多研究工作需要通过动物实验来进行。使用实验动物进行科研的优点是 花费人力、物力较少,时间短,易发现单因素与结果的关系,能提供大量有价值的可与人类 生命活动现象相类比的资料。在毒理学实验研究中,健康的实验动物是保证工作顺利进行和 获得正确可靠的研究结果的重要条件。 食品毒理学研究外源化学物对于机体(特别是人体)的有害作用及其机制。食品毒理学研 究的主要手段是动物实验。体内试验是以实验动物为模型,最终目的是通过外源化学物对实 验动物的毒性反应,向人(原型)外推,以期评估外源化学物对人的危害及危险性。体外实验 主要用于筛选和预测急性毒性和机制研究;人体实验和流行病学调查则可进一步深化和证实 在动物实验中所得到的资料。实际上,食品毒理学作为一门实验科学是以动物实验为中心的, 食品毒理学动物实验的设计、实施、结果观察和评价是毒理学研究的基本方法。 食品毒理学试验是对化学物安全性评价的主要手段,已为各国际组织或各国的行政部门 所颁布的规程或指南列为常规试验,有称为法规毒理学试验(regulatory toxico1ogy test),这 类毒理学试验是以筛查和描述外来化学物的毒性为目的,属于描述毒理学范畴。 第一节 食品毒理学实验的原则和局限性 一、食品毒理学实验的原则 在毒理学的试验中,有三个基本的原则。 第一个原则,化学物在实验动物产生的作用,可以外推于人。基本假设为:①人是最敏 感的动物物种;②人和实验动物的生物学过程包括化学物的代谢,与体重(或体表面积)相关。 这两个假设也是全部实验生物学和医学的前提。以单位体表面积计算在人产生毒作用的剂量 和实验动物通常相近似。而以体重计算则人通常比实验动物敏感,差别可能达10倍。因此可 以利用安全系数来计算人的相对安全剂量。已知人致癌物都对某种实验动物具有致癌性;实 验动物致癌物是否都对人有致癌性,还不清楚,但这已作为动物致癌试验的基础。一般认为, 如果某一化学物对几个物种实验动物的毒性是相同的,则人的反应也可能是相似的。 第二个原则是实验动物必须暴露于高剂量,这是发现对人潜在危害的必需的和可靠的方 法。此原则是根据质反应的概念,随剂量或暴露增加,群体中效应发生率增加。毒理学试验 中,一般要设3个或3个以上剂量组,以观察剂量-反应(效应)关系,确定受试化学物引起毒效 应及其毒性参数。毒性试验的设计并不是为了证明化学品的安全性,而是为了表征化学品可 能产生的毒作用。仅仅检测受试化学物在人的暴露剂量是否引起毒效应是不够的。当引起毒 效应的最低剂量(LOAEL)与人的暴露剂量接近时,说明该化学物不安全。当该剂量与人的暴 露剂量有很大的距离(几十倍,几百倍或以上),才认为具有一定安全性,此距离越大,安全 性越可靠。如果在研究中所用的一系列的剂量不能引起毒性效应,则认为所用剂量还不足够 高,应增加剂量,以确定受试化学品的毒性。但如果在试验的最高剂量组的剂量与人可能的 暴露剂量有足够的安全界限,则对于安全性评价来说未观察到毒效应的研究是可以接受的。 在毒理学试验中实验模型所需的动物总是远少于处于危险中的人群。为了在少量动物得到有
食品论坛 http://bbs.foodmate.net 第五章 食品毒理学实验基础 以科学研究为目的而进行科学饲养繁殖的动物称为实验动物。实验动物学作为在现代科 学带动崛起的一门以生命科学为主体,以医学、生物为核心的综合性独立的新兴学科,正以 崭新的面貌,异乎寻常的速度,影响着整个生命科学各领域,成为生命科学研究的奠基学科 和重要支撑条件,因而受到世界各国政府和科学家的重视,甚至作为衡量一个国家生物科学 水平高低的标志之一。 食品毒理学的很多研究工作需要通过动物实验来进行。使用实验动物进行科研的优点是 花费人力、物力较少,时间短,易发现单因素与结果的关系,能提供大量有价值的可与人类 生命活动现象相类比的资料。在毒理学实验研究中,健康的实验动物是保证工作顺利进行和 获得正确可靠的研究结果的重要条件。 食品毒理学研究外源化学物对于机体(特别是人体)的有害作用及其机制。食品毒理学研 究的主要手段是动物实验。体内试验是以实验动物为模型,最终目的是通过外源化学物对实 验动物的毒性反应,向人(原型)外推,以期评估外源化学物对人的危害及危险性。体外实验 主要用于筛选和预测急性毒性和机制研究;人体实验和流行病学调查则可进一步深化和证实 在动物实验中所得到的资料。实际上,食品毒理学作为一门实验科学是以动物实验为中心的, 食品毒理学动物实验的设计、实施、结果观察和评价是毒理学研究的基本方法。 食品毒理学试验是对化学物安全性评价的主要手段,已为各国际组织或各国的行政部门 所颁布的规程或指南列为常规试验,有称为法规毒理学试验(regulatory toxico1ogy test),这 类毒理学试验是以筛查和描述外来化学物的毒性为目的,属于描述毒理学范畴。 第一节 食品毒理学实验的原则和局限性 一、食品毒理学实验的原则 在毒理学的试验中,有三个基本的原则。 第一个原则,化学物在实验动物产生的作用,可以外推于人。基本假设为:①人是最敏 感的动物物种;②人和实验动物的生物学过程包括化学物的代谢,与体重(或体表面积)相关。 这两个假设也是全部实验生物学和医学的前提。以单位体表面积计算在人产生毒作用的剂量 和实验动物通常相近似。而以体重计算则人通常比实验动物敏感,差别可能达10倍。因此可 以利用安全系数来计算人的相对安全剂量。已知人致癌物都对某种实验动物具有致癌性;实 验动物致癌物是否都对人有致癌性,还不清楚,但这已作为动物致癌试验的基础。一般认为, 如果某一化学物对几个物种实验动物的毒性是相同的,则人的反应也可能是相似的。 第二个原则是实验动物必须暴露于高剂量,这是发现对人潜在危害的必需的和可靠的方 法。此原则是根据质反应的概念,随剂量或暴露增加,群体中效应发生率增加。毒理学试验 中,一般要设3个或3个以上剂量组,以观察剂量-反应(效应)关系,确定受试化学物引起毒效 应及其毒性参数。毒性试验的设计并不是为了证明化学品的安全性,而是为了表征化学品可 能产生的毒作用。仅仅检测受试化学物在人的暴露剂量是否引起毒效应是不够的。当引起毒 效应的最低剂量(LOAEL)与人的暴露剂量接近时,说明该化学物不安全。当该剂量与人的暴 露剂量有很大的距离(几十倍,几百倍或以上),才认为具有一定安全性,此距离越大,安全 性越可靠。如果在研究中所用的一系列的剂量不能引起毒性效应,则认为所用剂量还不足够 高,应增加剂量,以确定受试化学品的毒性。但如果在试验的最高剂量组的剂量与人可能的 暴露剂量有足够的安全界限,则对于安全性评价来说未观察到毒效应的研究是可以接受的。 在毒理学试验中实验模型所需的动物总是远少于处于危险中的人群。为了在少量动物得到有

食品论坛 http://bbs.foodmate.net 统计学意义的可靠的结果,需要应用相对较高的剂量,以使效应发生的频率足以检测。例如, 低达0.01%的癌症发生率,这意味着在100万人群中有100人发生癌症,此发生率太高,不能 为公众接受。在实验动物直接检测如此低发生率将至少需要30000只动物。因此,别无选择, 在毒理学试验中,对相对较少的实验动物必须以较高剂量进行试验,然后根据毒理学原则外 推估计低剂量暴露的危险性。 第三个原则,成年的健康(雄性和雌性未孕)实验动物和人可能的暴露途径是基本的选 择。选用成年的健康(雄性和雌性未孕)实验动物是为了使实验结果具有代表性和可重复性。 以成年的健康(雄性和雌性未孕)实验动物作为一般人群的代表性实验模型,而将幼年和老年 动物、妊娠的雌性动物、疾病状态作为特殊情况另作研究。这样可降低实验对象的多样性, 减少实验误差。毒理学实验结果的敏感性取决于受试物处理引起毒效应强度和实验误差两个 因素,处理引起的毒效应强,实验误差小,则实验结果的敏感性增加,反映受试物处理的真 实效应,反之亦然。在下文所述的实验设计是要规定实验条件,严格控制可能影响毒效应的 各种因素,实施质量保证,降低实验误差。只有这样,才能保证试验结果的准确性和可重复 性,不能重复的实验结果是没有任何科学价值的。外源化学物以不同途径染毒,实验动物表 现的毒性可有很大差异,这是由于因染毒部位解剖生理特点不同,外源化学物吸收进入血液 的速度和量也不同,首先到达的器官和组织也不同。因此,毒理学试验中染毒途径的选择, 应尽可能模拟人接触该受试物的方式。 二、食品毒理学实验的局限性 历史上,环境污染物及某些药物所引起的中毒和死亡多次发生,引起各国的重视,推动 了毒理学的发展,各国政府主管部门制订和多次修订了有关药品和各种化学品安全性评价的 规范或准则,希望在啮齿类和非啮齿类的毒理学研究能为有关候选新药和各种化学品提供安 全性证据,但以动物的资料预测人的毒性的预测价值尚有待于研究。Lumley(1990)和 Igarashi(1994)根据有限的临床资料报告,发现对人的毒性约一半不能由临床前(动物)毒性研 究预测。Heywood(1983)报告27个化学物(大多为药品)的靶器官毒性在大鼠和狗(或猴)之间的 相符率仅20%。Olson等(1998)报告131种化学物对动物的毒性与人的毒性相符率,啮齿类为 6%,非啮齿类(狗和猴)为28%,合并达36%,所有的物种相符率可达69%。按照目前的规 范,进行毒理学安全性评价,可以在一定程度上提高新药和各种化学品的使用安全性,但仍 不能完全排除对人健康危害的风险。WHO在《临床前药物安全性实验原则》的文件中指出“虽 然事先对生物活性物质进行了最仔细彻底的研究,但给人使用时总是不可避免地要冒一定的 风险。”这就是利用动物实验的局限性,即动物实验的结果外推到人的不确定性。 用实验动物的毒理学实验资料外推到人群接触的安全性时,会有很大的不确定性。这是 因为,外源化学物的毒性作用受到许多因素的影响。 首先,实验动物和人对外源化学物的反应敏感性不同,有时甚至存在着质的差别。虽然 在毒理学实验中通过用两种或两种以上的动物,并尽可能选择与人对毒物反应相似的动物, 但要完全避免物种差异是不可能的。而且,实验动物不能述说涉及主观感觉的毒效应,如疼 痛、腹胀、疲乏、头晕、眼花、耳鸣等,这些毒效应就难以或不可能发现。在动物实验中, 可观察到体征(sign),而没有症状(symptom)。 第二,在毒理学实验中,为了寻求毒作用的靶器官,并能在相对少量的动物上就能得到 剂量-反应或剂量-效应关系,往往选用较大的染毒剂量,这一剂量通常要比人实际接触的剂 量大得多。有些化学物在高剂量和低剂量的毒性作用规律并不一定一致,如大剂量下出现的 反应有可能是由于化学物在体内超过了机体的代谢能力,这就存在高剂量向低剂量外推的不 确定性。 第三,毒理学实验所用动物数量有限,那些发生率很低的毒性反应,在少量动物中难以 发现。而化学物一旦进入市场,接触人群往往会很大。这就存在小数量实验动物到大量人群
食品论坛 http://bbs.foodmate.net 统计学意义的可靠的结果,需要应用相对较高的剂量,以使效应发生的频率足以检测。例如, 低达0.01%的癌症发生率,这意味着在100万人群中有100人发生癌症,此发生率太高,不能 为公众接受。在实验动物直接检测如此低发生率将至少需要30000只动物。因此,别无选择, 在毒理学试验中,对相对较少的实验动物必须以较高剂量进行试验,然后根据毒理学原则外 推估计低剂量暴露的危险性。 第三个原则,成年的健康(雄性和雌性未孕)实验动物和人可能的暴露途径是基本的选 择。选用成年的健康(雄性和雌性未孕)实验动物是为了使实验结果具有代表性和可重复性。 以成年的健康(雄性和雌性未孕)实验动物作为一般人群的代表性实验模型,而将幼年和老年 动物、妊娠的雌性动物、疾病状态作为特殊情况另作研究。这样可降低实验对象的多样性, 减少实验误差。毒理学实验结果的敏感性取决于受试物处理引起毒效应强度和实验误差两个 因素,处理引起的毒效应强,实验误差小,则实验结果的敏感性增加,反映受试物处理的真 实效应,反之亦然。在下文所述的实验设计是要规定实验条件,严格控制可能影响毒效应的 各种因素,实施质量保证,降低实验误差。只有这样,才能保证试验结果的准确性和可重复 性,不能重复的实验结果是没有任何科学价值的。外源化学物以不同途径染毒,实验动物表 现的毒性可有很大差异,这是由于因染毒部位解剖生理特点不同,外源化学物吸收进入血液 的速度和量也不同,首先到达的器官和组织也不同。因此,毒理学试验中染毒途径的选择, 应尽可能模拟人接触该受试物的方式。 二、食品毒理学实验的局限性 历史上,环境污染物及某些药物所引起的中毒和死亡多次发生,引起各国的重视,推动 了毒理学的发展,各国政府主管部门制订和多次修订了有关药品和各种化学品安全性评价的 规范或准则,希望在啮齿类和非啮齿类的毒理学研究能为有关候选新药和各种化学品提供安 全性证据,但以动物的资料预测人的毒性的预测价值尚有待于研究。Lumley(1990)和 Igarashi(1994)根据有限的临床资料报告,发现对人的毒性约一半不能由临床前(动物)毒性研 究预测。Heywood(1983)报告27个化学物(大多为药品)的靶器官毒性在大鼠和狗(或猴)之间的 相符率仅20%。Olson等(1998)报告131种化学物对动物的毒性与人的毒性相符率,啮齿类为 6%,非啮齿类(狗和猴)为28%,合并达36%,所有的物种相符率可达69%。按照目前的规 范,进行毒理学安全性评价,可以在一定程度上提高新药和各种化学品的使用安全性,但仍 不能完全排除对人健康危害的风险。WHO在《临床前药物安全性实验原则》的文件中指出“虽 然事先对生物活性物质进行了最仔细彻底的研究,但给人使用时总是不可避免地要冒一定的 风险。”这就是利用动物实验的局限性,即动物实验的结果外推到人的不确定性。 用实验动物的毒理学实验资料外推到人群接触的安全性时,会有很大的不确定性。这是 因为,外源化学物的毒性作用受到许多因素的影响。 首先,实验动物和人对外源化学物的反应敏感性不同,有时甚至存在着质的差别。虽然 在毒理学实验中通过用两种或两种以上的动物,并尽可能选择与人对毒物反应相似的动物, 但要完全避免物种差异是不可能的。而且,实验动物不能述说涉及主观感觉的毒效应,如疼 痛、腹胀、疲乏、头晕、眼花、耳鸣等,这些毒效应就难以或不可能发现。在动物实验中, 可观察到体征(sign),而没有症状(symptom)。 第二,在毒理学实验中,为了寻求毒作用的靶器官,并能在相对少量的动物上就能得到 剂量-反应或剂量-效应关系,往往选用较大的染毒剂量,这一剂量通常要比人实际接触的剂 量大得多。有些化学物在高剂量和低剂量的毒性作用规律并不一定一致,如大剂量下出现的 反应有可能是由于化学物在体内超过了机体的代谢能力,这就存在高剂量向低剂量外推的不 确定性。 第三,毒理学实验所用动物数量有限,那些发生率很低的毒性反应,在少量动物中难以 发现。而化学物一旦进入市场,接触人群往往会很大。这就存在小数量实验动物到大量人群

食品论坛 http://bbs.foodmate.net 外推的不确定性。 第四,实验动物一般都是实验室培育的品系,一般选用成年健康动物,反应较单一,而 接触人群可以是不同的人种、种族,而且包括年老体弱及患病的个体,在对外源化学物毒性 反应的易感性上存在很大差异。 以上这些都构成了从毒理学动物实验结果向人群安全性评价外推时的不确定因素。 第二节 毒理学毒性评价试验的基本目的 毒理学实验的常规部分是毒性评价或安全性评价试验。为了对受试物的毒性进行全面的 测试,增强测试结果的可靠性,权威机构规定了评价程序,以保证毒性评价研究可以达到普 遍能接受的最低要求和原则。毒理学家认为毒理学试验程序应该有一定的灵活性。对毒理学 试验的原理和设计思路的深入理解,有助于研究者对评价程序的实施,在发现新的现象或线 索时,可进行一些补充实验来证实,并可进一步研究其机制。 毒性评价或安全性评价方面的基本目的包括以下几点: 1. 受试物毒作用的表现和性质。在急性和慢性毒性试验中,观察受试物对机体的有害 作用,对有害作用的观察应该是对每个实验动物进行全面的逐项的观察和记录。发现有害作 用是进行剂量-反应(效应)研究的前提。 2. 剂量-反应(效应)研究。剂量-反应(效应)研究是毒性评价和安全性评价的基础。通过 对不同有害作用的剂量-反应(效应)研究,可以得到该受试物的多种毒性参数。在急性(致死 性)毒性试验中,应该得到LD50,也可以得到LD01和MTD。在急性非致死性毒性试验中,应 该得到急性可观察到有害作用的最低剂量(LOAEL)和未观察到有害作用的剂量(NOAEL)。在 亚急性、亚慢性及慢性毒性试验中,应该得到相应的LOAEL和NOAEL。在致突变、致癌和 致畸等特殊毒性试验中,剂量-反应(效应)研究将为确定受试物是否具有这些特殊毒性提供依 据。在致畸试验也可得到LOAEL和NOAEL;在致突变、致癌试验中,尽管认为是无阈值的, 但也可得到表观的LOAEL和NOAEL。 3. 确定毒作用的靶器官。确定受试物有害作用的靶器官,是毒理学研究的重要目的, 以阐明受试物毒作用的特点,并为进一步的机制研究和毒性防治提供线索。 4. 确定损害的可逆性。一旦确认有害作用存在,就应研究停止接触后该损害是否可逆 和消失,器官和组织功能是否能恢复,还是像化学致癌作用那样停止接触后损害继续发展? 毒性的可逆性关系到对人的危害评价,如果受损的器官组织能够修复并恢复正常功能,则可 能接受较高危险性的接触水平。 当然,毒理学研究还可能有其他的目的和要求,例如毒作用的敏感检测指标和生物学标 志、毒作用机制研究、受试物的毒物动力学和代谢研究、中毒的解救措施等。对这些要求, 应扩展常规试验的设计以包括有关的项目,或者另外设计和进行靶器官毒理学研究及机制毒 理学研究。 第三节 实验动物的选择和处理 毒理学的动物实验是以实验动物作为研究对象的,为获得可靠的研究结果,先决条件是 正确地选用实验动物。 一、实验动物物种的选择 外源化学物的固有毒性往往在人和不同物种实验动物之间表现不同,物种差别可以表现 在量方面,引起毒性的剂量差别,即毒性大小的差别,如有报道,对人138种化学物的敏感
食品论坛 http://bbs.foodmate.net 外推的不确定性。 第四,实验动物一般都是实验室培育的品系,一般选用成年健康动物,反应较单一,而 接触人群可以是不同的人种、种族,而且包括年老体弱及患病的个体,在对外源化学物毒性 反应的易感性上存在很大差异。 以上这些都构成了从毒理学动物实验结果向人群安全性评价外推时的不确定因素。 第二节 毒理学毒性评价试验的基本目的 毒理学实验的常规部分是毒性评价或安全性评价试验。为了对受试物的毒性进行全面的 测试,增强测试结果的可靠性,权威机构规定了评价程序,以保证毒性评价研究可以达到普 遍能接受的最低要求和原则。毒理学家认为毒理学试验程序应该有一定的灵活性。对毒理学 试验的原理和设计思路的深入理解,有助于研究者对评价程序的实施,在发现新的现象或线 索时,可进行一些补充实验来证实,并可进一步研究其机制。 毒性评价或安全性评价方面的基本目的包括以下几点: 1. 受试物毒作用的表现和性质。在急性和慢性毒性试验中,观察受试物对机体的有害 作用,对有害作用的观察应该是对每个实验动物进行全面的逐项的观察和记录。发现有害作 用是进行剂量-反应(效应)研究的前提。 2. 剂量-反应(效应)研究。剂量-反应(效应)研究是毒性评价和安全性评价的基础。通过 对不同有害作用的剂量-反应(效应)研究,可以得到该受试物的多种毒性参数。在急性(致死 性)毒性试验中,应该得到LD50,也可以得到LD01和MTD。在急性非致死性毒性试验中,应 该得到急性可观察到有害作用的最低剂量(LOAEL)和未观察到有害作用的剂量(NOAEL)。在 亚急性、亚慢性及慢性毒性试验中,应该得到相应的LOAEL和NOAEL。在致突变、致癌和 致畸等特殊毒性试验中,剂量-反应(效应)研究将为确定受试物是否具有这些特殊毒性提供依 据。在致畸试验也可得到LOAEL和NOAEL;在致突变、致癌试验中,尽管认为是无阈值的, 但也可得到表观的LOAEL和NOAEL。 3. 确定毒作用的靶器官。确定受试物有害作用的靶器官,是毒理学研究的重要目的, 以阐明受试物毒作用的特点,并为进一步的机制研究和毒性防治提供线索。 4. 确定损害的可逆性。一旦确认有害作用存在,就应研究停止接触后该损害是否可逆 和消失,器官和组织功能是否能恢复,还是像化学致癌作用那样停止接触后损害继续发展? 毒性的可逆性关系到对人的危害评价,如果受损的器官组织能够修复并恢复正常功能,则可 能接受较高危险性的接触水平。 当然,毒理学研究还可能有其他的目的和要求,例如毒作用的敏感检测指标和生物学标 志、毒作用机制研究、受试物的毒物动力学和代谢研究、中毒的解救措施等。对这些要求, 应扩展常规试验的设计以包括有关的项目,或者另外设计和进行靶器官毒理学研究及机制毒 理学研究。 第三节 实验动物的选择和处理 毒理学的动物实验是以实验动物作为研究对象的,为获得可靠的研究结果,先决条件是 正确地选用实验动物。 一、实验动物物种的选择 外源化学物的固有毒性往往在人和不同物种实验动物之间表现不同,物种差别可以表现 在量方面,引起毒性的剂量差别,即毒性大小的差别,如有报道,对人138种化学物的敏感
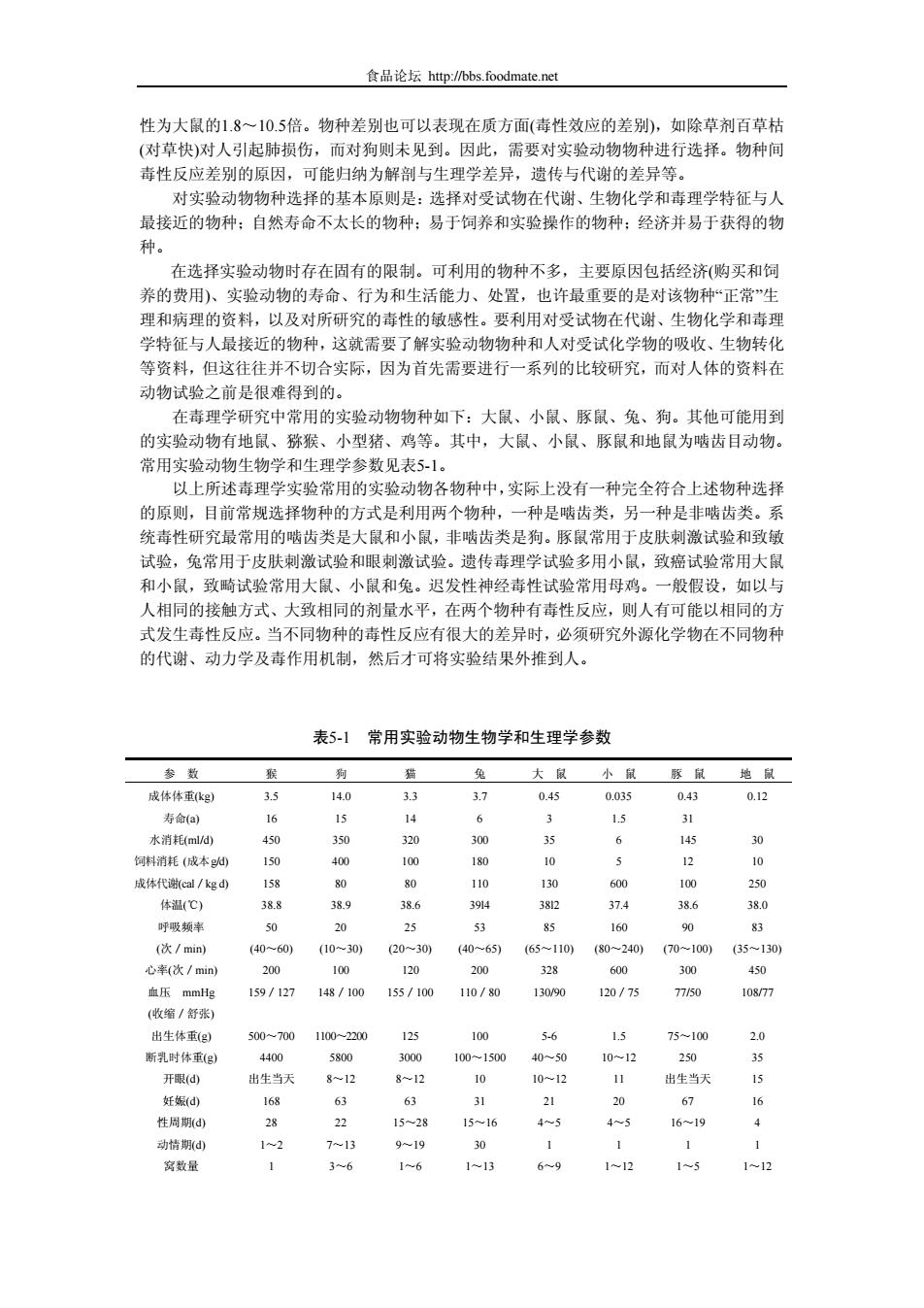
食品论坛 http://bbs.foodmate.net 性为大鼠的1.8~10.5倍。物种差别也可以表现在质方面(毒性效应的差别),如除草剂百草枯 (对草快)对人引起肺损伤,而对狗则未见到。因此,需要对实验动物物种进行选择。物种间 毒性反应差别的原因,可能归纳为解剖与生理学差异,遗传与代谢的差异等。 对实验动物物种选择的基本原则是:选择对受试物在代谢、生物化学和毒理学特征与人 最接近的物种;自然寿命不太长的物种;易于饲养和实验操作的物种;经济并易于获得的物 种。 在选择实验动物时存在固有的限制。可利用的物种不多,主要原因包括经济(购买和饲 养的费用)、实验动物的寿命、行为和生活能力、处置,也许最重要的是对该物种“正常”生 理和病理的资料,以及对所研究的毒性的敏感性。要利用对受试物在代谢、生物化学和毒理 学特征与人最接近的物种,这就需要了解实验动物物种和人对受试化学物的吸收、生物转化 等资料,但这往往并不切合实际,因为首先需要进行一系列的比较研究,而对人体的资料在 动物试验之前是很难得到的。 在毒理学研究中常用的实验动物物种如下:大鼠、小鼠、豚鼠、兔、狗。其他可能用到 的实验动物有地鼠、猕猴、小型猪、鸡等。其中,大鼠、小鼠、豚鼠和地鼠为啮齿目动物。 常用实验动物生物学和生理学参数见表5-1。 以上所述毒理学实验常用的实验动物各物种中,实际上没有一种完全符合上述物种选择 的原则,目前常规选择物种的方式是利用两个物种,一种是啮齿类,另一种是非啮齿类。系 统毒性研究最常用的啮齿类是大鼠和小鼠,非啮齿类是狗。豚鼠常用于皮肤刺激试验和致敏 试验,兔常用于皮肤刺激试验和眼刺激试验。遗传毒理学试验多用小鼠,致癌试验常用大鼠 和小鼠,致畸试验常用大鼠、小鼠和兔。迟发性神经毒性试验常用母鸡。一般假设,如以与 人相同的接触方式、大致相同的剂量水平,在两个物种有毒性反应,则人有可能以相同的方 式发生毒性反应。当不同物种的毒性反应有很大的差异时,必须研究外源化学物在不同物种 的代谢、动力学及毒作用机制,然后才可将实验结果外推到人。 表5-1 常用实验动物生物学和生理学参数 参 数 猴 狗 猫 兔 大 鼠 小 鼠 豚 鼠 地 鼠 成体体重(kg) 3.5 14.0 3.3 3.7 0.45 0.035 0.43 0.12 寿命(a) 16 15 14 6 3 1.5 31 水消耗(ml/d) 450 350 320 300 35 6 145 30 饲料消耗 (成本g/d) 150 400 100 180 10 5 12 10 成体代谢(cal/kg d) 158 80 80 110 130 600 100 250 体温(℃) 38.8 38.9 38.6 39l4 38l2 37.4 38.6 38.0 呼吸频率 50 20 25 53 85 160 90 83 (次/min) (40~60) (10~30) (20~30) (40~65) (65~110) (80~240) (70~100) (35~130) 心率(次/min) 200 100 120 200 328 600 300 450 血压 mmHg 159/127 148/100 155/100 110/80 130/90 120/75 77/50 108/77 (收缩/舒张) 出生体重(g) 500~700 1100~2200 125 100 5-6 1.5 75~100 2.0 断乳时体重(g) 4400 5800 3000 100~1500 40~50 10~12 250 35 开眼(d) 出生当天 8~12 8~12 10 10~12 11 出生当天 15 妊娠(d) 168 63 63 31 21 20 67 16 性周期(d) 28 22 15~28 15~16 4~5 4~5 16~19 4 动情期(d) 1~2 7~13 9~19 30 1 1 1 1 窝数量 1 3~6 1~6 1~13 6~9 1~12 1~5 1~12
食品论坛 http://bbs.foodmate.net 性为大鼠的1.8~10.5倍。物种差别也可以表现在质方面(毒性效应的差别),如除草剂百草枯 (对草快)对人引起肺损伤,而对狗则未见到。因此,需要对实验动物物种进行选择。物种间 毒性反应差别的原因,可能归纳为解剖与生理学差异,遗传与代谢的差异等。 对实验动物物种选择的基本原则是:选择对受试物在代谢、生物化学和毒理学特征与人 最接近的物种;自然寿命不太长的物种;易于饲养和实验操作的物种;经济并易于获得的物 种。 在选择实验动物时存在固有的限制。可利用的物种不多,主要原因包括经济(购买和饲 养的费用)、实验动物的寿命、行为和生活能力、处置,也许最重要的是对该物种“正常”生 理和病理的资料,以及对所研究的毒性的敏感性。要利用对受试物在代谢、生物化学和毒理 学特征与人最接近的物种,这就需要了解实验动物物种和人对受试化学物的吸收、生物转化 等资料,但这往往并不切合实际,因为首先需要进行一系列的比较研究,而对人体的资料在 动物试验之前是很难得到的。 在毒理学研究中常用的实验动物物种如下:大鼠、小鼠、豚鼠、兔、狗。其他可能用到 的实验动物有地鼠、猕猴、小型猪、鸡等。其中,大鼠、小鼠、豚鼠和地鼠为啮齿目动物。 常用实验动物生物学和生理学参数见表5-1。 以上所述毒理学实验常用的实验动物各物种中,实际上没有一种完全符合上述物种选择 的原则,目前常规选择物种的方式是利用两个物种,一种是啮齿类,另一种是非啮齿类。系 统毒性研究最常用的啮齿类是大鼠和小鼠,非啮齿类是狗。豚鼠常用于皮肤刺激试验和致敏 试验,兔常用于皮肤刺激试验和眼刺激试验。遗传毒理学试验多用小鼠,致癌试验常用大鼠 和小鼠,致畸试验常用大鼠、小鼠和兔。迟发性神经毒性试验常用母鸡。一般假设,如以与 人相同的接触方式、大致相同的剂量水平,在两个物种有毒性反应,则人有可能以相同的方 式发生毒性反应。当不同物种的毒性反应有很大的差异时,必须研究外源化学物在不同物种 的代谢、动力学及毒作用机制,然后才可将实验结果外推到人。 表5-1 常用实验动物生物学和生理学参数 参 数 猴 狗 猫 兔 大 鼠 小 鼠 豚 鼠 地 鼠 成体体重(kg) 3.5 14.0 3.3 3.7 0.45 0.035 0.43 0.12 寿命(a) 16 15 14 6 3 1.5 31 水消耗(ml/d) 450 350 320 300 35 6 145 30 饲料消耗 (成本g/d) 150 400 100 180 10 5 12 10 成体代谢(cal/kg d) 158 80 80 110 130 600 100 250 体温(℃) 38.8 38.9 38.6 39l4 38l2 37.4 38.6 38.0 呼吸频率 50 20 25 53 85 160 90 83 (次/min) (40~60) (10~30) (20~30) (40~65) (65~110) (80~240) (70~100) (35~130) 心率(次/min) 200 100 120 200 328 600 300 450 血压 mmHg 159/127 148/100 155/100 110/80 130/90 120/75 77/50 108/77 (收缩/舒张) 出生体重(g) 500~700 1100~2200 125 100 5-6 1.5 75~100 2.0 断乳时体重(g) 4400 5800 3000 100~1500 40~50 10~12 250 35 开眼(d) 出生当天 8~12 8~12 10 10~12 11 出生当天 15 妊娠(d) 168 63 63 31 21 20 67 16 性周期(d) 28 22 15~28 15~16 4~5 4~5 16~19 4 动情期(d) 1~2 7~13 9~19 30 1 1 1 1 窝数量 1 3~6 1~6 1~13 6~9 1~12 1~5 1~12
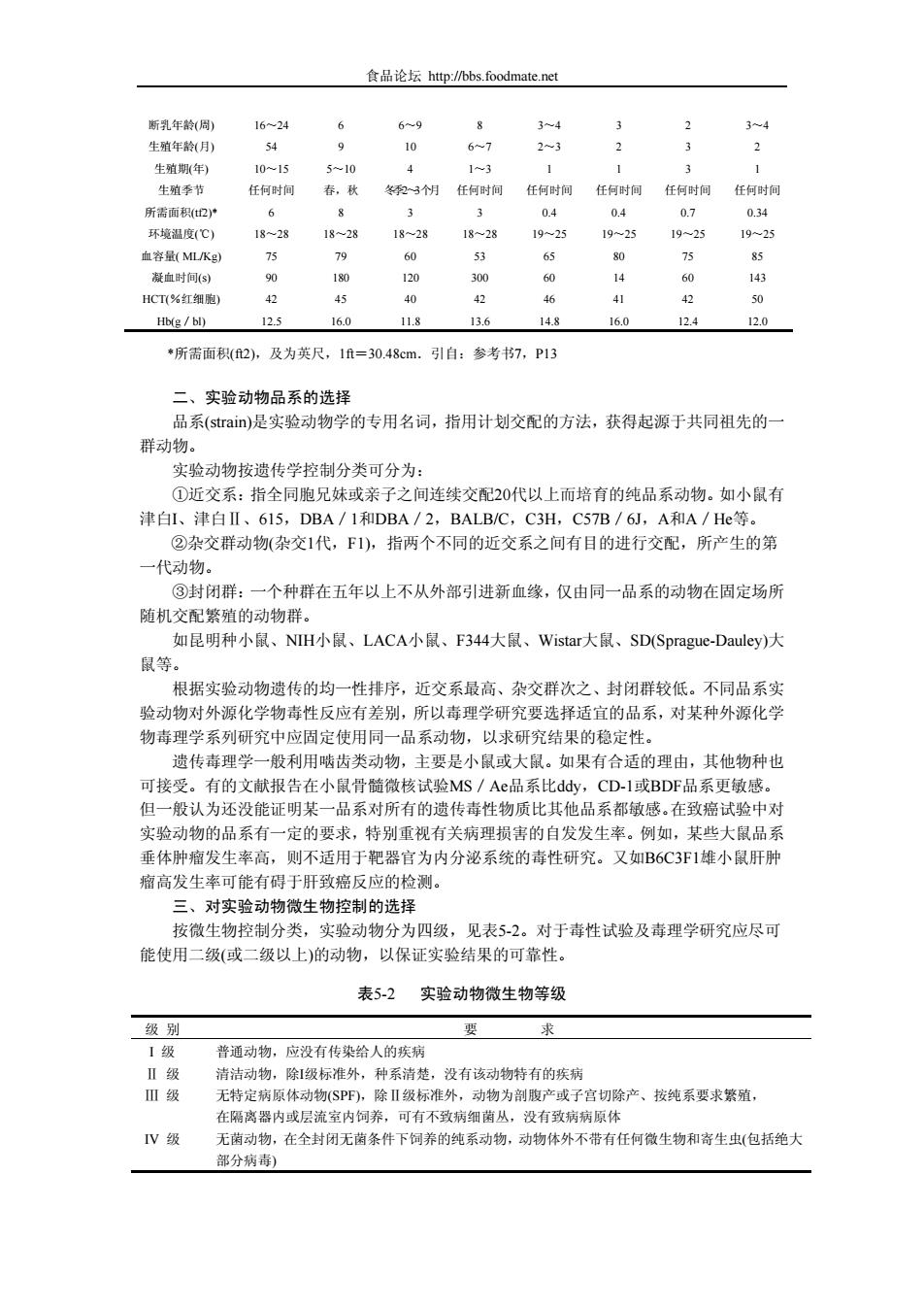
食品论坛 http://bbs.foodmate.net 断乳年龄(周) 16~24 6 6~9 8 3~4 3 2 3~4 生殖年龄(月) 54 9 10 6~7 2~3 2 3 2 生殖期(年) 10~15 5~10 4 1~3 1 1 3 1 生殖季节 任何时间 春,秋 冬季2~3个月 任何时间 任何时间 任何时间 任何时间 任何时间 所需面积(tf2)* 6 8 3 3 0.4 0.4 0.7 0.34 环境温度(℃) 18~28 18~28 18~28 18~28 19~25 19~25 19~25 19~25 血容量( ML/Kg) 75 79 60 53 65 80 75 85 凝血时间(s) 90 180 120 300 60 14 60 143 HCT(%红细胞) 42 45 40 42 46 41 42 50 Hb(g/bl) 12.5 16.0 11.8 13.6 14.8 16.0 12.4 12.0 *所需面积(ft2),及为英尺,1ft=30.48cm.引自:参考书7,P13 二、实验动物品系的选择 品系(strain)是实验动物学的专用名词,指用计划交配的方法,获得起源于共同祖先的一 群动物。 实验动物按遗传学控制分类可分为: ①近交系:指全同胞兄妹或亲子之间连续交配20代以上而培育的纯品系动物。如小鼠有 津白I、津白Ⅱ、615,DBA/1和DBA/2,BALB/C,C3H,C57B/6J,A和A/He等。 ②杂交群动物(杂交1代,F1),指两个不同的近交系之间有目的进行交配,所产生的第 一代动物。 ③封闭群:一个种群在五年以上不从外部引进新血缘,仅由同一品系的动物在固定场所 随机交配繁殖的动物群。 如昆明种小鼠、NIH小鼠、LACA小鼠、F344大鼠、Wistar大鼠、SD(Sprague-Dauley)大 鼠等。 根据实验动物遗传的均一性排序,近交系最高、杂交群次之、封闭群较低。不同品系实 验动物对外源化学物毒性反应有差别,所以毒理学研究要选择适宜的品系,对某种外源化学 物毒理学系列研究中应固定使用同一品系动物,以求研究结果的稳定性。 遗传毒理学一般利用啮齿类动物,主要是小鼠或大鼠。如果有合适的理由,其他物种也 可接受。有的文献报告在小鼠骨髓微核试验MS/Ae品系比ddy,CD-1或BDF品系更敏感。 但一般认为还没能证明某一品系对所有的遗传毒性物质比其他品系都敏感。在致癌试验中对 实验动物的品系有一定的要求,特别重视有关病理损害的自发发生率。例如,某些大鼠品系 垂体肿瘤发生率高,则不适用于靶器官为内分泌系统的毒性研究。又如B6C3F1雄小鼠肝肿 瘤高发生率可能有碍于肝致癌反应的检测。 三、对实验动物微生物控制的选择 按微生物控制分类,实验动物分为四级,见表5-2。对于毒性试验及毒理学研究应尽可 能使用二级(或二级以上)的动物,以保证实验结果的可靠性。 表5-2 实验动物微生物等级 级 别 要 求 I 级 Ⅱ 级 Ⅲ 级 IV 级 普通动物,应没有传染给人的疾病 清洁动物,除I级标准外,种系清楚,没有该动物特有的疾病 无特定病原体动物(SPF),除Ⅱ级标准外,动物为剖腹产或子宫切除产、按纯系要求繁殖, 在隔离器内或层流室内饲养,可有不致病细菌丛,没有致病病原体 无菌动物,在全封闭无菌条件下饲养的纯系动物,动物体外不带有任何微生物和寄生虫(包括绝大 部分病毒)
食品论坛 http://bbs.foodmate.net 断乳年龄(周) 16~24 6 6~9 8 3~4 3 2 3~4 生殖年龄(月) 54 9 10 6~7 2~3 2 3 2 生殖期(年) 10~15 5~10 4 1~3 1 1 3 1 生殖季节 任何时间 春,秋 冬季2~3个月 任何时间 任何时间 任何时间 任何时间 任何时间 所需面积(tf2)* 6 8 3 3 0.4 0.4 0.7 0.34 环境温度(℃) 18~28 18~28 18~28 18~28 19~25 19~25 19~25 19~25 血容量( ML/Kg) 75 79 60 53 65 80 75 85 凝血时间(s) 90 180 120 300 60 14 60 143 HCT(%红细胞) 42 45 40 42 46 41 42 50 Hb(g/bl) 12.5 16.0 11.8 13.6 14.8 16.0 12.4 12.0 *所需面积(ft2),及为英尺,1ft=30.48cm.引自:参考书7,P13 二、实验动物品系的选择 品系(strain)是实验动物学的专用名词,指用计划交配的方法,获得起源于共同祖先的一 群动物。 实验动物按遗传学控制分类可分为: ①近交系:指全同胞兄妹或亲子之间连续交配20代以上而培育的纯品系动物。如小鼠有 津白I、津白Ⅱ、615,DBA/1和DBA/2,BALB/C,C3H,C57B/6J,A和A/He等。 ②杂交群动物(杂交1代,F1),指两个不同的近交系之间有目的进行交配,所产生的第 一代动物。 ③封闭群:一个种群在五年以上不从外部引进新血缘,仅由同一品系的动物在固定场所 随机交配繁殖的动物群。 如昆明种小鼠、NIH小鼠、LACA小鼠、F344大鼠、Wistar大鼠、SD(Sprague-Dauley)大 鼠等。 根据实验动物遗传的均一性排序,近交系最高、杂交群次之、封闭群较低。不同品系实 验动物对外源化学物毒性反应有差别,所以毒理学研究要选择适宜的品系,对某种外源化学 物毒理学系列研究中应固定使用同一品系动物,以求研究结果的稳定性。 遗传毒理学一般利用啮齿类动物,主要是小鼠或大鼠。如果有合适的理由,其他物种也 可接受。有的文献报告在小鼠骨髓微核试验MS/Ae品系比ddy,CD-1或BDF品系更敏感。 但一般认为还没能证明某一品系对所有的遗传毒性物质比其他品系都敏感。在致癌试验中对 实验动物的品系有一定的要求,特别重视有关病理损害的自发发生率。例如,某些大鼠品系 垂体肿瘤发生率高,则不适用于靶器官为内分泌系统的毒性研究。又如B6C3F1雄小鼠肝肿 瘤高发生率可能有碍于肝致癌反应的检测。 三、对实验动物微生物控制的选择 按微生物控制分类,实验动物分为四级,见表5-2。对于毒性试验及毒理学研究应尽可 能使用二级(或二级以上)的动物,以保证实验结果的可靠性。 表5-2 实验动物微生物等级 级 别 要 求 I 级 Ⅱ 级 Ⅲ 级 IV 级 普通动物,应没有传染给人的疾病 清洁动物,除I级标准外,种系清楚,没有该动物特有的疾病 无特定病原体动物(SPF),除Ⅱ级标准外,动物为剖腹产或子宫切除产、按纯系要求繁殖, 在隔离器内或层流室内饲养,可有不致病细菌丛,没有致病病原体 无菌动物,在全封闭无菌条件下饲养的纯系动物,动物体外不带有任何微生物和寄生虫(包括绝大 部分病毒)

食品论坛 http://bbs.foodmate.net 四、个体选择 实验动物对外来化学物的毒性反应还存在个体差异,应注意实验动物的个体选择。 1. 性别 同一物种、同一品系的实验动物雌雄两性通常对相同外源化学物毒性反应类 似但雌雄两性对化学物的毒性敏感性上存在着差别。有文献报道在149种外源化学物中雌雄 敏感性比值小鼠平均为0.92,大鼠为0.88,这种差别表现在实验动物性发育成熟开始,直至 老年期。可见雌雄两性动物的性激素性质和水平是关键因素,一般讲雄性动物体内微粒体细 胞色素P-450酶系活性大于雌性动物,所以经该酶系降解解毒的外源化学物对雌性动物表现 的毒性大,然而经该酶活化增毒的外源化学物却相反。 如果已知不同性别的动物对受试物敏感性不同,应选择敏感的性别。如对性别差异不清 楚,则应选用雌雄两种性别。如实验中发现存在性别差异,则应将不同性别动物的实验结果 分别统计分析。 在遗传毒理学体内试验中,对性别的选择有几种意见: (1) 对单个物种应用两种性别。 (2) 对单个物种应用两种性别,除非已在一个性别得到阳性反应,就不必对另一种性别 进行试验。 (3) 对单个物种应用两种性别,除非经毒代动力学研究证明受试物(和其代谢产物)在雄 性和雌性无差别和/或如果在确定剂量的预试验证明有相等毒性。此假定在非遗传毒性与遗 传毒性之间有相关。 (4) 对单个物种常规用一种性别(雄性或雌性),除非预期/证明存在性别差异。由于历 史的原因UDS体内/体外试验常规用雄性大鼠。 一般来说,对于初次试验的受试物,应该采用两种性别。对大鼠和小鼠各一种性别进行 试验可能比单个物种两种性别提供更好的危害鉴定,但这需要更多的资料来证明。 2. 年龄和体重 实验动物同人类一样,生命全程大体上可区分三个阶段,即幼年期(从 出生到性成熟之前)、成年期和老年期。在成年期,各种激素(包括性激素)、代谢酶都处于高 峰稳定期,并对外源化学物的毒性反应差异较小,且有代表性。在幼年期和老年期,对外源 化学物的生物转运和生物转化,靶器官和受体的敏感性均与成年期不同。如有报道外源化学 物对成年动物的致死剂量(或LD50)与新生动物比较,其比值在0.002~16之间,表明有的外源 化学物对新生动物毒性低,也有的毒性反应强。毒理学试验选用实验动物的年龄取决于试验 的类型。急性试验一般选用成年动物;慢性试验因实验周期长,应选用较年幼的或初断乳的 动物,以使实验周期能复盖成年期。实验动物的年龄应由其出生日期来定,但实际工作中常 以动物的体重粗略地判断动物的年龄,作为挑选适龄动物的依据。同一试验中,组内个体间 体重差异应小于10%,各组间平均体重差异不应超过5%。 3. 生理状态 在毒理学试验中动物如出现妊娠,则影响体重及其他指标的检测结果, 并且,性激素对外源化学物代谢转化有影响,故应选用未产未孕的雌性动物。雌雄动物应分 笼饲养。但在某些试验如显性致死试验、致畸试验及繁殖试验等,则需有计划地合笼交配。 4. 健康状况 实验动物的健康状态对毒理学试验结果有很大的影响,因此应选用健康 动物。对于实验动物微生物控制的选择实际上是选择健康状况的一个重要指标,健康个体的 选择还包括了其他方面。健康动物应发育正常、体形健壮,无外观畸形,被毛浓密、有光泽、 顺贴而不蓬乱,行动灵活、反应敏捷,眼睛明亮有神,表皮无溃疡和结痴,天然孔道干净无 分泌物等。 为确保选择健康动物,一般在实验前观察5~7天。对于大鼠和狗的亚慢性和慢性试验, 可在实验前采血进行血液学和血液生化学检查,异常的动物应剔除;对狗应常规驱除肠道寄 生虫。 合理的全营养饲料对维持实验动物健康和正常的生理活动是至关重要的。高温与低温时
食品论坛 http://bbs.foodmate.net 四、个体选择 实验动物对外来化学物的毒性反应还存在个体差异,应注意实验动物的个体选择。 1. 性别 同一物种、同一品系的实验动物雌雄两性通常对相同外源化学物毒性反应类 似但雌雄两性对化学物的毒性敏感性上存在着差别。有文献报道在149种外源化学物中雌雄 敏感性比值小鼠平均为0.92,大鼠为0.88,这种差别表现在实验动物性发育成熟开始,直至 老年期。可见雌雄两性动物的性激素性质和水平是关键因素,一般讲雄性动物体内微粒体细 胞色素P-450酶系活性大于雌性动物,所以经该酶系降解解毒的外源化学物对雌性动物表现 的毒性大,然而经该酶活化增毒的外源化学物却相反。 如果已知不同性别的动物对受试物敏感性不同,应选择敏感的性别。如对性别差异不清 楚,则应选用雌雄两种性别。如实验中发现存在性别差异,则应将不同性别动物的实验结果 分别统计分析。 在遗传毒理学体内试验中,对性别的选择有几种意见: (1) 对单个物种应用两种性别。 (2) 对单个物种应用两种性别,除非已在一个性别得到阳性反应,就不必对另一种性别 进行试验。 (3) 对单个物种应用两种性别,除非经毒代动力学研究证明受试物(和其代谢产物)在雄 性和雌性无差别和/或如果在确定剂量的预试验证明有相等毒性。此假定在非遗传毒性与遗 传毒性之间有相关。 (4) 对单个物种常规用一种性别(雄性或雌性),除非预期/证明存在性别差异。由于历 史的原因UDS体内/体外试验常规用雄性大鼠。 一般来说,对于初次试验的受试物,应该采用两种性别。对大鼠和小鼠各一种性别进行 试验可能比单个物种两种性别提供更好的危害鉴定,但这需要更多的资料来证明。 2. 年龄和体重 实验动物同人类一样,生命全程大体上可区分三个阶段,即幼年期(从 出生到性成熟之前)、成年期和老年期。在成年期,各种激素(包括性激素)、代谢酶都处于高 峰稳定期,并对外源化学物的毒性反应差异较小,且有代表性。在幼年期和老年期,对外源 化学物的生物转运和生物转化,靶器官和受体的敏感性均与成年期不同。如有报道外源化学 物对成年动物的致死剂量(或LD50)与新生动物比较,其比值在0.002~16之间,表明有的外源 化学物对新生动物毒性低,也有的毒性反应强。毒理学试验选用实验动物的年龄取决于试验 的类型。急性试验一般选用成年动物;慢性试验因实验周期长,应选用较年幼的或初断乳的 动物,以使实验周期能复盖成年期。实验动物的年龄应由其出生日期来定,但实际工作中常 以动物的体重粗略地判断动物的年龄,作为挑选适龄动物的依据。同一试验中,组内个体间 体重差异应小于10%,各组间平均体重差异不应超过5%。 3. 生理状态 在毒理学试验中动物如出现妊娠,则影响体重及其他指标的检测结果, 并且,性激素对外源化学物代谢转化有影响,故应选用未产未孕的雌性动物。雌雄动物应分 笼饲养。但在某些试验如显性致死试验、致畸试验及繁殖试验等,则需有计划地合笼交配。 4. 健康状况 实验动物的健康状态对毒理学试验结果有很大的影响,因此应选用健康 动物。对于实验动物微生物控制的选择实际上是选择健康状况的一个重要指标,健康个体的 选择还包括了其他方面。健康动物应发育正常、体形健壮,无外观畸形,被毛浓密、有光泽、 顺贴而不蓬乱,行动灵活、反应敏捷,眼睛明亮有神,表皮无溃疡和结痴,天然孔道干净无 分泌物等。 为确保选择健康动物,一般在实验前观察5~7天。对于大鼠和狗的亚慢性和慢性试验, 可在实验前采血进行血液学和血液生化学检查,异常的动物应剔除;对狗应常规驱除肠道寄 生虫。 合理的全营养饲料对维持实验动物健康和正常的生理活动是至关重要的。高温与低温时

食品论坛 http://bbs.foodmate.net 外源化学物的毒性一般比常温为高。气温升高而毒性增大,这种毒性变化可能是由于温度影 响了毒物动力学所致。高温、高湿环境共存时皮肤更易于外源化学物经皮肤吸收。 人工昼夜周期,即使动物处于人工调控的12小时白昼(早6点至晚6点)及12小时黑夜(晚6 点至次日早6点),以稳定其生物时间节律。在正常、健康的动物每天24小时的生理规律不尽 相同,即存在着生物时间节律,对外源化学物的毒性反应也有昼夜性时间变化,因此出现毒 理学新的分支学科,称为时间毒理学(Chronotoxicology)。由于动物存在时间节律,外源化学 物在不同时间表现的毒性反应有差别,所以在毒理学实际工作中,尤其是进行亚慢性和慢性 染毒时,每日的染毒时间应固定一致,以防止出现时间毒性的影响。而且采取动物生物样品 (如血、尿等)进行各种指标的化验或一些生理功能的检查(如血压、体温等)也应固定时间。 根据我国的法规和有关规定,国家实行实验动物的质量监督和质量合格证制度。实验动 物的保种、饲育、供应和应用单位,由各级医学动物管理委员会进行定期监督、监测,并颁 发实验动物和实验设施的合格证书(有效期5年)。应用的实验动物必须有完整的资料。进行 动物实验的人员应经培训,取得资格认可(上岗证)。实验动物的饲养设施、环境条件及饲料 等必须符合有关的国家标准。 第四节 食品毒理学试验设计要点 一、体内毒理学试验设计 1. 剂量分组 在毒理学试验中,最重要的就是研究剂量-反应(效应)关系,也就是当外 源化学物染毒剂量增加,实验动物的毒性反应(效应)随之而增强。剂量-反应(效应)关系的存 在是确定外源化学物与有害作用的因果关系的重要依据,也可证明实验结果的可靠性。因此, 在毒理学试验中,一般至少要设3个剂量组(即高剂量组、中剂量组、低剂量组),希望能得 到满意的剂量-反应(效应)关系。 一般要求,高剂量组应出现明确的有害作用,或者高剂量组剂量已达到染毒的极限剂量 (如大鼠或小鼠灌胃或注射的最大容量)。低剂量组应不出现任何可观察到的有害作用(即相当 于NOAEL),但低剂量组剂量应当高于人可能的接触剂量,至少等于人可能的接触剂量。中 剂量组的剂量介于高剂量组和低剂量组之间,应出现轻微的毒性效应(即相当于LOAEL)。高、 中、低剂量组剂量一般按等比例计算,剂量间距应为2或 10 ,低剂量组剂量一般为高剂量 组剂量的1/10~1/20。 急性毒性试验分组和剂量选择见下一章。亚慢性毒性试验的高剂量应该用急性毒性的 LD50的某个分数或LD01。在长期或致癌试验,最高剂量选择为由亚慢性毒性试验确定的最大 耐受剂量(MTD),毒动学或代谢资料可能有助于决定剂量,特别是有受试物或其代谢产物的 蓄积或有剂量依赖性解毒改变的证据。有人认为,在新药安全性评价中,试验期限等于或小 于14天,限度剂量为2g/(kg·d);如大于14天限度剂量为1g/(kg、d)。在无毒性情况下, 对限度剂量的例外是基于该途径的最大染毒容量。 毒理学试验常用的对照有4种: (1) 未处理对照组(以前有称为空白对照组):即对照组不施加任何处理因素,不给受试 物也不给以相应的操作。未处理对照组往往用于遗传毒理学试验中,确定指示生物的生物学 特征的本底值,进行质量控制。 (2) 阴性(溶剂/赋形剂)对照:不给处理因素但给以必须的实验因素(溶剂/赋形剂),以 排除此实验因素(溶剂/赋形剂)的影响,阴性对照作为与染毒组比较的基础。没有阴性对照 组就不能说明受试物染毒与有害作用之间的关系。例如,在实验中,染毒各剂量组实验动物 出现某些异常、甚至死亡;如果阴性对照组没有发现异常,我们可以认为此种异常和死亡是 由于受试物的毒作用;如果阴性对照组也出现同样的异常和死亡,则应考虑是由于实验动物
食品论坛 http://bbs.foodmate.net 外源化学物的毒性一般比常温为高。气温升高而毒性增大,这种毒性变化可能是由于温度影 响了毒物动力学所致。高温、高湿环境共存时皮肤更易于外源化学物经皮肤吸收。 人工昼夜周期,即使动物处于人工调控的12小时白昼(早6点至晚6点)及12小时黑夜(晚6 点至次日早6点),以稳定其生物时间节律。在正常、健康的动物每天24小时的生理规律不尽 相同,即存在着生物时间节律,对外源化学物的毒性反应也有昼夜性时间变化,因此出现毒 理学新的分支学科,称为时间毒理学(Chronotoxicology)。由于动物存在时间节律,外源化学 物在不同时间表现的毒性反应有差别,所以在毒理学实际工作中,尤其是进行亚慢性和慢性 染毒时,每日的染毒时间应固定一致,以防止出现时间毒性的影响。而且采取动物生物样品 (如血、尿等)进行各种指标的化验或一些生理功能的检查(如血压、体温等)也应固定时间。 根据我国的法规和有关规定,国家实行实验动物的质量监督和质量合格证制度。实验动 物的保种、饲育、供应和应用单位,由各级医学动物管理委员会进行定期监督、监测,并颁 发实验动物和实验设施的合格证书(有效期5年)。应用的实验动物必须有完整的资料。进行 动物实验的人员应经培训,取得资格认可(上岗证)。实验动物的饲养设施、环境条件及饲料 等必须符合有关的国家标准。 第四节 食品毒理学试验设计要点 一、体内毒理学试验设计 1. 剂量分组 在毒理学试验中,最重要的就是研究剂量-反应(效应)关系,也就是当外 源化学物染毒剂量增加,实验动物的毒性反应(效应)随之而增强。剂量-反应(效应)关系的存 在是确定外源化学物与有害作用的因果关系的重要依据,也可证明实验结果的可靠性。因此, 在毒理学试验中,一般至少要设3个剂量组(即高剂量组、中剂量组、低剂量组),希望能得 到满意的剂量-反应(效应)关系。 一般要求,高剂量组应出现明确的有害作用,或者高剂量组剂量已达到染毒的极限剂量 (如大鼠或小鼠灌胃或注射的最大容量)。低剂量组应不出现任何可观察到的有害作用(即相当 于NOAEL),但低剂量组剂量应当高于人可能的接触剂量,至少等于人可能的接触剂量。中 剂量组的剂量介于高剂量组和低剂量组之间,应出现轻微的毒性效应(即相当于LOAEL)。高、 中、低剂量组剂量一般按等比例计算,剂量间距应为2或 10 ,低剂量组剂量一般为高剂量 组剂量的1/10~1/20。 急性毒性试验分组和剂量选择见下一章。亚慢性毒性试验的高剂量应该用急性毒性的 LD50的某个分数或LD01。在长期或致癌试验,最高剂量选择为由亚慢性毒性试验确定的最大 耐受剂量(MTD),毒动学或代谢资料可能有助于决定剂量,特别是有受试物或其代谢产物的 蓄积或有剂量依赖性解毒改变的证据。有人认为,在新药安全性评价中,试验期限等于或小 于14天,限度剂量为2g/(kg·d);如大于14天限度剂量为1g/(kg、d)。在无毒性情况下, 对限度剂量的例外是基于该途径的最大染毒容量。 毒理学试验常用的对照有4种: (1) 未处理对照组(以前有称为空白对照组):即对照组不施加任何处理因素,不给受试 物也不给以相应的操作。未处理对照组往往用于遗传毒理学试验中,确定指示生物的生物学 特征的本底值,进行质量控制。 (2) 阴性(溶剂/赋形剂)对照:不给处理因素但给以必须的实验因素(溶剂/赋形剂),以 排除此实验因素(溶剂/赋形剂)的影响,阴性对照作为与染毒组比较的基础。没有阴性对照 组就不能说明受试物染毒与有害作用之间的关系。例如,在实验中,染毒各剂量组实验动物 出现某些异常、甚至死亡;如果阴性对照组没有发现异常,我们可以认为此种异常和死亡是 由于受试物的毒作用;如果阴性对照组也出现同样的异常和死亡,则应考虑是由于实验动物

食品论坛 http://bbs.foodmate.net 患某种传染病或其他非实验因素所致,必须重新进行实验。 (3) 阳性对照:用已知的阳性物(如致突变物)检测试验体系的有效性。阳性对照组最好 与受试物用相同的溶剂、染毒途径及采样时间。在遗传毒理学试验、致畸试验和致癌试验中 都使用了阳性对照组,阳性对照组是用已知的致突变物、致畸物或致癌物染毒,应该得到肯 定的阳性结果(即致突变性、致畸性或致癌性)。这是由于这些试验,特别是遗传毒理学试验 的变异较大,为了进行质量控制而设置阳性对照组。当同时进行的阴性(溶剂/赋形剂)对照 组不能得到阴性结果,阳性对照组不能得到阳性结果,说明此次实验质量有问题,全部数据 无效,必须重新实验。在遗传毒理学试验中,阳性对照与受试物应该用同样的途径和溶剂/ 赋形剂,但如有困难,则不同的染毒途径、不同溶剂/赋形剂也可以接受。 (4) 历史性对照:由本实验室过去多次实验的对照组数据组成,上述三种对照都可构成 相应的历史对照。历史对照的最好用途是通过同质性检验检查试验体系的稳定性,即进行实 验室质量控制和保证。由于实验毒理学的各种参数至今尚没有公认的参考值,因此历史性对 照均值及其范围在评价研究结果时至为重要。 以上所述适用于大多数的毒理学体内试验。在急性毒性试验测定LD50或LC50时,剂量组 数根据选用的设计和统计学方法而定,可以是4组,也可以是5~7组。根据预实验结果,希 望所设计的中间剂量组的剂量与最后得到的LD50(LC50)接近。由于急性毒性试验的观察指标 是死亡,并伴有严重的中毒症状,对于有经验的实验者可以不设阴性对照组。当然,如果使 用了一种不常用的溶剂或者要测定某种其他的参数如MTD、急性LOAEL和NOAEL,则需要 设置阴性对照组。 2. 各组动物数 毒理学安全性评价试验各组动物数取决于很多因素,如实验目的和设 计,要求的敏感度、实验动物的寿命、生殖能力,经济的考虑及动物的可利用性。各组动物 数的设计应考虑到统计学的要求。对各种常规毒性试验的动物数要求,见以后有关章节。 3. 试验期限 某些试验(如致畸试验和多代生殖试验)的试验期限是由受试实验动物物 种或品系而决定的。而其他毒性试验的期限在某种程度上由定义所决定。如急性毒性是一次 或1天内多次染毒观察14天,亚慢性毒性试验规定为染毒持续至实验动物寿命的10%,对大 鼠和小鼠为90天,对狗应为1年。慢性毒性试验/致癌试验一般规定为持续至实验动物寿命 的大部分。又可分为两类,即规定试验期限的试验,或直到最敏感的组死亡率达到某一水平 (通常为80%)的试验。 二、体外毒理学试验设计 此处简要讨论在遗传毒理学体外试验共同考虑的几个问题。 1.测定受试物溶解性 应该测定受试物在试验介质中的溶解性。已注意到在试验系统 暴露期内,受试物的溶解性可能改变,因为存在细胞、S9、血清等。因此,在试验开始和 结束时评价溶解性是有意义的。溶解性限度就是出现沉淀的最低浓度。 2.试验最高剂量的推荐 对可溶性受试物浓度高于10mmol/L时可因高渗透压在哺乳动 物细胞引起损伤或人工假象,对细菌则无此影响。由于受试物的分子量并不一定知道(如聚 合物或混合物),因此,在大多数情况下,可溶性受试物的试验上限应该是:(1)对哺乳动物 细胞为10mmol/L或5mg/ml。(2)对细菌试验为5mg/平板。当受试物供应困难或非常昂贵(如生 物药剂),最高剂量低于10mmol/L或5mg/ml(或/平扳)是可以接受的。 对不溶性受试物最高浓度的推荐有争论,日本学者的资料表明,有的受试物仅在沉淀剂 量于细菌试验和染色体畸变试验中出现遗传毒性。哺乳动物细胞具有吞噬作用,细菌不具有 吞噬作用。一般认为无毒性的可溶于适当的溶剂而不溶于实验培养液(介质)中的受试物,最 高浓度应是溶解性限制(即产生沉淀的最低浓度),但不应干扰终点的计数。 对于有毒性的受试物,最高浓度在细菌试验中应该是明显显示毒性的剂量,对哺乳动物 细胞试验最高剂量,基因突变试验应达到10%~20%存活率,而染色体畸变和UBS试验应达
食品论坛 http://bbs.foodmate.net 患某种传染病或其他非实验因素所致,必须重新进行实验。 (3) 阳性对照:用已知的阳性物(如致突变物)检测试验体系的有效性。阳性对照组最好 与受试物用相同的溶剂、染毒途径及采样时间。在遗传毒理学试验、致畸试验和致癌试验中 都使用了阳性对照组,阳性对照组是用已知的致突变物、致畸物或致癌物染毒,应该得到肯 定的阳性结果(即致突变性、致畸性或致癌性)。这是由于这些试验,特别是遗传毒理学试验 的变异较大,为了进行质量控制而设置阳性对照组。当同时进行的阴性(溶剂/赋形剂)对照 组不能得到阴性结果,阳性对照组不能得到阳性结果,说明此次实验质量有问题,全部数据 无效,必须重新实验。在遗传毒理学试验中,阳性对照与受试物应该用同样的途径和溶剂/ 赋形剂,但如有困难,则不同的染毒途径、不同溶剂/赋形剂也可以接受。 (4) 历史性对照:由本实验室过去多次实验的对照组数据组成,上述三种对照都可构成 相应的历史对照。历史对照的最好用途是通过同质性检验检查试验体系的稳定性,即进行实 验室质量控制和保证。由于实验毒理学的各种参数至今尚没有公认的参考值,因此历史性对 照均值及其范围在评价研究结果时至为重要。 以上所述适用于大多数的毒理学体内试验。在急性毒性试验测定LD50或LC50时,剂量组 数根据选用的设计和统计学方法而定,可以是4组,也可以是5~7组。根据预实验结果,希 望所设计的中间剂量组的剂量与最后得到的LD50(LC50)接近。由于急性毒性试验的观察指标 是死亡,并伴有严重的中毒症状,对于有经验的实验者可以不设阴性对照组。当然,如果使 用了一种不常用的溶剂或者要测定某种其他的参数如MTD、急性LOAEL和NOAEL,则需要 设置阴性对照组。 2. 各组动物数 毒理学安全性评价试验各组动物数取决于很多因素,如实验目的和设 计,要求的敏感度、实验动物的寿命、生殖能力,经济的考虑及动物的可利用性。各组动物 数的设计应考虑到统计学的要求。对各种常规毒性试验的动物数要求,见以后有关章节。 3. 试验期限 某些试验(如致畸试验和多代生殖试验)的试验期限是由受试实验动物物 种或品系而决定的。而其他毒性试验的期限在某种程度上由定义所决定。如急性毒性是一次 或1天内多次染毒观察14天,亚慢性毒性试验规定为染毒持续至实验动物寿命的10%,对大 鼠和小鼠为90天,对狗应为1年。慢性毒性试验/致癌试验一般规定为持续至实验动物寿命 的大部分。又可分为两类,即规定试验期限的试验,或直到最敏感的组死亡率达到某一水平 (通常为80%)的试验。 二、体外毒理学试验设计 此处简要讨论在遗传毒理学体外试验共同考虑的几个问题。 1.测定受试物溶解性 应该测定受试物在试验介质中的溶解性。已注意到在试验系统 暴露期内,受试物的溶解性可能改变,因为存在细胞、S9、血清等。因此,在试验开始和 结束时评价溶解性是有意义的。溶解性限度就是出现沉淀的最低浓度。 2.试验最高剂量的推荐 对可溶性受试物浓度高于10mmol/L时可因高渗透压在哺乳动 物细胞引起损伤或人工假象,对细菌则无此影响。由于受试物的分子量并不一定知道(如聚 合物或混合物),因此,在大多数情况下,可溶性受试物的试验上限应该是:(1)对哺乳动物 细胞为10mmol/L或5mg/ml。(2)对细菌试验为5mg/平板。当受试物供应困难或非常昂贵(如生 物药剂),最高剂量低于10mmol/L或5mg/ml(或/平扳)是可以接受的。 对不溶性受试物最高浓度的推荐有争论,日本学者的资料表明,有的受试物仅在沉淀剂 量于细菌试验和染色体畸变试验中出现遗传毒性。哺乳动物细胞具有吞噬作用,细菌不具有 吞噬作用。一般认为无毒性的可溶于适当的溶剂而不溶于实验培养液(介质)中的受试物,最 高浓度应是溶解性限制(即产生沉淀的最低浓度),但不应干扰终点的计数。 对于有毒性的受试物,最高浓度在细菌试验中应该是明显显示毒性的剂量,对哺乳动物 细胞试验最高剂量,基因突变试验应达到10%~20%存活率,而染色体畸变和UBS试验应达

食品论坛 http://bbs.foodmate.net 到50%存活率。 对于没有适当溶剂,完全不溶的受试物,则可以按5mg/平板或10mmol/L(5mg/ml)进行 实验以检测杂质的致突变性。或者,采用生理盐水提取物进行实验。 3. 代谢活化 代谢活化常规使用Aroclor 1254(多氯联苯1254)预处理的雄性成年大鼠 肝匀浆90000g离心上清液(S9),及相应的辅因子(NADPH再生系统)。由于各国禁用限用多氯 联苯,可用苯巴比妥和β-萘黄酮联合诱导制备S9(El1iott,1992)。对体外哺乳动物细胞试验, 还可利用大鼠肝原代培养细胞等作为代谢活化系统。 4. 阳性对照 阳性对照的剂量应选择其剂量-反应的直线部分,并且构成历史性资料(历 史性对照),并以其作为实验质量控制的措施之一 5. 重复 由质控良好的实验得到明确的阴性结果和阳性结果,不强调要求重复。可疑 结果则应重复实验,最好改变剂量范围/剂量间隔、改变S9浓度或改变实验方法进行重复。 第五节 实验动物的柒毒和处置 本节简要介绍在动物实验前的实验动物准备、受试物的准备、染毒途径和方法、动物处 死和生物标本采集的基本内容,详细的方法和步骤请查阅有关的毒理学实验方法专著。 一、动物实验前的准备 实验动物在购进之后,应雌雄分开饲养。一般应进行5~7天的检疫,在此期间应多次观 察动物,及时剔除不健康的动物。观察期结束,将实验动物按实验设计的要求进行标记和分 组。 实验动物的标记方法对啮齿动物常用染色法,可用苦味酸(黄色)、品红(红色)的酒精饱 和溶液在动物被毛上染色,不同的颜色和染色部位表示不同的编号,可标出1~99号。由于 被毛上颜色会逐步消失,故需重复染色。对啮齿动物还可用剪耳法标记。对狗等大动物一般 用挂牌法。 实验动物分组的原则要求所有的动物分配到各剂量组和对照组的机会均等,避免主观选 择倾向,减少偏性,以保证结果的准确可靠。正确的分组方法是随机分组。实验动物按性别、 体重顺序编号,然后利用统计学的随机数字表,按完全随机分组法或配伍组随机分组法,将 实验动物分配到各剂量组和对照组。然后应计算各组实验动物体重的均值和标准差,必要时 可将实验动物适当调组,以使各组实验动物体重的均值的差别不超过允许范围。 二、受试物和样品的准备 应了解受试物的纯度及杂质成分,了解受试物的化学结构和理化性质,特别是其挥发性 和溶解性。查阅文献,检索与受试物化学结构和理化性质相似的化合物的毒性资料,以作参 考。对各个毒理学试验应该用同一种、同一批号受试物。受试物成分和配方必须固定。如是 异构体混合物,异构体比例必须固定。活性成分的百分含量和可检测的杂质的浓度也应固定。 受试物在贮存期内稳定性和在饲料中的稳定性必须进行研究并报告。受试物应一次备齐全部 实验的用量。 所需受试物总量=(A×B×C×D)×1.2 式中:A为每组动物数;B为各处理组的剂量和(如0.1+0.3+1.0mg/kg=1.4mg/kg);C为染 毒次数(通常为天);D为动物的平均体重;1.2为安全因子,防止损耗。 染毒前根据染毒途径的不同,应将受试物制备成一定的剂型。常用的是制备成水溶液、 油溶液或混悬液。对溶剂和助溶剂的要求是,所用的溶剂或助溶剂应该是无毒的,与受试物 不起反应,受试物在溶液中应稳定。对水溶性受试物,体内试验适当的溶剂为水(经口染毒) 和等渗盐水(胃肠道外染毒)。水不溶性受试物应溶于或悬浮于适当的有机溶剂中。天然植物 油(如玉米油,橄榄油)可以用作为溶剂,有两个缺点,即不可能保证得到成分完全一致的植
食品论坛 http://bbs.foodmate.net 到50%存活率。 对于没有适当溶剂,完全不溶的受试物,则可以按5mg/平板或10mmol/L(5mg/ml)进行 实验以检测杂质的致突变性。或者,采用生理盐水提取物进行实验。 3. 代谢活化 代谢活化常规使用Aroclor 1254(多氯联苯1254)预处理的雄性成年大鼠 肝匀浆90000g离心上清液(S9),及相应的辅因子(NADPH再生系统)。由于各国禁用限用多氯 联苯,可用苯巴比妥和β-萘黄酮联合诱导制备S9(El1iott,1992)。对体外哺乳动物细胞试验, 还可利用大鼠肝原代培养细胞等作为代谢活化系统。 4. 阳性对照 阳性对照的剂量应选择其剂量-反应的直线部分,并且构成历史性资料(历 史性对照),并以其作为实验质量控制的措施之一 5. 重复 由质控良好的实验得到明确的阴性结果和阳性结果,不强调要求重复。可疑 结果则应重复实验,最好改变剂量范围/剂量间隔、改变S9浓度或改变实验方法进行重复。 第五节 实验动物的柒毒和处置 本节简要介绍在动物实验前的实验动物准备、受试物的准备、染毒途径和方法、动物处 死和生物标本采集的基本内容,详细的方法和步骤请查阅有关的毒理学实验方法专著。 一、动物实验前的准备 实验动物在购进之后,应雌雄分开饲养。一般应进行5~7天的检疫,在此期间应多次观 察动物,及时剔除不健康的动物。观察期结束,将实验动物按实验设计的要求进行标记和分 组。 实验动物的标记方法对啮齿动物常用染色法,可用苦味酸(黄色)、品红(红色)的酒精饱 和溶液在动物被毛上染色,不同的颜色和染色部位表示不同的编号,可标出1~99号。由于 被毛上颜色会逐步消失,故需重复染色。对啮齿动物还可用剪耳法标记。对狗等大动物一般 用挂牌法。 实验动物分组的原则要求所有的动物分配到各剂量组和对照组的机会均等,避免主观选 择倾向,减少偏性,以保证结果的准确可靠。正确的分组方法是随机分组。实验动物按性别、 体重顺序编号,然后利用统计学的随机数字表,按完全随机分组法或配伍组随机分组法,将 实验动物分配到各剂量组和对照组。然后应计算各组实验动物体重的均值和标准差,必要时 可将实验动物适当调组,以使各组实验动物体重的均值的差别不超过允许范围。 二、受试物和样品的准备 应了解受试物的纯度及杂质成分,了解受试物的化学结构和理化性质,特别是其挥发性 和溶解性。查阅文献,检索与受试物化学结构和理化性质相似的化合物的毒性资料,以作参 考。对各个毒理学试验应该用同一种、同一批号受试物。受试物成分和配方必须固定。如是 异构体混合物,异构体比例必须固定。活性成分的百分含量和可检测的杂质的浓度也应固定。 受试物在贮存期内稳定性和在饲料中的稳定性必须进行研究并报告。受试物应一次备齐全部 实验的用量。 所需受试物总量=(A×B×C×D)×1.2 式中:A为每组动物数;B为各处理组的剂量和(如0.1+0.3+1.0mg/kg=1.4mg/kg);C为染 毒次数(通常为天);D为动物的平均体重;1.2为安全因子,防止损耗。 染毒前根据染毒途径的不同,应将受试物制备成一定的剂型。常用的是制备成水溶液、 油溶液或混悬液。对溶剂和助溶剂的要求是,所用的溶剂或助溶剂应该是无毒的,与受试物 不起反应,受试物在溶液中应稳定。对水溶性受试物,体内试验适当的溶剂为水(经口染毒) 和等渗盐水(胃肠道外染毒)。水不溶性受试物应溶于或悬浮于适当的有机溶剂中。天然植物 油(如玉米油,橄榄油)可以用作为溶剂,有两个缺点,即不可能保证得到成分完全一致的植

食品论坛 http://bbs.foodmate.net 物油,植物油中的抗氧化剂成分等可影响受试物的毒性/遗传毒性。二甲基亚矾(DMSO)不 适用于体内实验,因其毒性较高,并且溶于DMSO的受试物在染毒后出现沉淀。 新药安全性评价推荐混悬液赋形剂为0.5%羧甲基纤维素钠或10%阿拉伯树胶;受试物 溶液应新鲜配制,除非已证明贮存稳定。其他的剂型见下文染毒途径的介绍。 外源化学物用溶剂稀释,一般讲浓溶液比稀溶液毒性大,但是也有的外源化学物稀释之 后毒性反而增加,即存在所谓“稀释毒性”,其原因尚不清楚。 在准备染毒制剂时的要点:①在准备制剂时加热受试物不应接近改变其化学性质或物理 性质的温度。②如受试物为固体,并且评价其对皮肤的毒性,应保持其形状和颗粒大小。③ 多成分的受试物(混合物)应按配方配制,以使染毒制剂准确地反映原混合物(即其成分不应被 选择性地悬浮或溶解)。④制剂应保持化学稳定性和受试物的一致性。⑤制剂应减少总试验 容积,利用溶剂或赋形剂的量不应过多。⑥制剂应易于准确染毒。⑦如可能,制剂pH应为5~ 9。⑧不应用酸或碱使受试物解离(基于保护动物的原因,并避免改变肠道或肾小管内的PH)。 ⑨如果应用非胃肠道途径,终溶液应尽可能接近等渗。 对于各种染毒途径的最大容积,以受试的实验动物物种或制剂来确定。一般规定,染毒 最大容积为:①经口20ml/kg(对空腹动物);②经皮2ml/kg(根据体表面积计算,限于染毒的准 确性);③静脉1ml/kg(5分钟以上);④肌肉注射0.5ml/kg(一个部位);⑤每眼0.01ml;⑥直肠 0.5ml/kg;⑦阴道:大鼠0.2m1,兔1ml;⑧吸人2mg/L;⑨鼻:猴或狗每鼻孔0.1ml。染毒的 通常容积(最大容积):大鼠灌胃为1.0(3.0)ml/100g体重(BW),静注为0.5(3.0)ml/100g BW ; 小鼠灌胃为0.2(1.0)ml/20g B W,静注为0.2(0.5)ml/20g Bw;狗灌胃为50(100)ml/10 kg Bw, 静注为30(50)ml/10 kg BW。各种规范可能有不同的规定,应按规定进行。 三、染毒途径 毒理学试验中染毒途径的选择,应尽可能模拟人在接触该受试物的方式。最常用的染毒 途径为经口、经呼吸道、经皮及注射途径。不同途径的吸收速率,一般是:静脉注射>吸入 >肌肉注射>腹腔注射>皮下注射>经口>皮内注射>其他途径(如经皮等)。 1. 经口(胃肠道)染毒 常用有灌胃、喂饲和吞咽胶囊等方式。 (1) 灌胃:将受试物配制成溶液或混悬液,以注射器经导管注入胃内。一般灌胃深度从 口至剑突下,最好是利用等容量灌胃法,即受试物配制成不同浓度,实验动物单位体重的灌 胃容量相同。大鼠隔夜禁食,小鼠可禁食4小时(因小鼠消化吸收和代谢速度较快),均不停 饮水。灌胃后2~4小时提供饲料。经口多次染毒,一般不禁食,但应每日定时染毒。灌胃法 优点是剂量准确,缺点是工作量大,并有伤及食道或误入气管的可能。 (2) 吞咽胶囊:将一定剂量的受试物装入胶囊中,放至狗的舌后部,迫使动物咽下,此 法剂量准确,适用于易挥发、易水解和有异味的受试物。 (3) 喂饲:将受试物掺入动物饲料或饮水中供实验动物自行摄入。饲料中掺入受试物不 应超过5%,以免造成饲料营养成分改变而影响实验动物的生长发育。喂饲法符合人类接触 受试物的实际情况,但缺点多,如适口性差的受试物,实验动物拒食;易挥发或易水解的受 试物不适用。而且,实验动物应单笼喂饲,以食物消耗量计算其实际染毒剂量。 2. 经呼吸道染毒 经呼吸道染毒可分为吸入染毒和气管内注入。 (1) 静式吸入染毒:将一定数量的啮齿类动物放在密闭的染毒柜中,加入易挥发的液态 受试物或气态受试物使成一定浓度。一般50升的染毒柜接触2小时,可放小鼠6~10只或大鼠 1只。静式吸入染毒简易,但缺点较多,主要是随试验进行氧分压降低(因此,实验动物数量 有限制),柜内受试物浓度也逐渐下降(由于动物吸入消耗、为被毛及染毒柜壁吸附所致),而 且实验动物有经皮吸收的可能。 静式吸入染毒多以计算方法得到染毒柜内受试物浓度,以mg/m3 表示。 (2) 动式吸入染毒:由染毒柜、机械通风系统和配气系统三部分构成。对设备的要求较
食品论坛 http://bbs.foodmate.net 物油,植物油中的抗氧化剂成分等可影响受试物的毒性/遗传毒性。二甲基亚矾(DMSO)不 适用于体内实验,因其毒性较高,并且溶于DMSO的受试物在染毒后出现沉淀。 新药安全性评价推荐混悬液赋形剂为0.5%羧甲基纤维素钠或10%阿拉伯树胶;受试物 溶液应新鲜配制,除非已证明贮存稳定。其他的剂型见下文染毒途径的介绍。 外源化学物用溶剂稀释,一般讲浓溶液比稀溶液毒性大,但是也有的外源化学物稀释之 后毒性反而增加,即存在所谓“稀释毒性”,其原因尚不清楚。 在准备染毒制剂时的要点:①在准备制剂时加热受试物不应接近改变其化学性质或物理 性质的温度。②如受试物为固体,并且评价其对皮肤的毒性,应保持其形状和颗粒大小。③ 多成分的受试物(混合物)应按配方配制,以使染毒制剂准确地反映原混合物(即其成分不应被 选择性地悬浮或溶解)。④制剂应保持化学稳定性和受试物的一致性。⑤制剂应减少总试验 容积,利用溶剂或赋形剂的量不应过多。⑥制剂应易于准确染毒。⑦如可能,制剂pH应为5~ 9。⑧不应用酸或碱使受试物解离(基于保护动物的原因,并避免改变肠道或肾小管内的PH)。 ⑨如果应用非胃肠道途径,终溶液应尽可能接近等渗。 对于各种染毒途径的最大容积,以受试的实验动物物种或制剂来确定。一般规定,染毒 最大容积为:①经口20ml/kg(对空腹动物);②经皮2ml/kg(根据体表面积计算,限于染毒的准 确性);③静脉1ml/kg(5分钟以上);④肌肉注射0.5ml/kg(一个部位);⑤每眼0.01ml;⑥直肠 0.5ml/kg;⑦阴道:大鼠0.2m1,兔1ml;⑧吸人2mg/L;⑨鼻:猴或狗每鼻孔0.1ml。染毒的 通常容积(最大容积):大鼠灌胃为1.0(3.0)ml/100g体重(BW),静注为0.5(3.0)ml/100g BW ; 小鼠灌胃为0.2(1.0)ml/20g B W,静注为0.2(0.5)ml/20g Bw;狗灌胃为50(100)ml/10 kg Bw, 静注为30(50)ml/10 kg BW。各种规范可能有不同的规定,应按规定进行。 三、染毒途径 毒理学试验中染毒途径的选择,应尽可能模拟人在接触该受试物的方式。最常用的染毒 途径为经口、经呼吸道、经皮及注射途径。不同途径的吸收速率,一般是:静脉注射>吸入 >肌肉注射>腹腔注射>皮下注射>经口>皮内注射>其他途径(如经皮等)。 1. 经口(胃肠道)染毒 常用有灌胃、喂饲和吞咽胶囊等方式。 (1) 灌胃:将受试物配制成溶液或混悬液,以注射器经导管注入胃内。一般灌胃深度从 口至剑突下,最好是利用等容量灌胃法,即受试物配制成不同浓度,实验动物单位体重的灌 胃容量相同。大鼠隔夜禁食,小鼠可禁食4小时(因小鼠消化吸收和代谢速度较快),均不停 饮水。灌胃后2~4小时提供饲料。经口多次染毒,一般不禁食,但应每日定时染毒。灌胃法 优点是剂量准确,缺点是工作量大,并有伤及食道或误入气管的可能。 (2) 吞咽胶囊:将一定剂量的受试物装入胶囊中,放至狗的舌后部,迫使动物咽下,此 法剂量准确,适用于易挥发、易水解和有异味的受试物。 (3) 喂饲:将受试物掺入动物饲料或饮水中供实验动物自行摄入。饲料中掺入受试物不 应超过5%,以免造成饲料营养成分改变而影响实验动物的生长发育。喂饲法符合人类接触 受试物的实际情况,但缺点多,如适口性差的受试物,实验动物拒食;易挥发或易水解的受 试物不适用。而且,实验动物应单笼喂饲,以食物消耗量计算其实际染毒剂量。 2. 经呼吸道染毒 经呼吸道染毒可分为吸入染毒和气管内注入。 (1) 静式吸入染毒:将一定数量的啮齿类动物放在密闭的染毒柜中,加入易挥发的液态 受试物或气态受试物使成一定浓度。一般50升的染毒柜接触2小时,可放小鼠6~10只或大鼠 1只。静式吸入染毒简易,但缺点较多,主要是随试验进行氧分压降低(因此,实验动物数量 有限制),柜内受试物浓度也逐渐下降(由于动物吸入消耗、为被毛及染毒柜壁吸附所致),而 且实验动物有经皮吸收的可能。 静式吸入染毒多以计算方法得到染毒柜内受试物浓度,以mg/m3 表示。 (2) 动式吸入染毒:由染毒柜、机械通风系统和配气系统三部分构成。对设备的要求较