
第二章 流体的P-V-T关系
第二章 流体的 P-V-T关系

2.1 纯物质的P-V-T关系 2.2 气体的状态方程 2.3 对比态原理及其应用 2.4 真实气体混合物的P-V-T关系 2.5 液体的P-V-T性质 2.6 习题计算
2.1 纯物质的P-V-T关系 2.2 气体的状态方程 2.3 对比态原理及其应用 2.4 真实气体混合物的P-V-T关系 2.5 液体的P-V-T性质 2.6 习题计算

2.1纯物质的p-V-T关系 1“固”、” 液” “气汽)” 分别代表固体 固液 液体和气体的单相区; 2“固汽”、”固液”和”液消 分别表示 将化曲线 固 固汽、固液和液汽平衡共存的两 三相点 汽化曲线 液 相区。 汽液 个3汽化线的一个端点是临界点C, 三相点线 它表示 升华曲线 汽固 汽液两相能共存的最高压力和温 度,即 临界压力和临界温度。 图2-1纯物质的p-V-T图 4高于临界压力和临界温度的区 域称为 超临界流体区
2.1 纯物质的p –V –T关系 图2-1 纯物质的p –V –T图 C 固液 汽液 汽固 液 1 “固” 、”液” 、“气(汽)” 分别代表固体 、液体和气体的单相区; 2 “固-汽” 、”固-液”和”液-汽” 分别表示 固汽、固液和液汽平衡共存的两 相区。 3 汽化线的一个端点是临界点C, 它表示 汽液两相能共存的最高压力和温 度,即 临界压力和临界温度。 4高于临界压力和临界温度的区 域称为 超临界流体区
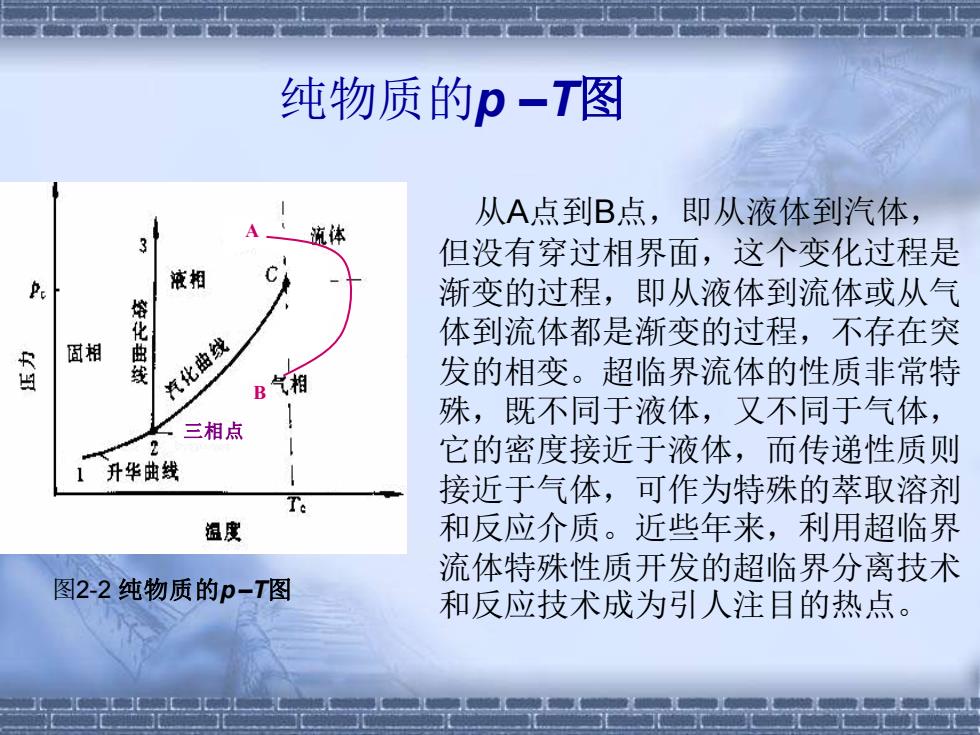
纯物质的p-T图 从A点到B点,即从液体到汽体, 3 流体 但没有穿过相界面,这个变化过程是 液相 渐变的过程,即从液体到流体或从气 固相 熔化曲 体到流体都是渐变的过程,不存在突 R 汽化曲线 B气相 发的相变。超临界流体的性质非常特 殊,既不同于液体,又不同于气体, 三相点 2 它的密度接近于液体,而传递性质则 升华曲线 接近于气体,可作为特殊的萃取溶剂 组度 和反应介质。近些年来,利用超临界 流体特殊性质开发的超临界分离技术 图2-2纯物质的p-T图 和反应技术成为引人注目的热点
纯物质的p –T图 A B 三相点 图2-2 纯物质的p –T图 从A点到B点,即从液体到汽体, 但没有穿过相界面,这个变化过程是 渐变的过程,即从液体到流体或从气 体到流体都是渐变的过程,不存在突 发的相变。超临界流体的性质非常特 殊,既不同于液体,又不同于气体, 它的密度接近于液体,而传递性质则 接近于气体,可作为特殊的萃取溶剂 和反应介质。近些年来,利用超临界 流体特殊性质开发的超临界分离技术 和反应技术成为引人注目的热点
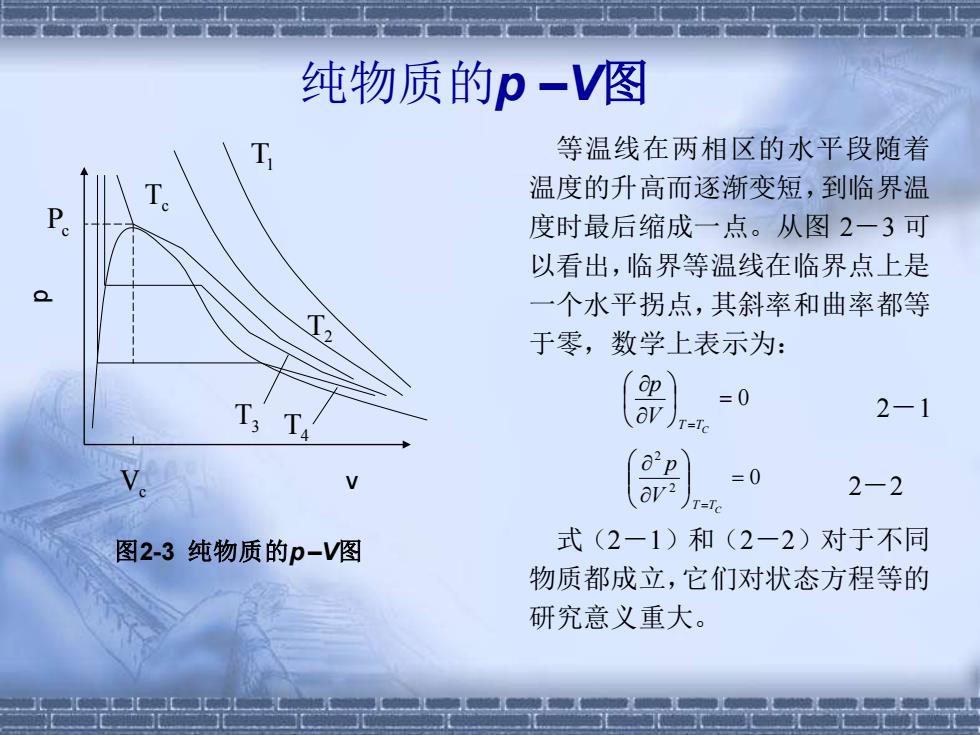
纯物质的p-V图 等温线在两相区的水平段随着 温度的升高而逐渐变短,到临界温 Q 度时最后缩成一点。从图2一3可 以看出,临界等温线在临界点上是 一个水平拐点,其斜率和曲率都等 于零,数学上表示为: p =0 T:Ta 、aV 2-1 T=To o'p =0 2-2 T=To 图2-3纯物质的p-V图 式(2-1)和(2-2)对于不同 物质都成立,它们对状态方程等的 研究意义重大
等温线在两相区的水平段随着 温度的升高而逐渐变短,到临界温 度时最后缩成一点。从图 2-3 可 以看出,临界等温线在临界点上是 一个水平拐点,其斜率和曲率都等 于零,数学上表示为: = 0 T =TC V p 2-1 0 2 2 = T =TC V p 2-2 式(2-1)和(2-2)对于不同 物质都成立,它们对状态方程等的 研究意义重大。 图2-3 纯物质的p –V图 纯物质的p –V图 p v T1 T2 T3 T4 Tc Pc Vc

2.2气体的状态方程 定义:描述流体p-V-T关系的函数式为: f(p,/,T)= )称为状态方程 (Equation of SatateEOS),它用来联系在平衡态下纯流体的 压力、摩尔体积、温度之间的关系。 作用:状态方程具有非常重要的价值 (1)表示在较广泛的范围内p、V、T之间的函数关系; (2)可通过它计算不能直接从实验测得的其他热力学性质
定义:描述流体p –V -T关系的函数式为: 称为状态方程 (Equation of SatateEOS),它用来联系在平衡态下纯流体的 压力、摩尔体积、温度之间的关系。 作用:状态方程具有非常重要的价值 (1)表示在较广泛的范围内p、V、T之间的函数关系; (2) 可通过它计算不能直接从实验测得的其他热力学性质。 2.2 气体的状态方程 f (p,V,T) = 0

要求:形式简单、计算方便、适用于不同极性 及分子形状的化合物、计算各种热力学 性质时均有较高的精确度。 分类:目前存在的状态方程分如下几类: (1)理想气体状态方程; (2)Virial(维里)方程; (3)立方型状态方程; (4)多参数状态方程
要求:形式简单、计算方便、适用于不同极性 及分子形状的化合物、计算各种热力学 性质时均有较高的精确度。 分类:目前存在的状态方程分如下几类: (1)理想气体状态方程; (2)Virial(维里)方程; (3)立方型状态方程; (4)多参数状态方程

2.2.1理想气体状态方程 假定分子的大小如同几何点一样,分子间不存在相互作 用力,由这样的分子组成的气体叫做理想气体。在极低的压 力下真实气体非常接近理想气体,可以当作理想气体处理。 理想气体状态方程是最简单的状态方程: PV=RT
2.2.1理想气体状态方程 假定分子的大小如同几何点一样,分子间不存在相互作 用力,由这样的分子组成的气体叫做理想气体。在极低的压 力下真实气体非常接近理想气体,可以当作理想气体处理。 理想气体状态方程是最简单的状态方程: pV = RT

(1) 在工程设计中,可以用理想气体状态方 程进行近似的估算。 (2) 它可以作为衡量真实气体状态方程是否 正确的标准之一,当压力趋近于0或者体积趋于无穷时, 任何真实气体状态方程都应还原为理想气体方程
(1) 在工程设计中,可以用理想气体状态方 程进行近似的估算。 (2) 它可以作为衡量真实气体状态方程是否 正确的标准之一,当压力趋近于 0或者体积趋于无穷 时, 任何真实气体状态方程都应还原为理想气体方程

2.2.2立方型状态方程 立方型状态方程是指方程可展开为体积(或密度)的三 次方形式。这类方程能够解析求根,有较高精度,又不太 复杂,很受工程界欢迎。 van der Waals状态方程 方程形式: RT p= v-b
立方型状态方程是指方程可展开为体积(或密度)的三 次方形式。这类方程能够解析求根,有较高精度,又不太 复杂,很受工程界欢迎。 van der Waals 状态方程 方程形式: 2.2.2立方型状态方程 2 V a V b RT p − − =