
习题 第1章绪言 一、是否题 1.孤立体系的热力学能和嫡都是一定值。 2.封闭体系的体积为一常数。 3.封闭体系中有两个相α,B。在尚未达到平衡时,α,B两个相都是均相做开体系: 达到平衡时,则α,B两个相都等价于均相封闭体系。 4. 理想气体的焓和热容仅是温度的函数。 5.理想气体的熵和吉氏函数仅是温度的函数。 6.要确定物质在单相区的状态需要指定两个强度性质,但是状态方程P-P(T,门的自变 量中只有一个强府性历,所以,这与相律省矛店。 7. 封闭体系的1mol气体进行了某一过程,其体积总是变化者的,但是初态和终态的体积 相等,初态和终态的温度分别为T1和T2,则该过程的4U=C,dn:同样,对于初、 终态压力相等的过程有4出=C,dr。 8描述封闭体系中理想气体绝热可逆逸径的方程是手-会) (其中y=C坚/C9), 而一位学生认为这是状态函数间的关系,与途径无关,所以不需要可逆的条件 9.自变量与独立变量是一致的,从属变量与函数是一致的。 10.自变量与独立变量是不可能相同的。 三、填空题 1. 状态函数的特点是: 2. 单相区的纯物质和定组成混合物的自由度数目分别是 和。 3.封闭体系中,温度是T的1mol理想气体从(P,)等温可逆地膨胀到(P,の,则所做的 功为 (以表示)或 (以P表示): 4.封闭体系中的1mol理想气体(已知C),按下列途径由T、P和可逆地变化至P,则 A等容过程的W= ,4=
习题 第 1 章 绪言 一、是否题 1. 孤立体系的热力学能和熵都是一定值。 2. 封闭体系的体积为一常数。 3. 封闭体系中有两个相 , 。在尚未达到平衡时, , 两个相都是均相敞开体系; 达到平衡时,则 , 两个相都等价于均相封闭体系。 4. 理想气体的焓和热容仅是温度的函数。 5. 理想气体的熵和吉氏函数仅是温度的函数。 6. 要确定物质在单相区的状态需要指定两个强度性质,但是状态方程 P=P(T,V)的自变 量中只有一个强度性质,所以,这与相律有矛盾。 7. 封闭体系的1mol气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积 相等,初态和终态的温度分别为T1和T2,则该过程的 = 2 1 T T U CV dT ;同样,对于初、 终态压力相等的过程有 = 2 1 T T H CP dT 。 8. 描述封闭体系中理想气体绝热可逆途径的方程是 ( 1) 1 2 1 2 − = P P T T (其中 ig V ig = CP C ), 而一位学生认为这是状态函数间的关系,与途径无关,所以不需要可逆的条件。 9. 自变量与独立变量是一致的,从属变量与函数是一致的。 10. 自变量与独立变量是不可能相同的。 三、填空题 1. 状态函数的特点是:_。 2. 单相区的纯物质和定组成混合物的自由度数目分别是_和 _。 3. 封闭体系中,温度是T的1mol理想气体从(Pi,Vi)等温可逆地膨胀到(Pf,Vf),则所做的 功为_ (以V表示)或_ (以P表示)。 4. 封闭体系中的1mol理想气体(已知 ig CP ),按下列途径由T1、P1和V1可逆地变化至P2,则 A 等容过程的 W= _,Q=_,U=_

的 40= C绝热过程的W= 00,4 5.在常压下100Ocm液体水膨胀1cm3,所作之功为一 :若使水的表面增大1cm2, 我们所要作的功是 」(水的表张力是72egcm2)。 6 1MPa=_Pa=l0bar= atm= mmHg. 7.1kJ= cal=atm cm3= bar cm3=pam3。 &.普适气体常数R=MPa cm3morK=83.14 bar cm3moK-l=JmoK cal mol-K- 四、计算题 1. 个绝热刚性容器,总体积为V,温度为T,被一个体积可以忽略的隔板分为A、B两 室。两室装有不同的理想气体。突然将隔板移走,使容器内的气体自发达到平衡。计算 该过程的Q、W、AU和最终的T和P。设初压力是(a)两室均为Po:(b)左室为Pa, 右室是真空。 2.常压下非常纯的水可以过冷至0C以下。一些5℃的水由于受到干扰而开始结品,由于 结品过程进行得很快,可以认为体系是绝热的,试求凝固分率和过程的熵变化。已知冰 的熔化热为333.4Jg和水在0~-5℃之间的热容为422JgK1。 某一服从P(b) RT状态方程(b是正常数)的气体,在从10O0b等温可逆膨胀至 2000b,所做的功应是理想气体经过相同过程所做功的多少倍? 4.对于C肾为常数的理想气体经过一绝热可逆过程,状态变化符合下列方程 种 CI ,试问,对于C停=a+bT+cT2的理想气体,上述关系 式又是如何?以上a、b,c为常数。 5. 一个0.057m3气瓶中贮有的1MPa和294K的高压气体通过一半开的阀门放入一个压力恒 015的气柜中,当气瓶中的压 至0.5MPa时,计算下列两种条件下从气瓶 中流入气柜中的气体量。(假设气体为理想气体 (a)气体流得足够慢以至于可视为恒温过程; (b)气体流动很快以至于可忽视热量损失(假设过程可逆,绝热指数y=1.4)。1 五、图示题
H=_。 B 等温过程的 W=_,Q=_,U=_,H=_。 C 绝热过程的 W=_,Q= 0 , U=_,_ 5. 在常压下1000cm3液体水膨胀1cm3,所作之功为_J;若使水的表面增大1cm2, 我们所要作的功是_J (水的表张力是72erg cm-2 )。 6. 1MPa=_Pa=10bar=_atm=_mmHg。 7. 1kJ=_J=_cal=_atm cm3=_bar cm3=_Pa m3。 8. 普适气体常数R=_MPa cm3 mol-1 K-1=83.14bar cm3 mol-1 K-1=_ J mol-1 K-1 =_cal mol-1 K-1。 四、计算题 1. 一个绝热刚性容器,总体积为 Vt,温度为 T,被一个体积可以忽略的隔板分为 A、B 两 室。两室装有不同的理想气体。突然将隔板移走,使容器内的气体自发达到平衡。计算 该过程的 Q、W、U 和最终的 T 和 P。设初压力是(a)两室均为 P0;(b)左室为 P0, 右室是真空。 2. 常压下非常纯的水可以过冷至 0℃以下。一些-5℃的水由于受到干扰而开始结晶,由于 结晶过程进行得很快,可以认为体系是绝热的,试求凝固分率和过程的熵变化。已知冰 的熔化热为 333.4J g-1 和水在 0~-5℃之间的热容为 4.22J g-1 K-1。 3. 某一服从 P(V-b)=RT 状态方程(b 是正常数)的气体,在从 1000b 等温可逆膨胀至 2000b,所做的功应是理想气体经过相同过程所做功的多少倍? 4. 对 于 ig CP 为 常 数 的 理 想气 体 经 过一 绝 热 可逆 过 程, 状 态 变化 符 合下 列 方 程 ( 1) 1 2 1 2 − = P P T T ,其中 ig V ig P C C = ,试问,对于 2 C a bT cT ig P = + + 的理想气体,上述关系 式又是如何? 以上a、b、c为常数。 5. 一个0.057m3气瓶中贮有的1MPa和294K的高压气体通过一半开的阀门放入一个压力恒 定为0.115MPa的气柜中,当气瓶中的压力降至0.5MPa时,计算下列两种条件下从气瓶 中流入气柜中的气体量。(假设气体为理想气体) (a)气体流得足够慢以至于可视为恒温过程; (b)气体流动很快以至于可忽视热量损失(假设过程可逆,绝热指数 =1.4 )。l 五、图示题
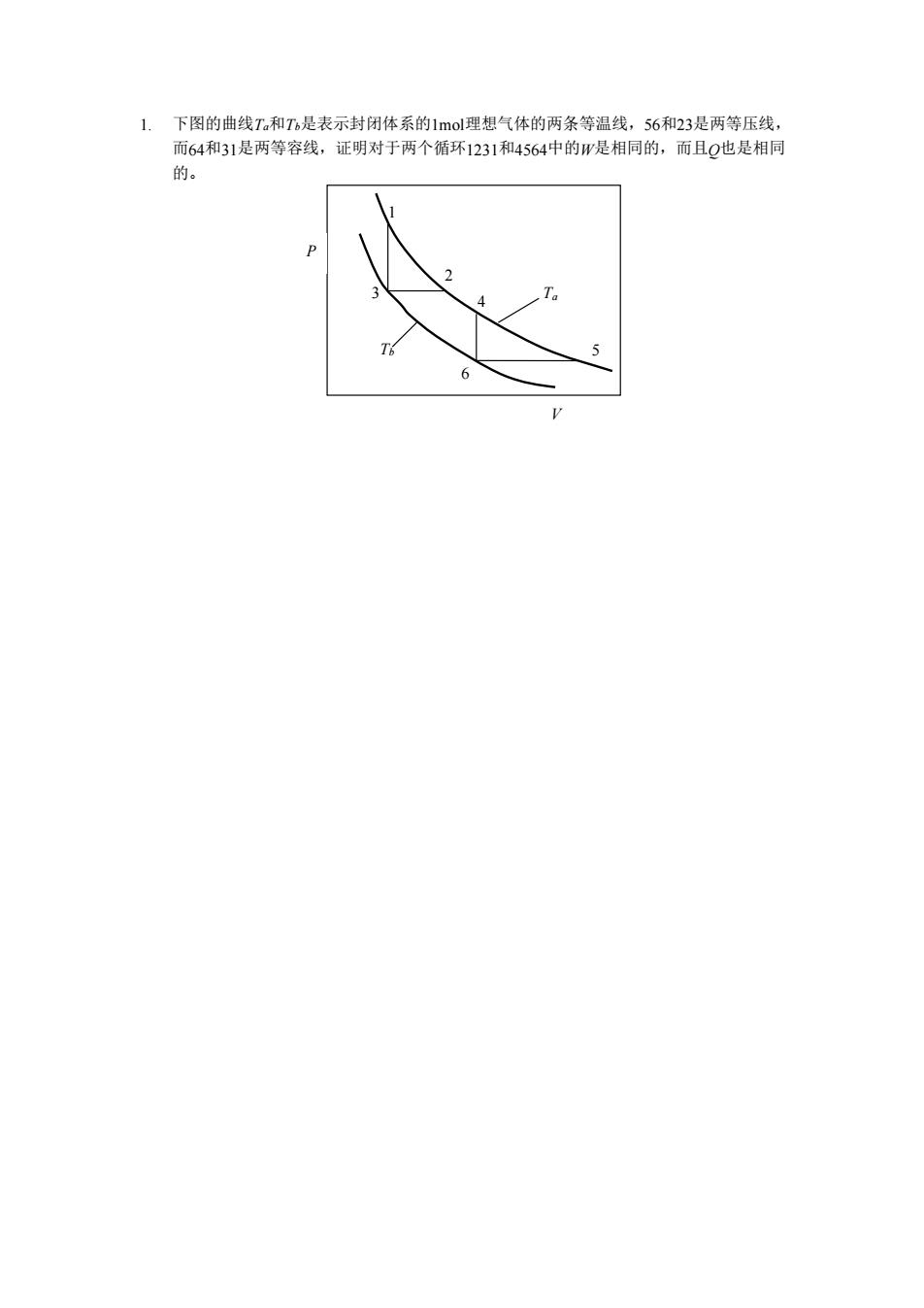
1.下图的曲线T和T是表示封闭体系的1mol理想气体的两条等温线,56和23是两等压线, 而64和31是两等容线,证明对于两个循环1231和4564中的W是相同的,而且Q也是相同 的
1. 下图的曲线Ta和Tb是表示封闭体系的1mol理想气体的两条等温线,56和23是两等压线, 而64和31是两等容线,证明对于两个循环1231和4564中的W是相同的,而且Q也是相同 的。 V P 1 2 3 4 5 6 Ta Tb