
第2章 流体的PV-T关系 一、是否题 1,纯物质由蒸汽变成固体,必须经过液相。 (错。可以直接变成固体。) 2.纯物质由蒸汽变成液体,必须经过冷凝的相变化过程。 (错。可以通超临界体区。) 3.当压力大于临界压力时,纯物质就以液态存在。 (错。若温度也大于临界温度时,则是超临界流体。) 4。纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸汽的摩尔体积随着温度的升高而减小。 (对。由纯物质的T一V相图上的饱和汽体系和饱和液体系曲线可知。) 5. 气体混合物的virial系数,如B,C”,是温度和组成的函数 (对。) 6.在压力趋于零的极限条件下,所有的流体将成为简单流体。 (错。简单流体系指一类非极性的球形流体,如A等,与所处的状态无关。) 2。所有的物质在相同的状态下,表现出相同的性质,这称之为对比态原理 (错) 8.由于分子间相互作用力的存在,实际气体的摩尔体积一定小于同温同压下的理想气体的摩尔体积, 所以,理想气体的压缩因子Z=1,实际气体的压缩因子21.) 9.理想气体的U,Cr,H,Cp虽然与P无关,但与有关。 10.纯物质的三相点随着所处的压力或温度的不同而改变。 (错。纯物质的三相平衡时,体系自由度是零,体系的状态已经确定。) 11.在同一温度下,纯物质的饱和液体与饱和蒸汽的热力学能相等。 (错。它们相差一个汽化热力学能,当在临界状态时,两者相等,但此时己是汽液不分) 2。在同一温度下,纯物质的饱和液体与饱和燕汽的吉氏西数相等。 (对。这是纯物质的汽液平衡准则) 13.若一个状态方程能给出纯流体正确的临界压缩因子,那么它就是一个优秀的状态方程 (错。) 14.气体混合物的virial系数,如B,C,是温度和组成的函数 (对。) 15.三参数的对应态原理较两参数优秀,因为前者适合于任何流体。 (错。三对数对应态原理不能适用于任何流体,一般能用于正常流体normal fluid) 16.在压力趋于零的极限条件下,所有的流体将成为简单流体。 。简单流体系指 类非极性的球形济 如Ar等, 与所处的状态无关。) 17.纯气体的virial系数,如B,C",是温度和压力的函数。 (错,只是温度的函数) 18.普遍化维里系数使用范围和普遍化压缩因子使用范围基本相同 19.普遍化维里系数法只需要温度、压力和偏心因子即可计算纯气体的压缩因子 3
3 第 2 章 流体的 P-V-T 关系 一、是否题 1. 纯物质由蒸汽变成固体,必须经过液相。 (错。可以直接变成固体。) 2. 纯物质由蒸汽变成液体,必须经过冷凝的相变化过程。 (错。可以通过超临界流体区。) 3. 当压力大于临界压力时,纯物质就以液态存在。 (错。若温度也大于临界温度时,则是超临界流体。) 4. 纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸汽的摩尔体积随着温度的升高而减小。 (对。由纯物质的T-V相图上的饱和汽体系和饱和液体系曲线可知。) 5. 气体混合物的virial系数,如B,C.,是温度和组成的函数。 (对。) 6. 在压力趋于零的极限条件下,所有的流体将成为简单流体。 (错。简单流体系指一类非极性的球形流体,如Ar等,与所处的状态无关。) 7. 所有的物质在相同的状态下,表现出相同的性质,这称之为对比态原理 (错) 8. 由于分子间相互作用力的存在,实际气体的摩尔体积一定小于同温同压下的理想气体的摩尔体积, 所以,理想气体的压缩因子Z=1,实际气体的压缩因子Z<1。 (错。如温度大于Boyle温度时,Z>1。) 9. 理想气体的 U CV H CP , , , 虽然与P无关,但与V有关。 (对。因 T T T P T M V RT V P P M V M = − = 2 。) 10. 纯物质的三相点随着所处的压力或温度的不同而改变。 (错。纯物质的三相平衡时,体系自由度是零,体系的状态已经确定。) 11. 在同一温度下,纯物质的饱和液体与饱和蒸汽的热力学能相等。 (错。它们相差一个汽化热力学能,当在临界状态时,两者相等,但此时已是汽液不分) 12. 在同一温度下,纯物质的饱和液体与饱和蒸汽的吉氏函数相等。 (对。这是纯物质的汽液平衡准则。) 13. 若一个状态方程能给出纯流体正确的临界压缩因子,那么它就是一个优秀的状态方程。 (错。) 14. 气体混合物的virial系数,如B,C.,是温度和组成的函数。 (对。) 15. 三参数的对应态原理较两参数优秀,因为前者适合于任何流体。 (错。三对数对应态原理不能适用于任何流体,一般能用于正常流体normal fluid) 16. 在压力趋于零的极限条件下,所有的流体将成为简单流体。 (错。简单流体系指一类非极性的球形流,如Ar等,与所处的状态无关。) 17. 纯气体的virial系数,如B,C.,是温度和压力的函数。 (错,只是温度的函数) 18. 普遍化维里系数使用范围和普遍化压缩因子使用范围基本相同 (错) 19. 普遍化维里系数法只需要温度、压力和偏心因子即可计算纯气体的压缩因子

(错,还需要物质的临界常数) 20.在纯物质的PT图上,气化曲线、泡点线、汽液平衡线是一条线。 (对) 21.从纯物质的PV图上看,只知道压力,是无法确定纯物质的状态的 (对) 22.从纯物质的PT图上看,在等温升压过程中,不同状态的气体的表现是一样的。 (错,有的液化,有的成为超临界流体 23.气体变为固体,必须先液化,再凝固。 (错) 24.立方型状态方程可以求出压力的解析解 (错,需要叠代,进行数值求解) 25.压力低于所处温度下的饱和蒸汽压的液体称为过热液体 (对) 26.压力高于所处温度下的饱和蒸汽压的汽体称为过冷蒸汽 (什) 27.当压力大于临界压力时。纯物质就以液态存在了 28纯物质的三相点随若所处的压力或温度的不同而改变 29.纯物质的PVT图中的三相点的自由度为0 30.在一定压力下,组成相同的混合物的露点温度和泡点温度不可能相同。 二填空题 1.在三参数对应态原理中,Z=+ωZ,三参数指的是 。在两参 数对应态原理中,两参数指的是 2在维里方程中C/V2项代表 3在纯物质的PT图中有 个两相区。汽液平衡时,压力为 ,温度为 4.甲烷气体的TC=190.6K.PC=4.6MPa.当体系处于T=400K,P=12MPa时的Tr= 5.在纯物质的PT图中有 个两相区。泡点的轨迹称为 ,汽液平衡时,压力 为 ,温度为 6.纯物质的临界等温线在临界点处的 为零。 7.在纯物质的PT图中,有 单相区,分别为 ,其自由度为 ,存 在 _条两相平衡线,分别为 ,其自由度为 三相点的自由度为 8.常用的立方型状态方程有 9.偏心因子的定义式是 其含义为 10.在纯物质的pV图中有 个两相区,其自由度为,其饱和液相线和饱和气相线的交点 是
4 (错,还需要物质的临界常数) 20. 在纯物质的PT图上,气化曲线、泡点线、汽液平衡线是一条线。 (对) 21. 从纯物质的PV图上看,只知道压力,是无法确定纯物质的状态的 (对) 22. 从纯物质的PT图上看,在等温升压过程中,不同状态的气体的表现是一样的。 (错,有的液化,有的成为超临界流体) 23. 气体变为固体,必须先液化,再凝固。 (错) 24. 立方型状态方程可以求出压力的解析解 (错,需要叠代,进行数值求解) 25. 压力低于所处温度下的饱和蒸汽压的液体称为过热液体 (对) 26. 压力高于所处温度下的饱和蒸汽压的汽体称为过冷蒸汽 (对) 27. 当压力大于临界压力时。纯物质就以液态存在了 ( ) 28. 纯物质的三相点随着所处的压力或温度的不同而改变 ( ) 29. 纯物质的 PVT 图中的三相点的自由度为 0 30. 在一定压力下,组成相同的混合物的露点温度和泡点温度不可能相同。 ( ) 二 填空题 1. 在三参数对应态原理中, Z=Z0+ωZ 1 , 三参数指的是 , , 。在两参 数对应态原理中, 两参数指的是 , 。 2.在维里方程中 C/V2 项代表 。 3. 在纯物质的P-V-T图中有 个两相区。汽液平衡时,压力为 ,温度为 。 4. 甲烷气体的 TC=190.6K,PC=4.6MPa, 当体系处于 T=400K,P=12MPa 时的 Tr= , Pr= , 5. 在纯物质的 P-T 图中有 个两相区。泡点的轨迹称为 ,汽液平衡时,压力 为 ,温度为 。 6. 纯物质的临界等温线在临界点处的 和 为零。 7. 在纯物质的 PT 图中,有 单相区,分别为 ,其自由度为 ,存 在 条两相平衡线,分别为 ,其自由度为, 三相点的自由度为 。 8. 常用的立方型状态方程有 。 9. 偏心因子的定义式是 。 其含义为 。 10. 在纯物质的 PV 图中有 个两相区,其自由度为 ,其饱和液相线和饱和气相线的交点 是

11.纯物质的临界等温线在临界点处的斜率和曲率均为0,在数学上可以表示为 12.对于纯物质,一定温度下的泡点压力与露点压力 (相同/不同)的:一定温度下的泡点与露 点,在P一T图上是 的(重叠/分开),而在PV图上是」 的重叠/分开),泡点 的轨迹称为 露点的轨迹称为 饱和汽、液相线与三相线所包围的区域称为 。纯物质汽液平衡时,压力称为 ,温度称为 13.对于三元混合物,展开第二vrl系数B=∑∑y,B,= 其中涉及了下标相同的维里系数有 ,它们表示 下标下标不同的 virial系数有 它们表示 14.简述对应态原理 15.纯流体P-T图中液化曲线是 和 的平衡线。 16.熔化曲线是 和 的平衡线。 17.立方型的气体状态方程有: 方程、 方程和 方程。 三、选择题 1.指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为() A.饱和蒸汽 B.超临界流体 C.过热燕汽 (C。参考P一图上的亚临界等温线。) 2. 温度下的过冷纯液体的压力P A.>P*(T) B.P(T) B.<P(T) C.=P(T) (B。参考P一图上的亚临界等温线。) 4.纯物质的第二virial系数B A仅是I的函数B是T和P的函数C是T和V的函数D是任何两强度性质的函数 (A。va系数表示了分子间的相互作用,仅是温度的函数。) 5.能表达流体在临界点的P.等温线的正确趋势的viia方程,必须至少用到 A.第三virial系数 B.第二virial系数C.无穷项 D.只需要理想气体方程 (A。要表示出等温线在临界点的拐点特征,要求关于的立方型方程) 6。对于纯物质,一定温度下的泡点压力与露点压力是() A相同的 B不同的 7.对于纯物质, 一定温度下泡点与屏点,在P一T图上是 (A) A重叠的 B分开的 8.对于纯物质,一定温度下泡点与露点,在P图上是(B) A重叠的 B分开的 9.泡点的轨迹称为 (A)
5 11. 纯物质的临界等温线在临界点处的斜率和曲率均为 0,在数学上可以表示为 和 。 12. 对于纯物质,一定温度下的泡点压力与露点压力 (相同/不同)的;一定温度下的泡点与露 点,在 P-T 图上是_ 的(重叠/分开),而在 P-V 图上是_ 的(重叠/分开),泡点 的轨迹称为_,露点的轨迹称为_,饱和汽、液相线与三相线所包围的区域称为 _。纯物质汽液平衡时,压力称为_ _,温度称为 13. 对于三元混合物,展开第二virial系数 = = = = ij i j B yi y jB 3 1 3 1 , 其中涉及了下标相同的维里系数有 ,它们表示 ,下标下标不同的 virial系数有 ,它们表示 。 14. 简述对应态原理 。 15. 纯流体P-T图中液化曲线是 和 的平衡线。 16. 熔化曲线是 和 的平衡线。 17. 立方型的气体状态方程有: 方程、 方程和 方程。 三、选择题 1. 指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则气体的状态为( ) A. 饱和蒸汽 B. 超临界流体 C. 过热蒸汽 (C。参考P-V图上的亚临界等温线。) 2. T温度下的过冷纯液体的压力P (A。参考P-V图上的亚临界等温线。) 3. T温度下的过热纯蒸汽的压力P (B。参考P-V图上的亚临界等温线。) 4. 纯物质的第二virial系数B (A。virial系数表示了分子间的相互作用,仅是温度的函数。) 5. 能表达流体在临界点的P-V等温线的正确趋势的virial方程,必须至少用到 (A。要表示出等温线在临界点的拐点特征,要求关于V的立方型方程) 6. 对于纯物质,一定温度下的泡点压力与露点压力是 (A) A 相同的 B 不同的 7. 对于纯物质,一定温度下泡点与露点,在P-T图上是 (A) A 重叠的 B 分开的 8. 对于纯物质,一定温度下泡点与露点,在P-V图上是 (B) A 重叠的 B 分开的 9. 泡点的轨迹称为 (A) A. > P (T ) s B. P (T ) s B. < P (T ) s C. = P (T ) s A 仅是T的函数 B 是T和P的函数 C 是T和V的函数 D 是任何两强度性质的函数 A. 第三virial系数 B. 第二virial系数 C. 无穷项 D. 只需要理想气体方程

A饱和液相线B饱和汽相线 10.露点的轨迹称为 (B) A饱和液相线 B饱和汽相线 11对于合物,PR方程常数的表达式a=之,A-y)中的相互作用参数,同时 (A) B为0C从实验数据拟合得到,在没有实验数据时,近似作零处理 12对于渴合物,PR方程常藏的表达式a-之,-)中的相互作用参数,伪时 (c) A为1 B为0 C从实验数据拟合得到,在没有实验数据时,近似作零处理 13.指定温度下的纯物质,当压力大于该温度下的饱和蒸汽压时,则物质的状态为() A饱和蒸汽B超临界流体 C过热蒸汽D压缩液体 (CD。参考P一V图上的亚临界等温线。) 14.偏心因子是从下列定义的() A分子的对成性B蒸汽压性质 C分子的极性 (C 15当P一0时,纯气体的[RTP-VET)的值为( A0B很高的温度时为0C与第三维里系数有关D在BOye温度时为0 16.属于亚稳定状态的有() A过热蒸汽 B过热液体 C过冷蒸汽D饱和蒸汽 (ABC。) 四、图示题 1.水的PT和PV图如下,回答 (1)点E和C的意义: (2)曲线EC,AC和BC的意义: (3)标出液相曲、固相区、气相区以及两相区。 (4)有一汽相体系,状态为P、V、T,如果想在等温情况下压缩,获得过冷液体,请在两张图上标 出路径(5分)
6 A 饱和液相线 B 饱和汽相线 10. 露点的轨迹称为 (B) A 饱和液相线 B 饱和汽相线 11. 对于混合物,PR方程常数a的表达式 = = = − 3 1 3 1 (1 ) i j i j ii jj ij a y y a a k 中的相互作用参数kij,i=j 时, 其值 (A) A 为1 B 为0 C 从实验数据拟合得到,在没有实验数据时,近似作零处理 12. 对于混合物,PR方程常数a的表达式 = = = − 3 1 3 1 (1 ) i j i j ii jj ij a y y a a k 中的相互作用参数kij,i≠j 时, 其值 ( C ) A 为1 B 为0 C 从实验数据拟合得到,在没有实验数据时,近似作零处理 13. 指定温度下的纯物质,当压力大于该温度下的饱和蒸汽压时,则物质的状态为( ) A 饱和蒸汽 B 超临界流体 C 过热蒸汽 D 压缩液体 (C D。参考P-V图上的亚临界等温线。) 14. 偏心因子是从下列定义的( ) A 分子的对成性 B 蒸汽压性质 C 分子的极性 (C) 15.当P→0时,纯气体的[RT/P-V(P, T)]的值为( ) A 0 B 很高的温度时为0 C 与第三维里系数有关 D 在Boyle温度时为0 ( ) 16. 属于亚稳定状态的有( ) A 过热蒸汽 B 过热液体 C 过冷蒸汽 D 饱和蒸汽 (A B C 。) 四、图示题 1.水的 PT 和 PV 图如下,回答: (1)点 E 和 C 的意义; (2)曲线 EC, AC 和 BC 的意义; (3)标出液相曲、固相区、气相区以及两相区。 (4)有一汽相体系,状态为 P1、V1、T1,如果想在等温情况下压缩,获得过冷液体,请在两张图上标 出路径(5 分)
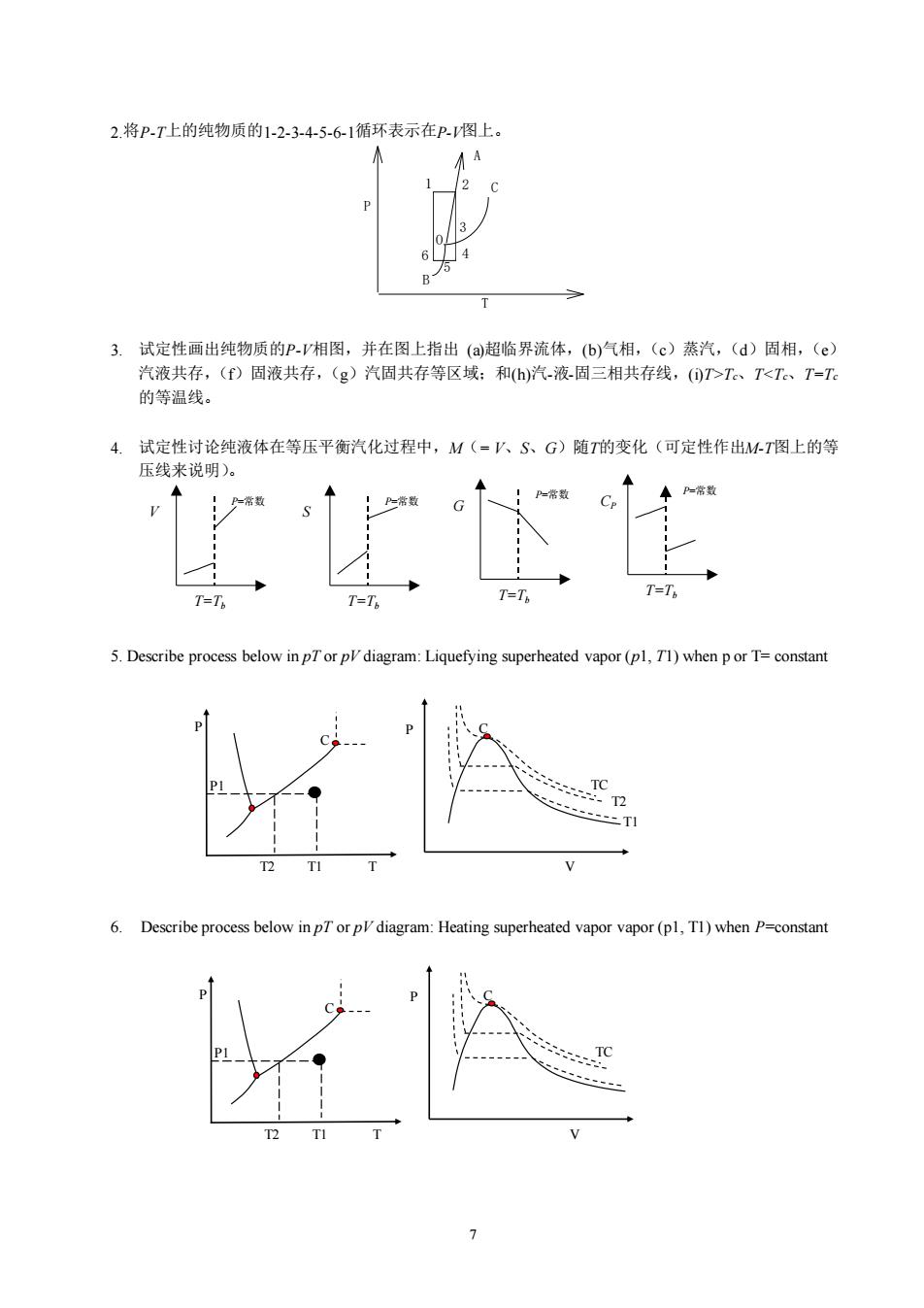
2.将P.T上的纯物质的1-23-45-6-1循环表示在P.图上。 3.试定性画出纯物质的P-相图,并在图上指出(a超临界流体,(b)气相,(c)蒸汽,()固相,(e) 汽液共存,(f)周液共存,(g)汽周共存等区域:和(h)汽液周三相共存线,(D>、T<T。、T-T 的等温线。 4.试定性讨论纯液体在等压平衡汽化过程中,M(=人、S、G)随7的变化(可定性作出MT图上的等 压线来说明)。 T=T T-T T=T T=T 5.Describe process below inpTor p diagram:Liquefying superheated vapor(pl,T1)when por T=constant 二T1 escribe process below inpT or p diagram:Heating supe vapor r vapor(pl,TI)when P=constan
7 2.将P-T上的纯物质的1-2-3-4-5-6-1循环表示在P-V图上。 P T 1 2 3 4 5 6 O C A B 3. 试定性画出纯物质的P-V相图,并在图上指出 (a)超临界流体,(b)气相,(c)蒸汽,(d)固相,(e) 汽液共存,(f)固液共存,(g)汽固共存等区域;和(h)汽-液-固三相共存线,(i)T>Tc、T<Tc、T=Tc 的等温线。 4. 试定性讨论纯液体在等压平衡汽化过程中,M(= V、S、G)随T的变化(可定性作出M-T图上的等 压线来说明)。 5. Describe process below in pT or pV diagram: Liquefying superheated vapor (p1, T1) when p or T= constant 6. Describe process below in pT or pV diagram: Heating superheated vapor vapor (p1, T1) when P=constant V T=Tb P=常数 S T=Tb P=常数 G T=Tb P=常数 CP T=Tb P=常数 P T2 T1 T P1 C P V TC C T1 T2 P T2 T1 T P1 C P V TC C

五、证明题 1.试证明在ZP,图上的临界等温线在临界点时的斜率是无穷大:同样,在Z1/图上的临界等温线在 临界点的斜率为一有限值 (品[1小-2 2已知流体的时k由线是关于(部,=0的点的轨连。E明dW流体的wk自线是 (a-bRTW2-2abV+ab2=0 由vdW方程得 。品09-0 整理得Boyle曲线 (a-bRT)2-2abv+ab2=O 六、计算题 1.由饱和蒸汽压方程,在合适的假设下估算水在25℃时的汽化格。 ·→r 解dnp AH dT 由人a方程hPr= B 查得水和Antoine?常数是B=3826.36,C=-45.47,故 B A-( RB-8314×382636=4291.384Jmor 4547 2.一个0.5m的压力容器,其极限压力为275MP,出于安全的考虑,要求操作压力不得超过极限压 力的一半。试问容器在130℃条件下最多能装入多少丙烷?(答案:约10kg) 解:查出T=369.85K,P=4.249MPa,w=0.152 P=275/2=1375MPgT=130℃ 由计算软件,选择“流体的PVT关系”一“PR方程”,计算出给定状态下的摩尔体积, =2.198mmof
8 五、证明题 1. 试证明 在Z-Pr图上的临界等温线在临界点时的斜率是无穷大;同样,在Z-1/Vr图上的临界等温线在 临界点的斜率为一有限值。 证明: ( ) → = + = 点 点 点 T c c c c c c T c c T c r V P P V RT P P PV RT P P Z , , , ( ) ( ) c T c c c c c c c T c c r T c Z V P P V RT V V PV RT V V V Z = − = − + = − 点 , 点 , 点 2 , 1 2. 已 知 流 体 的 Boyle 曲 线 是 关 于 = 0 P T Z 的 点 的 轨 迹 。 证 明 vdW 流 体 的 Boyle 曲 线 是 ( ) 2 0 2 2 a − bRT V − abV + ab = 证明: 0 0 1 = = + = + T T T V P P V V P V P P RT Z 由 得 由vdW方程得 ( ) 0 3 2 2 3 + = − − − − V Va V b RTV V a V b RT 整理得Boyle曲线 ( ) 2 0 2 2 a − bRT V − abV + ab = 六、计算题 1. 由饱和蒸汽压方程,在合适的假设下估算水在25℃时的汽化焓。 解: dT d P H RT RT H RZ T H R Z T H dT d P s vap vap vap vap vap s vap ln 2 ln 2 2 2 = = → = 低压下 由Antoine方程 ( ) 2 ln ln C T B dT d P C T B P A s s + = + = − 得 查得水和Antoine常数是 B = 3826.36,C = −45.47 ,故 ( ) 44291.84 1 298.15 45.47 8.314 3826.36 1 2 2 2 2 = + − = + = + = T C RB RT C T B H vap Jmol-1 2. 一个 0.5m3 的压力容器,其极限压力为 2.75MPa,出于安全的考虑,要求操作压力不得超过极限压 力的一半。试问容器在 130℃条件下最多能装入多少丙烷?(答案:约 10kg) 解:查出 Tc=369.85K,Pc=4.249MPa,ω=0.152 P=2.75/2=1.375MPa,T=130℃ 由计算软件,选择“流体的 PVT 关系”→“PR 方程”,计算出给定状态下的摩尔体积, V v=2.198 m3 kmol-1

=0.5/2.198*44=10.01(kg) 3.用virial方程估算0.5MPa,373.15K时的等摩尔甲烷(1)-乙烷(2)-戊烷(3)混合物的摩尔体 积(实验值5975cmmo。已知373.15K时的virial系数如下(单位: B1=-20,B2=-241,B=-621,B2=-75,B=-122,B2=-399。 解:混合物的virial系数是 B=22y,,=听+,+,+2B+28+2y81 i=l i=l .-20-241-621-2×75-2×122-2×399.-230.4 9 V=RT/P+B=8.314×373.15/0.5-230.44=5974.298cm3mol1 4.用Antoine方程计算正丁烷在50C时蒸汽压:用PR方计算正丁烷在50C时饱和汽、液相摩尔体积(用 教件计算);再用修正的Rackett方程计算正丁烷在50C时饱和液相摩尔体积。(液相摩尔体积的实 验值是106,94 em moH). 解 查附录得Antoine常数:A=6.8146,B=2151.63,C-36.24 临界参数T=425.4K,P=3.797MPa,w=0.193 修正的Rackett方程常数:a=0.2726,B-0.0003 hPs-6.8146- -3624+7→p=0504P。 215163 由软件计算知V1=103.0193cm3mol',V"=4757.469cm3mol- 利用Racket方程P=(RI.IBe+Bl-Tn V =107.01cm'mol 6=ZR7_0242x8314x405.6g1cm 1128×105 6=-2828-2914×100%=-295% 29.14 v=29.14cm mol,V=28.60cm mol V=x)=28.28(cm'mol) -0.0643 5.试计算一个125cm的刚性容器,在50℃和18.745NMPa的条件下能贮存甲烷多少克(实验值是17克)? 分别比较理想气体方程、三参数对应态原理和PR方程的结果。 解:查出T=190.58K,P=4.604MPa=-0.01l )利用库想气体状态方程Pr=n月=得=082一m=1g (2)三参数对应态原理 Z=Z(P.T)+@Z'(P,T) -16w B=1875=4071 4.604 查表得20=0.8846Z=0.2562 Z=0.8864+0.011×0.2562=0.8892
9 m=0.5/2.198*44=10.01 (kg) 3. 用 virial 方程估算 0.5MPa,373.15K 时的等摩尔甲烷(1)-乙烷(2)-戊烷(3)混合物的摩尔体 积 ( 实验值 5975cm3mol-1 ) 。已知 373.15K 时 的 virial 系数如下(单位: cm3 mol-1 ), B11 = −20 , B22 = −241, B33 = −621, B12 = −75 , B13 = −122 , B23 = −399 。 解:混合物的 virial 系数是 230.44 9 20 241 621 2 75 2 122 2 399 3 2 1 2 1 2 2 2 3 2 3 2 3 1 3 1 2 2 3 2 1 2 2 1 3 1 3 1 = − − − − − − − = = = + + + + + = = B y y Bi j y B y B y B y y B y y B y y B i j i j V = RT / P+ B = 8.314373.15/0.5− 230.44 = 5974.298 cm3 mol-1 4. 用Antoine方程计算正丁烷在50℃时蒸汽压;用PR方计算正丁烷在50℃时饱和汽、液相摩尔体积(用 软件计算);再用修正的Rackett方程计算正丁烷在50℃时饱和液相摩尔体积。(液相摩尔体积的实 验值是106.94cm3 mol-1)。 解:查附录得Antoine常数:A=6.8146, B=2151.63,C= -36.24 临界参数Tc=425.4K,Pc=3.797MPa,ω=0.193 修正的Rackett方程常数:α=0.2726,β=0.0003 − + = − T P S 36.24 2151.63 ln 6.8146 P MPa S = 0.504 由软件计算知 3 1 103.0193 − V = cm mol sl , 3 1 4757.469 − V = cm mol sv 利用Rackett方程 ( ) 2 / 7 1 (1 ) ( / ) 1 Tr C C r sl V RT P T + − = + − 3 1 107.01 − V = cm mol sl 3 6 3 3 ( , ) 3 0.242 8.314 405.6 / 11.28 10 28.28 29.14 100% 2.95% 29.14 29.14 / , 28.60 / . 28.28( / ) 0.0643 R r r R C r C C SL L SL R T T C r Z RT V g cm p V cm mol V cm mol V V Z cm mol = = − = = − = = = = − 5. 试计算一个125cm3的刚性容器,在50℃和18.745MPa的条件下能贮存甲烷多少克(实验值是17克)? 分别比较理想气体方程、三参数对应态原理和PR方程的结果。 解:查出Tc=190.58K,Pc=4.604MPa,ω=0.011 (1) 利用理想气体状态方程 PV = nRT m g RT PV n = = 0.872 = 14 (2) 三参数对应态原理 查表得 Z 0=0.8846 Z 1=0.2562 ( ) ( ) 1 , , o Z Z P T Z P T = + r r r r 323.15 18.745 1.696 4.071 190.58 4.604 T P r r = = = = Z = + = 0.8864 0.011 0.2562 0.8892

V-ZRT_0.892×8.314×323.15-1274em/mol 18.745 m=15.7g (3)利用PR方程计算得V=122.7268cm31mol一n=1.02→m=16.3g 6.展开三元混合物的第二virial系数B,说明下标相同的virial系数和下标不同的virial系数的意义。 解:B=之立9,马,=疗品+品,+听品+2B+2+2,其中,涉及了下标相 同的virial系数有B,B2,B,它们表示两个相同分子间的相互作用:下标不同的virial系数有B2,B2,B1 它们表示两个不同分子间的相互作用。 7.现将压力为10Pa和温度为25℃的氯气100L压缩到1L,其温度为-110℃,试求终了压力。 解:查到氮气的有关临界参数为:T,=126.2K,P.=3.394MPa,当T-25℃,p=105Pa时,可将氮气视 作理想气体,其摩尔体积为 V-RT-8314x298-0.0248m1mo0 103 则氨气的总摩尔量为 1 1 n=010248024smo0n=010248=024sa 压缩终了时氨气的摩尔体积为 r=001+(0248)=0.00248m1mo0 现使用R-K方程计算终了压力: RT P-V-6-TV(V+b) 其中 a=042748R7 =0.24748×8314×1262 -=1.558 3.394×10° 6=008664RL=008648314x1262=268x10 P. 3.394×106 8314×163 1.558 则 p=248-368X10a63×248x10x248+2.68x10=43.4×10Pa) 8.用R-K方程求294.3K和1.013×10kPa下甲烷的摩尔体积。已知实验值为 V(1.013×10°Pa,294.3K)=2370.27cm2/mol 解:查附表知甲烷的特性参数为
10 (3) 利用PR方程计算得 V 122.7268cm / mol n 1.02 m 16.3g 3 = = = 6. 展开三元混合物的第二virial系数B,说明下标相同的virial系数和下标不同的virial系数的意义。 解: = = = = ij i j B yi y jB 3 1 3 1 3 1 2 12 2 3 23 3 1 31 2 2 3 2 1 2 2 y1 B + y B + y B + 2y y B + 2y y B + 2y y B ,其中,涉及了下标相 同的virial系数有 1 2 3 B , B , B ,它们表示两个相同分子间的相互作用;下标不同的virial系数有 12 23 31 B , B , B , 它们表示两个不同分子间的相互作用。 7. 现将压力为 5 10 Pa 和温度为 25℃的氮气 100L 压缩到 1L,其温度为−110 ℃,试求终了压力。 解:查到氮气的有关临界参数为: 126.2 , 3.394 , T K p MPa c c = = 当 T=25℃,p=105Pa 时,可将氮气视 作理想气体,其摩尔体积为 3 5 8.314 298 0.0248( / ) 10 RT V m mol P = = = 则氮气的总摩尔量为 1 0.1 0.0248 ( ) 0.248 n mol = = 1 0.1 0.0248 ( ) 0.248 n mol = = 压缩终了时氮气的摩尔体积为 1 3 0.001 ( ) 0.000248( / ) 0.248 V m mol = = 现使用 R-K 方程计算终了压力: 0.5 ( ) RT a p V b T V V b = − − + 其中 2 2.5 2 2.5 6 (8.314) (126.2) 0.42748 0.24748 1.558 3.394 10 c c R T a p = = = 5 6 8.314 126.2 0.08664 0.08664 2.68 10 3.394 10 c c RT b p − = = = 则 5 5 0.5 5 5 8.314 163 1.558 43.4 10 ( ) (24.8 3.68) 10 (163) 24.8 10 (24.8 2.68) 10 p Pa − − − = − = − + 8. 用 R-K 方程求 294.3K 和 1.013 103kPa 下甲烷的摩尔体积。已知实验值为 6 3 V Pa K cm mol (1.013 10 ,294.3 ) 2370.27 / = 解:查附表知甲烷的特性参数为 0.8892 8.314 323.15 3 127.4 / 18.745 ZRT V cm mol P = = = 125 0.9812 127.4 Vt n mol V = = = m g =15.7

T.=190.6K,p.=4.600MPa,1w=0.008 (I)应用R-K方程计算甲烷的摩尔体积。己知R-K方程为 RT P=Y-6-TV(V+b) (1) 将式()方程两边乘以W-创 V-b=RT_a(V-b) P PTV(V+b) 将上式写成迭代格式 四+pn+0 a(v-b) a=0.42748RT2 =0.427488.314x90.6=322k:m.K5mor P 4.6×103 b=0.08686RZ=0.08664×8314×1906 =0.02985m6.km0- 46×103 -83142943+02985-1oBx23i+0298 3222(W-0.02985) 1013 41=2.4453- 0.1854(y-0.02985) V(W+0.02985) 取6=RT-8314x2943=24154m2.0r 1013 -2.4453 0185424154-002985)-23704m2.mof 2.4154(2.4154+0.02985) V2=2.4453- 0.1854(2.3704-0.02985) =23690m3.km01F 2.3704(2.3704+0.02985) 0.18542.3690-0.02985 -2.4453 -2.3690m2.kmor 2.3690(2.3690+0.02985) V=2.3690m3.kmol 则在T=294.3K和p=1.013×103kPa时摩尔体积的计算值与实验值的相对百分偏差为 2370.27-2369×100%=-0.054 2370.27 9.工程设计中需要乙烷在3446kPa和93.33℃下的体积数据,已查到的文献值为Q.02527m/kg,试应 用下列诸方法进行核算: (1)两参数压缩因子法: (2)三参数压缩因子法: (3)S-R-K方程法:
11 190.6 , 4.600 , 0.008 T K p MPa w c c = = = (1)应用 R-K 方程计算甲烷的摩尔体积。已知 R-K 方程为 0.5 ( ) RT a p V b T V V b = − − + (1) 将式(1)方程两边乘以 将上式写成迭代格式 2 2.5 2 2.5 6 0.5 2 3 (8.314) (190.6) 0.42748 0.42748 3222 4.6 10 c a c R T a kP m K kmol p − = = = 6 1 3 8.314 190.6 0.08686 0.08664 0.02985 4.6 10 c c RT b m kmol p − = = = 取 则在 T=294.3K 和 p=1.013 3 10 kPa 时摩尔体积的计算值与实验值的相对百分偏差为 9. 工程设计中需要乙烷在 3446kPa 和 93.33℃下的体积数据,已查到的文献值为 0.02527 3 m kg / ,试应 用下列诸方法进行核算: (1) 两参数压缩因子法; (2) 三参数压缩因子法; (3) S-R-K 方程法; P (V − b ) PT V(V b) a(V b ) P RT V b / + − − = − 1 2 ( ) PT V (V b) a V b b P RT V k k / k k + − + = + − 1 1 2 3 1 0 8.314 294.3 2.4154 1013 RT V m kmol P − = = = ( ) ( ) 1 1/ 2 8.314 294.3 3222 0.02985 0.02985 1013 1013 294.3 0.02985 k k k k V V V V + − = + − + ( ) ( ) 1 0.1854 0.02985 2.4453 0.02985 k k k k V V V V + − = − + ( ) ( ) 3 1 1 0.1854 2.4154 0.02985 2.4453 2.3704 2.4154 2.4154 0.02985 V m kmol − − = − = + ( ) ( ) 3 1 2 0.1854 2.3704 0.02985 2.4453 2.3690 2.3704 2.3704 0.02985 V m kmol − − = − = + ( ) ( ) 3 1 3 0.1854 2.3690 0.02985 2.4453 2.3690 2.3690 2.3690 0.02985 V m kmol − − = − = + 3 1 V m kmol 2.3690 − = 2370.27 2369 100% 0.054 2370.27 − =

(4)PR方程法: (5)Berthlot维里方程法。 解:查附录2的表2-1得到乙烷的特性常数为 T=305.4K,p.=4.884MPa,=0.098,M=30.070 (1)两参数压缩因子法 由T=273.15+93.33=366.48(K),p=3446kPa和T,P.的数值可确定对比参数如下: P4.884×10 =0.71 由T=1.20,p.=0.71查图得 Z-=0.86 因为pV=ZRT,则 r=ZRT_086×8314×36648 D 3446×10 -0.00076(m21mol)=0.02527(m2/kg 由上可知,乙烷体积的计算值与文献值相符。 (2)三参数压缩因子法 Pit2er提出的三参数压缩因子式为 Z=Z+0Z) (1) 由T,=1.20,p,=0.71,查图2-4和图2-5,得 Z0-0.85 70=0.09 将00.098和Z0,Z之值代入式(1),得 2Z-0.85×0.098×0.09-0.8588 则乙烷在3446kPa和93.33℃下的体积为 V=ZR7_08588x8314×36648 D 3446×10 0.000759(m21mol)=0.02524(m21kg) 计算值与文献值的相对百分偏差为 6-002524-0.0252×100%=-0.12% 0.02527 (3)S-R-K方程法 已知S-R-K方程为 。 a(T) (1)
12 (4) P-R 方程法; (5) Berthlot 维里方程法。 解:查附录 2 的表 2-1 得到乙烷的特性常数为: 305.4 , 4.884 , 0.098, 30.070 T K p MPa M c c = = = = (1) 两参数压缩因子法 由 T=273.15+93.33=366.48(K),p=3446kPa 和 T c , c p 的数值可确定对比参数如下: 366.48 1.20, 305.4 r c T T T = = = 6 6 3.446 10 0.71 4.884 10 r c p p p = = = 由 T r =1.20, r p =0.71 查图得 Z=0.86 因为 pV=ZRT,则 3 0.86 8.314 366.48 3446 10 ZRT V p = = =0.00076( 3 m mol / )=0.02527( 3 m kg / ) 由上可知,乙烷体积的计算值与文献值相符。 (2) 三参数压缩因子法 Pitzer 提出的三参数压缩因子式为 (0) (1) Z Z Z = + (1) 由 T r =1.20, r p =0.71,查图 2-4 和图 2-5,得 (0) Z =0.85 (1) Z =0.09 将 =0.098 和 (0) Z , (1) Z 之值代入式(1),得 Z=0.85 0.098 0.09=0.8588 则乙烷在 3446kPa 和 93.33℃下的体积为 3 0.8588 8.314 366.48 3446 10 ZRT V p = = =0.000759( 3 m mol / )=0.02524( 3 m kg / ) 计算值与文献值的相对百分偏差为 0.02524 0.02527 100% 0.12% 0.02527 − = = − (3)S-R-K 方程法 已知 S-R-K 方程为 ( ) ( ) RT a T p V b V V b = − − + (1)