
第8章化学反应平衡 一、是否题 1.化学平衡常数在低压下可以视为一个仅与温度有关的常数:而在高压下,T和p应该对化学平衡常 数均有影响。 错。化学平衡常数仅是温度的函数,与压力无关。 2,很明显,反应物的浓度或压力可以使化学平衡移动,所以就可以改变平衡常数, 错。化学平衡常数仅是温度的函数 3.改变反应温度,不但可以使化学平衡移动,而且可以改变平衡常数。 对。 4.化学反应的△G是该反应进行方向的判据。 错。应该是△G,· 5.化学反应的△G是该反应在标准状态下进行方向的判据。当化学反应Gbs函数的变化大于零, 则该反应是不可能进行的。 6.初始时系统内存在的CH、,0、C0和H分别是2mol、1mol、1mol和4mol,当发生了心0) 反应进度的气相反应CH,+H,OCO+3H,后,则系统内物质的量不会变化。 错。可以导出系统内总物质的量与反应进度的关系是∑2=8+2£,所以,系统的总物质的量是 增加的。 7.若化学平衡常数随着温度的升高而升高,则反应的标准培变化△H°为正值 对.因为dn)- (drJ厂RT。 8.无论在T,p一定,或U,V一定,或T,V一定条件下,对于封闭系统的平衡状态,总是有G为 极小值。 错。对于封闭系统的平衡状态,在U,V一定条件下,S是极大值:U,V一定条件下,A是极大 值:T,p一定条件下,G是极小值。 二、计算题 1,一容器中开始有物质的量为的水蒸气,分解成为氢气和氧气的反应进度为,求各组分的物 质的量和摩尔分数。 解:反应式为H,O一H2+0.5O2,各组分的物质的量和摩尔分数可以表示如下。 82
82 第 8 章 化学反应平衡 一、是否题 1.化学平衡常数在低压下可以视为一个仅与温度有关的常数;而在高压下,T 和 p 应该对化学平衡常 数均有影响。 错。化学平衡常数仅是温度的函数,与压力无关。 2. 很明显,反应物的浓度或压力可以使化学平衡移动,所以就可以改变平衡常数。 错。化学平衡常数仅是温度的函数。 3. 改变反应温度,不但可以使化学平衡移动,而且可以改变平衡常数。 对。 4. 化学反应的 0 G 是该反应进行方向的判据。 错。应该是 Gt 。 5. 化学反应的 0 G 是该反应在标准状态下进行方向的判据。当化学反应 Gibbs 函数的变化大于零, 则该反应是不可能进行的。 对。 6. 初始时系统内存在的 CH4、H2O、CO 和 H2分别是 2mol、1mol、1mol 和 4mol,当发生了 ( 0) 反应进度的气相反应 4 2 2 CH H O CO H + +3 后,则系统内物质的量不会变化。 错。可以导出系统内总物质的量与反应进度的关系是 8 2 i n = + ,所以,系统的总物质的量是 增加的。 7. 若化学平衡常数随着温度的升高而升高,则反应的标准焓变化 0 H 为正值 对。因为 0 2 ln a d K H dT RT = 。 8. 无论在 T,p 一定,或 U,V 一定,或 T,V 一定条件下,对于封闭系统的平衡状态,总是有 G 为 极小值。 错。对于封闭系统的平衡状态,在 U,V 一定条件下,S 是极大值;U,V 一定条件下,A 是极大 值;T,p 一定条件下,G 是极小值。 二、计算题 1.一容器中开始有物质的量为 n0的水蒸气,分解成为氢气和氧气的反应进度为 ,求各组分的物 质的量和摩尔分数。 解:反应式为 2 2 2 H O H O + 0.5 ,各组分的物质的量和摩尔分数可以表示如下
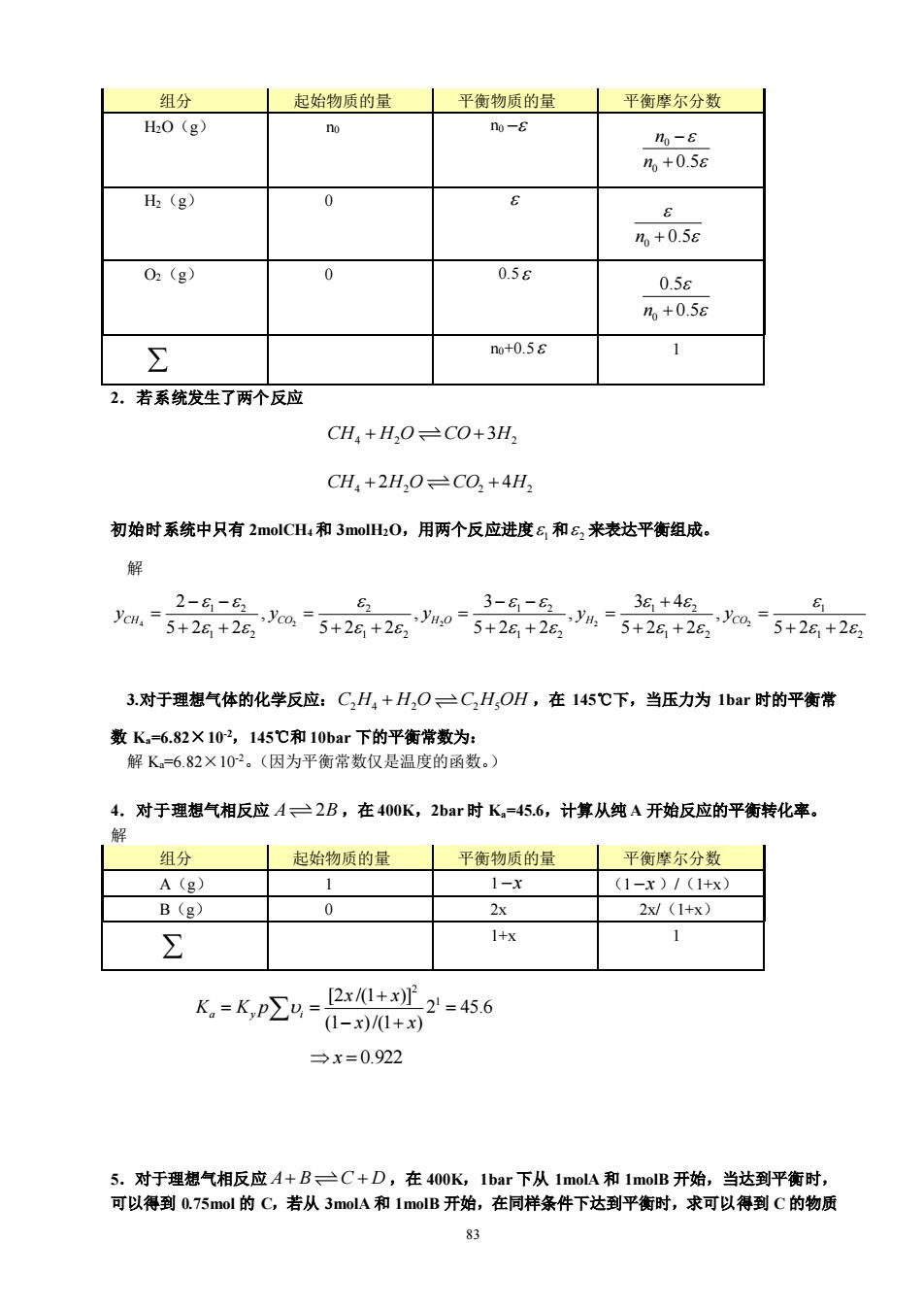
组分 起始物质的量 平衡物质的量 平衡摩尔分数 H0(g) no no-8 1。-£ %+0.58 H2 (g) 0 m,+0.5e 0(g) 0 0.58 0.5s m+0.58 6 m+0.58 1 2.若系统发生了两个反应 CH.+H,O、=CO+3H2 CH4+2H,0=C0+4H: 初始时系统中只有2 molCH和3mlH,0,用两个反应进度6和6,来表达平衡组成。 2-8-8, 3-8-8, 38+48, a5+2+26m5+26+2,05+2+2%5+2+2m3+2g+2写 3.对于理想气体的化学反应:CH,+H2O=CH,OH,在145℃下,当压力为1bar时的平衡常 数K,=6.82X102,145℃和10har下的平衡常数为 解K=6.82×102。(因为平衡常数仅是温度的函数。 4.对于理想气相反应A2B,在400K,2bar时K=45.6,计算从纯A开始反应的平衡转化率。 解 组分 丨起始物质的量 」平衡物质的量 平衡摩尔分数 A (g) 1 1-x (1-x)/(1+x) B (g) 0 2x 2x/(1+x) ∑ 1+x 1 k=K2-2-86 →x=0.922 5.对于理想气相反应A+BC+D,在400K,1bar下从1molA和1molB开始,当达到平衡时, 可以得到Q75mol的C,若从3mol4和1molB开始,在同样条件下达到平衡时,求可以得到C的物质
83 组分 起始物质的量 平衡物质的量 平衡摩尔分数 H2O(g) n0 n0 − 0 0 0.5 n n − + H2(g) 0 0 n 0.5 + O2(g) 0 0.5 0 0.5 n 0.5 + n0+0.5 1 2.若系统发生了两个反应 4 2 2 CH H O CO H + +3 4 2 2 2 CH H O CO H + + 2 4 初始时系统中只有 2molCH4 和 3molH2O,用两个反应进度 1 和 2 来表达平衡组成。 解 4 2 2 2 2 1 2 2 1 2 1 2 1 1 2 1 2 1 2 1 2 1 2 2 3 3 4 , , , , 5 2 2 5 2 2 5 2 2 5 2 2 5 2 2 CH CO H O H CO y y y y y − − − − + = = = = = + + + + + + + + + + 3.对于理想气体的化学反应: C H H O C H OH 2 4 2 2 5 + ,在 145℃下,当压力为 1bar 时的平衡常 数 Ka=6.82×10-2,145℃和 10bar 下的平衡常数为: 解 Ka=6.82×10-2。(因为平衡常数仅是温度的函数。) 4.对于理想气相反应 A B2 ,在 400K,2bar 时 Ka=45.6,计算从纯 A 开始反应的平衡转化率。 解 组分 起始物质的量 平衡物质的量 平衡摩尔分数 A(g) 1 1 −x (1−x )/(1+x) B(g) 0 2x 2x/(1+x) 1+x 1 2 1 [2 /(1 )] 2 45.6 (1 ) /(1 ) a y i x x K K p x x + = = = − + =x 0.922 5.对于理想气相反应 A B C D + + ,在 400K,1bar 下从 1molA 和 1molB 开始,当达到平衡时, 可以得到 0.75mol 的 C,若从 3molA 和 1molB 开始,在同样条件下达到平衡时,求可以得到 C 的物质
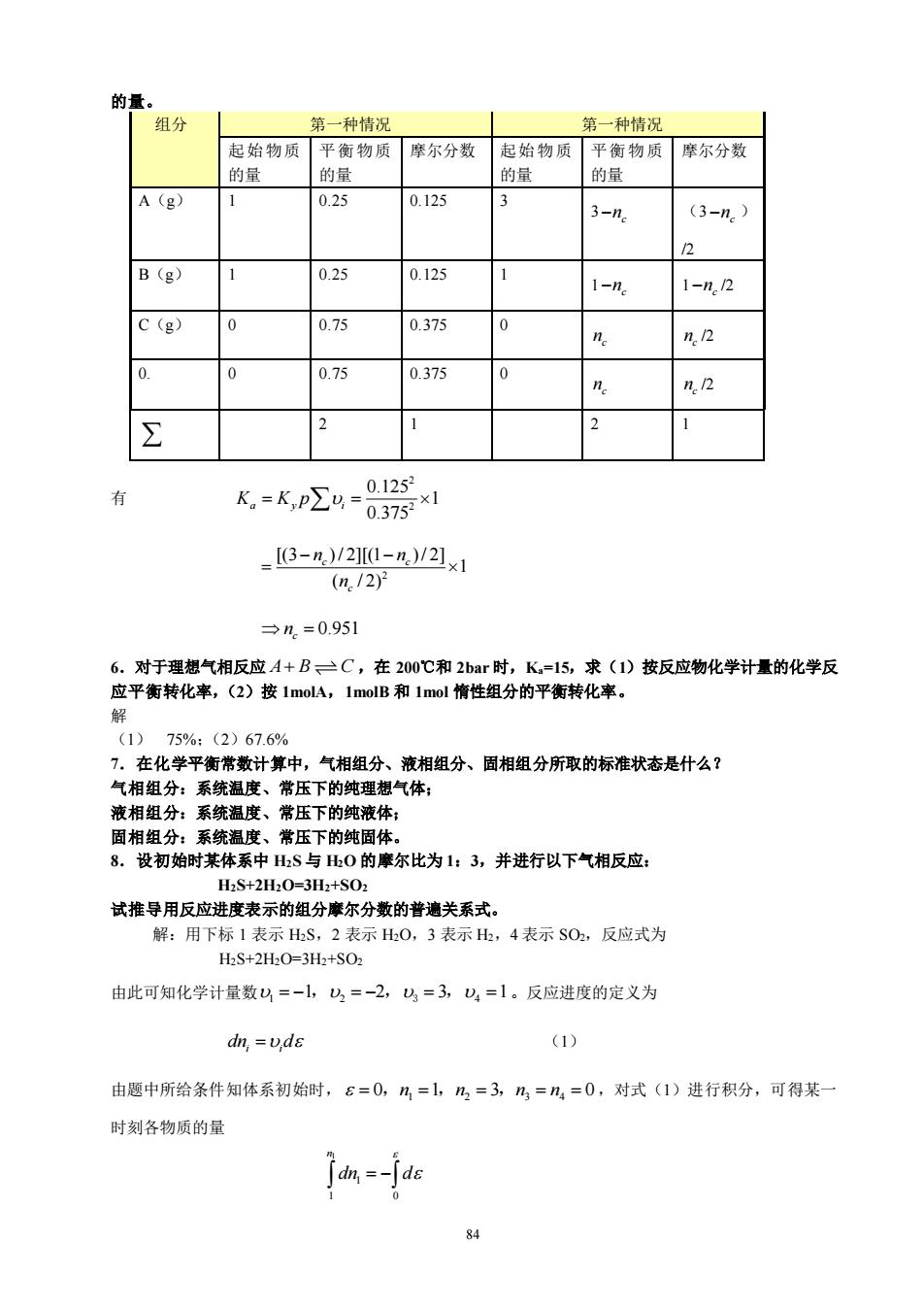
的量。 组分 第一种情况 第一种情况 起始物质平衡物质 摩尔分数 起始物质 平衡物质 摩尔分数 的量 的量 的 的量 A(g) 0.25 0.125 3-Me (3-n.) B (g) 0.25 0.125 -n 1-n2 C(g) 0 0.75 0.375 n n.2 0.75 0.375 n.2 2 1 -p2-8器 _3-n)/2I0-n/2x1 (n./2 →n=0.951 6.对于理想气相反应A+B三C,在200℃和2bar时,K=15,求(1)按反应物化学计量的化学反 应平衡转化率,(2)按1molA,1molB和1mol惰性组分的平衡转化率。 75%:(2)67.6% 7.在化学平衡常数计算中,气相组分、液相组分、固相组分所取的标准状态是什么? 气相组分:系统温度、常压下的纯理想气体; 液相组分:系统温度、常压下的纯液体: 固相组分:系统温度、常压下的纯固体。 8。设初始时某体系中山S与0的摩尔比为1:3,并进行以下气相反应 H2S+2H2O=3H2+SO2 试推导用反应进度表示的组分摩尔分数的普遗关系式。 解:用下标1表示HS,2表示H0,3表示出,4表示S02,反应式为 HS+2H,0=3H2+SO2 由此可知化学计量数=-1,山2=-2,=3,U=1。反应进度的定义为 dn,=vds (1) 由题中所给条件知体系初始时,6=0,2=1,2,=3,乃,=n=0,对式(1)进行积分,可得某 时刻各物质的量 jan=-Jds
84 的量。 组分 第一种情况 第一种情况 起始物质 的量 平衡物质 的量 摩尔分数 起始物质 的量 平衡物质 的量 摩尔分数 A(g) 1 0.25 0.125 3 3 c −n (3 c −n ) /2 B(g) 1 0.25 0.125 1 1 c −n 1 c −n /2 C(g) 0 0.75 0.375 0 c n c n /2 0. 0 0.75 0.375 0 c n c n /2 2 1 2 1 有 2 2 0.125 1 0.375 K K p a y i = = 2 [(3 ) / 2][(1 ) / 2] 1 ( / 2) c c c n n n − − = 0.951 c = n 6.对于理想气相反应 A B C + ,在 200℃和 2bar 时,Ka=15,求(1)按反应物化学计量的化学反 应平衡转化率,(2)按 1molA,1molB 和 1mol 惰性组分的平衡转化率。 解 (1) 75%;(2)67.6% 7.在化学平衡常数计算中,气相组分、液相组分、固相组分所取的标准状态是什么? 气相组分:系统温度、常压下的纯理想气体; 液相组分:系统温度、常压下的纯液体; 固相组分:系统温度、常压下的纯固体。 8.设初始时某体系中 H2S 与 H2O 的摩尔比为 1:3,并进行以下气相反应: H2S+2H2O=3H2+SO2 试推导用反应进度表示的组分摩尔分数的普遍关系式。 解:用下标 1 表示 H2S,2 表示 H2O,3 表示 H2,4 表示 SO2,反应式为 H2S+2H2O=3H2+SO2 由此可知化学计量数 1 2 4 = − = − = = 1 2 3 1 , , 3 , 。反应进度的定义为 i i dn d = (1) 由题中所给条件知体系初始时, 1 2 3 4 = = = = = 0 1 3 0 ,n n n n , , ,对式(1)进行积分,可得某一 时刻各物质的量 1 1 1 0 n dn d = −

积分得 m=1-e 同理,可得2=3-26,n=36,n4=6。总摩尔数为n=∑4=4+6,因此用反应进度表示的组 分摩尔分数的普遍关系式为 y=1-6)4+6),为=(3-2s)4+6) 为=3s(4+y4=64+8) 9.已知合成甲烧气的一个反应为 3H2+CO=CH++H2O 该气相反应的平衡问题很重要。为了进行研究,需要把平衡常数K表示为反应进度的函数。如果初始 时混合物中与C0的率尔比为4 1山,试推导该关系式。 解:用小标1代表,2代表C0,3代表CH4,4代表HO,反应式为 3H:+CO-CH+H2O 由此可知化学计量数山=-3,凸2=-1,山=U,=1。各物质量的变化与反应进度的关系式为 dn,=vds (1) 由题中所给条件,知体系初始时,8=0,n=4,2=1,n=n4=0,若达到平衡时反应进度为8, 则对式(1)积分可得各物质的量 ∫dm,=-3de %=4-38 同理,可得h2=1-6。乃=几=6,。总摩尔数n=∑n,=5-26。,平衡时各物质的摩尔分数为 片=(4-36)/5-28b=(1-6)5-28)b为=y4=/5-28) 本题研究的反应是气相反应,纯物质的标准态逸度取°=101.325kPa,平衡常数表达式为 K=Π(f/f°)"=Π0y4p/101.325) (2) 将化学计量数及用反应进度表示的平衡组成代入式(2),得 K=01325站c6-2s (4)'4(4-35,)'0-6,) 10.已知在35℃,101.325kPa下达到平衡时N0:变为N0的解离分率为Q27,此条件下气体可当作 理想气体处理。 (1)试求该气相反应的平衡常数K: (2)计算在35℃,13.33kPa下达到平衡时的反应进度6: 85
85 积分得 1 n = −1 同理,可得 2 3 4 n n n = − = = 3 2 3 , , 。总摩尔数为 4 i i n n = = + ,因此用反应进度表示的组 分摩尔分数的普遍关系式为 1 2 y y = − + = − + (1 ) /(4 ) (3 2 ) /(4 ) , 3 4 y y = + = + 3 /(4 ) /(4 ) , 9.已知合成甲烷气的一个反应为 3H2+CO=CH4+H2O 该气相反应的平衡问题很重要。为了进行研究,需要把平衡常数 K 表示为反应进度的函数。如果初始 时混合物中 H2与 CO 的摩尔比为 4:1,试推导该关系式。 解:用小标 1 代表 H2,2 代表 CO,3 代表 CH4,4 代表 H2O,反应式为 3H2+CO=CH4+H2O 由此可知化学计量数 1 2 4 = − = − = = 3 1 1 , , 3 。各物质量的变化与反应进度的关系式为 i i dn d = (1) 由题中所给条件,知体系初始时, 1 2 3 4 = = = = = 0 4 1 0 ,n n n n , , ,若达到平衡时反应进度为 e , 则对式(1)积分可得各物质的量 1 1 1 0 3 n e dn d = − 得 1 n = −4 3 同理,可得 2 3 4 1 e e n n n = − = = , 。总摩尔数 5 2 i e i n n = = − ,平衡时各物质的摩尔分数为 1 2 3 4 (4 3 ) /(5 2 ) (1 ) /(5 2 ) /(5 2 ) e e e e e y y y y = − − = − − = = − , , 本题研究的反应是气相反应,纯物质的标准态逸度取 101.325 i f kPa = ,平衡常数表达式为 ˆ ˆ ( / ) ( /101.325) i i i i i i i i K f f y p = = (2) 将化学计量数及用反应进度表示的平衡组成代入式(2),得 2 2 2 3 4 3 3 1 2 ˆ ˆ 101.325 (5 2 ) ( ) ˆ ˆ ( ) (4 3 ) (1 ) e e e e K p − = − − 10.已知在 35℃,101.325kPa 下达到平衡时 N2O4变为 NO2的解离分率为 0.27,此条件下气体可当作 理想气体处理。 (1) 试求该气相反应的平衡常数 K; (2) 计算在 35℃,13.33kPa 下达到平衡时的反应进度 e ;

(3)已知温度为318K和298K时,N,0:解离的平衡常数分别为Q.664和0.141,试计算在此温 度范围内的平均反应热。 解:用下标1表示NO4,2表示NO2,化学反应式为 N20=2 NO2 得到4=-l,山2=2。初始时,6=0,并设n=l,n2=0,则达到平衡时g=6,n1=1-8。,n=26, 1+5,平衡时的摩尔分数为 y=(1-6,)/1+6,b2=261+6) (1) 由于气体可看作理想气体处理,并取参考态压力为101.325kP,于是化学反应平衡参数为 K=Πo132s”=101325 (2) 将式(1)代入式(2),得用反应进度表示的反应平衡常数表达式为 D 42 p462 K=1013250+6,X0-6)1o13250- (3) (1)由于达到平衡时N,0,变为NO,的解离分率为0.27,即 解离分率=(1-n)1=6。-0.27 (4) 将式(4)及已知的压力数据代入式(3),得反应平衡常数值为 K=0.315 (2)由式(3)得 8=4p101325+K" (5) 由于平衡常数K仅与温度有关,而与压力无关,于是当压力变为1333狄Pa时,由式(5)便可求 得平衡反应进度为 £.=0.612 (3)平均反应热可由它与化学反应平衡常数的关系求得 -h克=61iw1m 1,设已知甲醇可以由C0加H按下列反应制取 CO(g)+2H,(g)CH,OH(g) 且反应是在400K,101.325kPa下进行的。通过分析,从反应器得到的平衡气相产品中,H2的含量为 40%(摩尔百分数)。 假设为理想气体,试确定平衡产品中 C0与CH60H的组成: (2)如果反应在500K,101.325kPa下进行,初始物料与(1)相同,能否希塑平衡产物中的 H的组成大于或小于40%?(设气体为理想气体.) 已知:上述反应在400K时K=152,△H°=-94.54kJ。 解:用小标1表示CO,2表示,3表示CHOH,由反应式
86 (3) 已知温度为 318K 和 298K 时,N2O4解离的平衡常数分别为 0.664 和 0.141,试计算在此温 度范围内的平均反应热。 解:用下标 1 表示 N2O4,2 表示 NO2,化学反应式为 N2O4=2 NO2 得到 1 2 = − = 1 2 , 。初始时, = 0 ,并设 n1=1,n2=0,则达到平衡时 e = ,n1=1 e − ,n2=2 , n=1+ e ,平衡时的摩尔分数为 1 2 (1 ) /(1 ) 2 /(1 ) e e e e y y = − + = + , (1) 由于气体可看作理想气体处理,并取参考态压力为 101.325kPa,于是化学反应平衡参数为 2 2 1 ( ) 101.325 101.325 i i i py py K y = = (2) 将式(1)代入式(2),得用反应进度表示的反应平衡常数表达式为 2 2 2 4 4 101.325 (1 )(1 ) 101.325 (1 ) e e e e e p p K = = + − − (3) (1) 由于达到平衡时 N2O4 变为 NO2 的解离分率为 0.27,即 解离分率=(1-n1)/1= e =0.27 (4) 将式(4)及已知的压力数据代入式(3),得反应平衡常数值为 K=0.315 (2) 由式(3)得 1/ 2 ( ) 4 /101.325 e K p K = + (5) 由于平衡常数 K 仅与温度有关,而与压力无关,于是当压力变为 13.33kPa 时,由式(5)便可求 得平衡反应进度为 0.612 e = (3) 平均反应热可由它与化学反应平衡常数的关系求得 1 2 1 1 2 2 ln 61.041 / ( ) RTT K H kJ mol T T K = = − 11.设已知甲醇可以由 CO 加 H2 按下列反应制取 2 3 CO g H g CH OH g ( ) 2 ( ) ( ) + → 且反应是在 400K,101.325kPa 下进行的。通过分析,从反应器得到的平衡气相产品中,H2 的含量为 40%(摩尔百分数)。 (1) 假设为理想气体,试确定平衡产品中 CO 与 CH3OH 的组成; (2) 如果反应在 500K,101.325kPa 下进行,初始物料与(1)相同,能否希望平衡产物中的 H2 的组成大于或小于 40%?(设气体为理想气体。) 已知:上述反应在 400K 时 K=1.52, H kJ 94.54 = − 。 解:用小标 1 表示 CO,2 表示 H2,3 表示 CH3OH,由反应式

CO(g)+2H,(g)->CH,OH(g) 知化学计量数)=-1,),=-2,U3=1。对理想气体,平衡常数为 k-Πo2s”=产o125 (1) 吃p 将y3=1-y1-y2代入式(1),得 K-1(0125或=1+K0p0125 1-y2 (2) 将y2=0.40,K=1.52,p=101.325kPa代入,得到C0及CHOH的组成为 y1=0.480,y3=1-y1-y3=0.118 (2)由于反应热△H小于零,这是一个放热反应,当反应温度升高时,平衡常数K将减小,不 利于反应向正方向进行,即平衡向左移动,因此平衡产物中的H2的组成将大于40%(摩尔分数)。 87
87 2 3 CO g H g CH OH g ( ) 2 ( ) ( ) + → 知化学计量数 1 2 3 = − = − = 1 2 1 , , 。对理想气体,平衡常数为 3 2 2 1 2 101.325 ( ) ( ) 101.325 i i i py y K y y p = = (1) 将 y3=1-y1-y2 代入式(1),得 1 2 2 2 2 2 1 1 2 2 1 1 101.325 ( ) 1 ( /101.325) y y y K y y y p K y p − − − = = + 或 (2) 将 y2=0.40,K=1.52,p=101.325kPa 代入,得到 CO 及 CH3OH 的组成为 y1=0.480, y3=1-y1-y3=0.118 (2)由于反应热 H 小于零,这是一个放热反应,当反应温度升高时,平衡常数 K 将减小,不 利于反应向正方向进行,即平衡向左移动,因此平衡产物中的 H2 的组成将大于 40%(摩尔分数)