
1物质的状态、溶液和胶体 1.1物质存在的状态 1.1.1气体 气体的最基本特征:可压缩性和扩散性(密度小) 理想气体:1、忽略气体分子之间的作力: 2、忽略气体分子的体积。 或高温、低压的真实气体) 1.1.1.1 理想气体状态方程式(重点) pV=nRT R=8.314kPa-LK1.mol1=8.314J-K1.mo1 例:1-1;1-2
1 物质的状态、溶液和胶体 1.1 物质存在的状态 1.1.1气体 气体的最基本特征:可压缩性和扩散性(密度小) 理想气体:1、忽略气体分子之间的作力; 2、忽略气体分子的体积。 (或高温、低压的真实气体) 1.1.1.1 理想气体状态方程式(重点) pV = nRT R=8.314 kPaLK-1 mol-1 =8.314 JK-1 mol-1 例:1-1;1-2

n 72 R 7 RT M 1.1.1.2气体分压定律(重点) 分压:在恒温条件下混合气体中某组分气体单独占有 与混合气体相同体积时所产生的压力,称为 该组分气体的分压。 nB RT PB= n RT V P总= 混合气体的总压等于混合气体中各组分气体 分压之和。p=p1+p2+… 例:1-3
1.1.1.2 气体分压定律(重点) V n RT p B B = RT pM p RT pV M mRT M m RT pV n = = = = = 分压:在恒温条件下混合气体中某组分气体单独占有 与混合气体相同体积时所产生的压力,称为 该组分气体的分压。 总 总 总 = V n RT p 混合气体的总压等于混合气体中各组分气体 分压之和。p = p1 + p2 + 例:1-3

1.1.2液体 系统:研究的对象。 相:系统中物理性质和化学性质完全相同的均匀部分 称为相,相与相之间存在明显的界面。例: 1.1.2.1液体的蒸气压 液化 气化与蒸发: 相变: 相平衡: 饱和蒸气压: 影响蒸气压的因素:分子间力、温度(蒸气压曲线) 1.1.2.2液体的沸点和凝固点 沸点:液体的蒸气压等于外界压力时系统对应的温度。(此 时系统达气液两相平衡
1.1.2 液体 系统:研究的对象。 相:系统中物理性质和化学性质完全相同的均匀部分 称为相,相与相之间存在明显的界面。例: 1.1.2.1 液体的蒸气压 液化 气化与蒸发: 相变: 相平衡: 饱和蒸气压: 影响蒸气压的因素:分子间力、温度(蒸气压曲线) 1.1.2.2 液体的沸点和凝固点 沸点:液体的蒸气压等于外界压力时系统对应的温度。(此 时系统达气液两相平衡)

凝固点:液体蒸气压等于固体蒸气压时系统对应的温度。 (此时固、液两相达到平衡) 1.1.3固体 1.1.4水的相图:了解DA、DB和DC线 1.1.5等离子体 1.2溶液 1.2.1分散系的概念 1.分散系:一种或几种物质分散在另一种物质中 构成的混合系统。=分散质土分散剂 2.分散系的分类 聚集状态: 分散质粒子直径: d100nm 粗分散系 悬浊液、乳浊液 多相
凝固点:液体蒸气压等于固体蒸气压时系统对应的温度。 (此时固、液两相达到平衡) 1.1.3 固体 1.1.4 水的相图:了解DA、DB和DC线 1.1.5 等离子体 1.2 溶液 1.2.1 分散系的概念 1.分散系:一种或几种物质分散在另一种物质中 构成的混合系统。=分散质+分散剂 2.分散系的分类 聚集状态: 分散质粒子直径: d100nm 粗分散系 悬浊液、乳浊液 多相

1.2.2溶液浓度的表示方法(溶质/溶剂、溶质/溶液) 1.2.2.1物质的量浓度c8= 单位:molL1 基本单元 物质的量:系统中所含基本单元的量。单位:ol 基本单元:系统中原子、离子、分子或它们的特定组合。 2NaOH H2SO4 Na2S04+2H20 (B)n(B)=an(aB) Q 1 (B)=c(B)=an(aB)
1.2.2 溶液浓度的表示方法(溶质/溶剂、溶质/溶液) 1.2.2.1 物质的量浓度cB= 单位:mol·L-1 基本单元 • 物质的量:系统中所含基本单元的量。单位:mol • 基本单元:系统中原子、离子、分子或它们的特定组合。 • 2NaOH + H2SO4 Na2SO4 + 2H2O a M B B a M B c B an aB a c a B n B an aB a n a ( ) ) 1 ( ) ( ) ( ) 1 ( 1 ) ( ) ( ) 1 ( 1 = = = = = V nB

1.2.2.2质量摩尔浓度bB= nB 单位:mol-kg1 mA 1.2.2.3摩尔分数XB= nB单位:1 n nB Xa= na+nB X nA na+ne ∑,=1 1.2.2.4质量分数wB= mB 单位:1,(或mgkg) m
1.2.2.2 质量摩尔浓度bB= 单位:mol·kg-1 1.2.2.3 摩尔分数χB= 单位:1 1.2.2.4 质量分数ωB= 单位:1,(或mg·kg-1 ) m mB A B m n n nB A B B B n n n + = A B A A n n n + = i =1
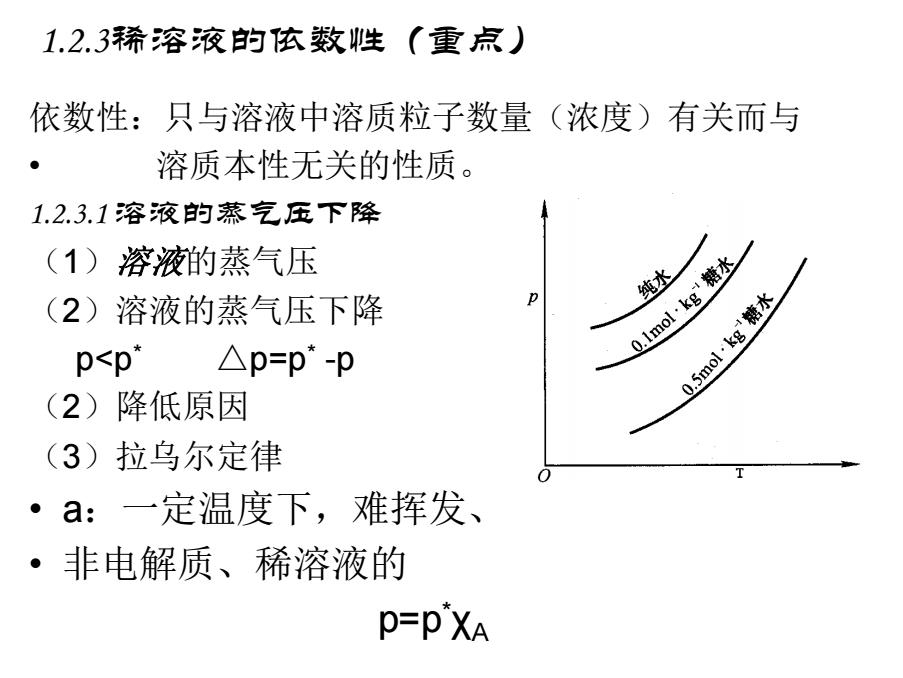
1.2.3稀溶液的依数性(重点) 依数性:只与溶液中溶质粒子数量(浓度)有关而与 溶质本性无关的性质。 1.2.3.1溶液的蒸气压下降 (1)溶液的蒸气压 (2)溶液的蒸气压下降 p 0lmol,kg糖水 纯水 p<p* △p=p*-p 0.5mol~kg糖水 (2)降低原因 (3)拉乌尔定律 ·a:一定温度下,难挥发、 ·非电解质、稀溶液的 P=PXA
1.2.3稀溶液的依数性(重点) 依数性:只与溶液中溶质粒子数量(浓度)有关而与 • 溶质本性无关的性质。 1.2.3.1 溶液的蒸气压下降 (1)溶液的蒸气压 (2)溶液的蒸气压下降 p<p* △p=p* -p (2)降低原因 (3)拉乌尔定律 • a:一定温度下,难挥发、 • 非电解质、稀溶液的 p=p * χA

b:双组分 XA =1-XB ● p=p"-p'XB ● △p=pXB nB C: Xa= nB≈ B= na+ne na malMa =.M4=bgM4×10 mB △p=pbB·MA×l0-3=KbB ·一定温度下,难挥发、非电解质、稀溶液的蒸气压下 降与溶液的质量摩尔浓度成正比,而与溶质的本性无 关
b:双组分 χA =1-χB • p=p* -p * χB • △p= p * χB c: • 一定温度下,难挥发、非电解质、稀溶液的蒸气压下 降与溶液的质量摩尔浓度成正比,而与溶质的本性无 关。 3 10 / − = = = + = A B A B B A A B A B A B B B M b M m n m M n n n n n n p p bB M A = KbB = * −3 △ 10
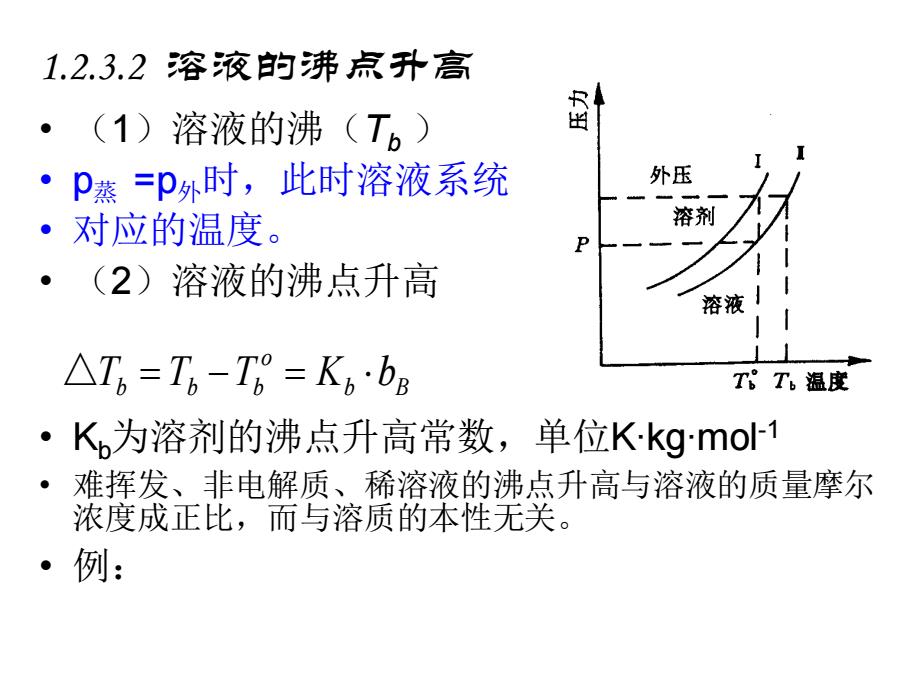
1.2.3.2溶液的沸点升高 (1)溶液的沸(T。) 出 ”P蒸=p外时,此时溶液系统 外压 对应的温度。 溶剂 (2)溶液的沸点升高 溶液1 △T6=T6-T6=K6·bB T8T。温度 ·K为溶剂的沸点升高常数,单位.kg.mo1 ● 难挥发、非电解质、稀溶液的沸点升高与溶液的质量摩尔 浓度成正比,而与溶质的本性无关。 ·例:
1.2.3.2 溶液的沸点升高 • (1)溶液的沸(Tb ) • p蒸 =p外时,此时溶液系统 • 对应的温度。 • (2)溶液的沸点升高 • Kb为溶剂的沸点升高常数,单位K∙kg∙mol-1 • 难挥发、非电解质、稀溶液的沸点升高与溶液的质量摩尔 浓度成正比,而与溶质的本性无关。 • 例: b B o b b b △T = T −T = K b

1.2.3.3溶液的疑固点降低 (1)凝固点(T) P冰=p液体时,系统达固一液两 压 ·相平衡,此时系统对应的温度。力 固体溶剂蒸气压 ,(2)溶液的凝固点降低 溶剂蒸气压 Ps 溶液蒸气压 △r=Ty-Ty=K·bB K为溶剂的凝固点降低常数, 温度 单位K.kg.mol-1 难挥发、非电解质、稀溶液的凝固点降低与溶 液的质量摩尔浓度成正比,而与溶质的本性无 关。 例:植物的防寒抗旱功能
1.2.3.3 溶液的凝固点降低 • (1)凝固点(Tf ) p冰 =p液体时,系统达固-液两 • 相平衡,此时系统对应的温度。 • (2)溶液的凝固点降低 • Kf为溶剂的凝固点降低常数, • 单位K∙kg∙mol-1 • 难挥发、非电解质、稀溶液的凝固点降低与溶 液的质量摩尔浓度成正比,而与溶质的本性无 关。 • 例:植物的防寒抗旱功能 f f B o f f △T =T −T = K b