
普通化学教案 有雯 理学院基础化学教研室
普通化学教案 肖雯 理学院基础化学教研室

授课总学时: 56学时 周 学 4学时 本课程的教学目的和任务: 化学学科是现代生物科学的基础,是现代生物学及农业科学工作 者知识结构的重要组成部分,是高等农林院校的重要基础课。其目的 和任务是使学生在掌握普通化学基本理论、基础知识的同时,掌握辩 证唯物主义的认识观,用科学的思维方式和化学基本理论理解生态农 业,为学生今后的专业课学习及今后的科研、教学、生产工作打下坚 实的化学基础。 本课程的性质、特点及基本要求: 本课程是农业学科学生的重要基础课。掌握化学的基本知识和基 础理论,有利于为将来的科学研究和科学工作打好理论基础:化学学 科的特点是实践性和理论性非常强,所以学习本课程有利于培养学生 的实践能力和动手能力:有利于培养学生科学的思维方法和科学的工 作作风。 学生学完本课程后,应达到如下要求: 1、了解本课程的知识结构体系、研究范畴及在基础科学中的地位。 2、掌握化学基础理论及其应用。 3、了解物质结构的基本理论知识。 4、掌握与农业生产紧密相关的溶液及胶体的有关知识。 5、了解与农业和环境科学有关的重要元素及化合物。 2
2 授 课 总 学 时: 56 学时 周 学 时: 4 学时 本课程的教学目的和任务: 化学学科是现代生物科学的基础,是现代生物学及农业科学工作 者知识结构的重要组成部分,是高等农林院校的重要基础课。其目的 和任务是使学生在掌握普通化学基本理论、基础知识的同时,掌握辩 证唯物主义的认识观,用科学的思维方式和化学基本理论理解生态农 业,为学生今后的专业课学习及今后的科研、教学、生产工作打下坚 实的化学基础。 本课程的性质、特点及基本要求: 本课程是农业学科学生的重要基础课。掌握化学的基本知识和基 础理论,有利于为将来的科学研究和科学工作打好理论基础;化学学 科的特点是实践性和理论性非常强,所以学习本课程有利于培养学生 的实践能力和动手能力;有利于培养学生科学的思维方法和科学的工 作作风。 学生学完本课程后,应达到如下要求: 1、了解本课程的知识结构体系、研究范畴及在基础科学中的地位。 2、掌握化学基础理论及其应用。 3、了解物质结构的基本理论知识。 4、掌握与农业生产紧密相关的溶液及胶体的有关知识。 5、了解与农业和环境科学有关的重要元素及化合物
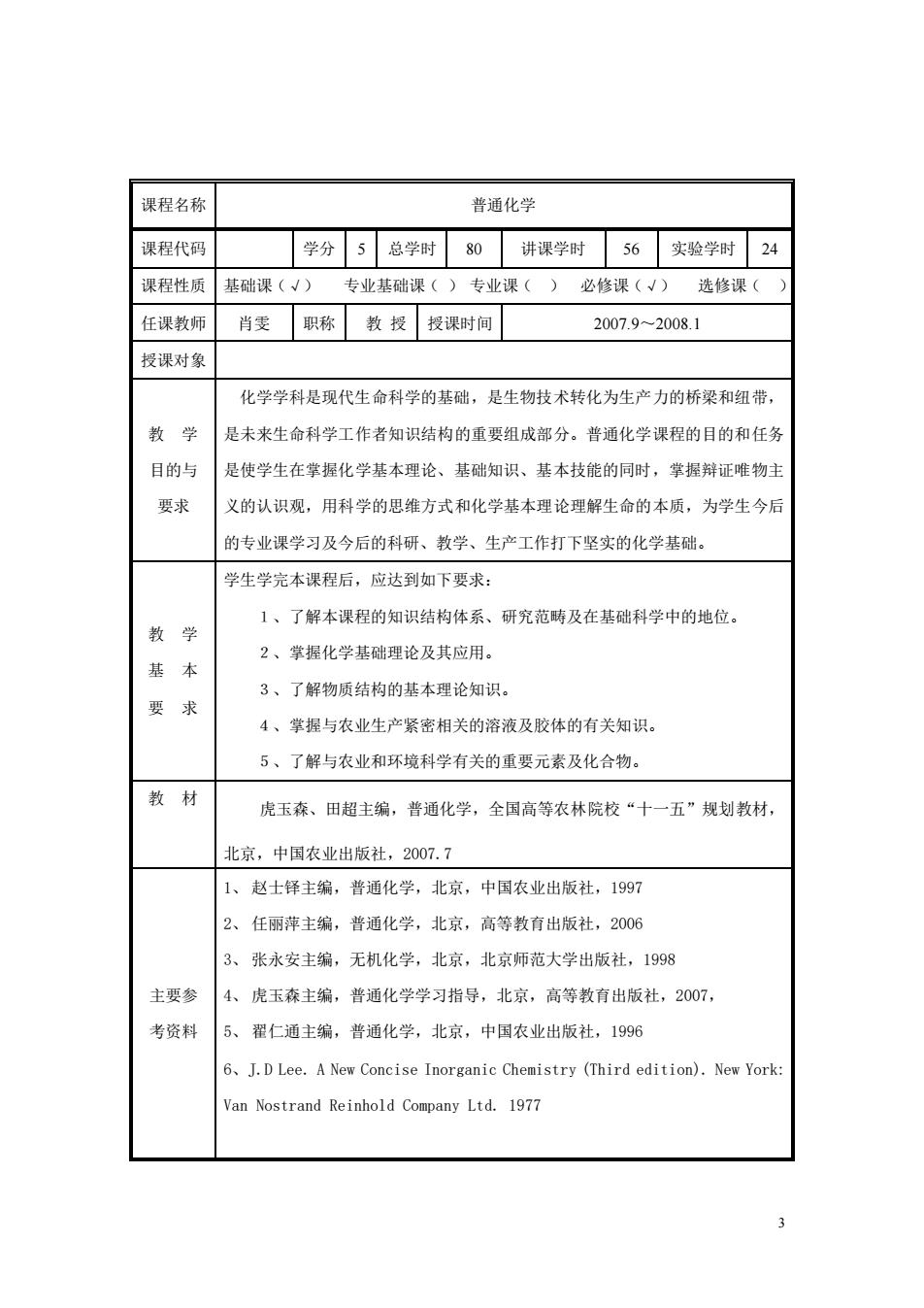
课程名称 普通化学 课程代码 学分 总学时 80 讲课学时 56 实验学时 24 课程性质 基础课(√) 专业基础课() 专业课() 必修课(√) 选修课() 任课教师 肖雯 职称 教授 授课时间 2007.9~2008.1 授课对象 化学学科是现代生命科学的基础,是生物技术转化为生产力的桥梁和纽带, 教学 是未来生命科学工作者知识结构的重要组成部分。普通化学课程的目的和任务 目的与 是使学生在掌握化学基本理论、基础知识、基本技能的同时,掌握辩证唯物主 要求 义的认识观,用科学的思维方式和化学基本理论理解生命的本质,为学生今后 的专业课学习及今后的科研、教学、生产工作打下坚实的化学基础。 学生学完本课程后,应达到如下要求: 1、了解本课程的知识结构体系、研究范畴及在基础科学中的地位。 教学 2、掌握化学基础理论及其应用。 基 本 3、了解物质结构的基本理论知识。 要 求 4、掌握与农业生产紧密相关的溶液及胶体的有关知识。 5、了解与农业和环境科学有关的重要元素及化合物。 教材 虎玉森、田超主编,普通化学,全国高等农林院校“十一五”规划教材, 北京,中国农业出版社,2007.7 1、赵士铎主编,普通化学,北京,中国农业出版社,1997 2、 任丽萍主编,普通化学,北京,高等教育出版社,2006 3、 张永安主编,无机化学,北京,北京师范大学出版社,1998 主要参 4、虎玉森主编,普通化学学习指导,北京,高等教育出版社,2007, 考资料 5、 翟仁通主编,普通化学,北京,中国农业出版社,1996 6.J.D Lee.A New Concise Inorganic Chemistry (Third edition).New York: Van Nostrand Reinhold Company Ltd.1977
3 课程名称 普通化学 课程代码 学分 5 总学时 80 讲课学时 56 实验学时 24 课程性质 基础课(√) 专业基础课( ) 专业课( ) 必修课(√) 选修课( ) 任课教师 肖雯 职称 教 授 授课时间 2007.9~2008.1 授课对象 教 学 目的与 要求 化学学科是现代生命科学的基础,是生物技术转化为生产力的桥梁和纽带, 是未来生命科学工作者知识结构的重要组成部分。普通化学课程的目的和任务 是使学生在掌握化学基本理论、基础知识、基本技能的同时,掌握辩证唯物主 义的认识观,用科学的思维方式和化学基本理论理解生命的本质,为学生今后 的专业课学习及今后的科研、教学、生产工作打下坚实的化学基础。 教 学 基 本 要 求 学生学完本课程后,应达到如下要求: 1、了解本课程的知识结构体系、研究范畴及在基础科学中的地位。 2、掌握化学基础理论及其应用。 3、了解物质结构的基本理论知识。 4、掌握与农业生产紧密相关的溶液及胶体的有关知识。 5、了解与农业和环境科学有关的重要元素及化合物。 教 材 虎玉森、田超主编,普通化学,全国高等农林院校“十一五”规划教材, 北京,中国农业出版社,2007.7 主要参 考资料 1、 赵士铎主编,普通化学,北京,中国农业出版社,1997 2、 任丽萍主编,普通化学,北京,高等教育出版社,2006 3、 张永安主编,无机化学,北京,北京师范大学出版社,1998 4、 虎玉森主编,普通化学学习指导,北京,高等教育出版社,2007, 5、 翟仁通主编,普通化学,北京,中国农业出版社,1996 6、J.D Lee. A New Concise Inorganic Chemistry (Third edition). New York: Van Nostrand Reinhold Company Ltd. 1977
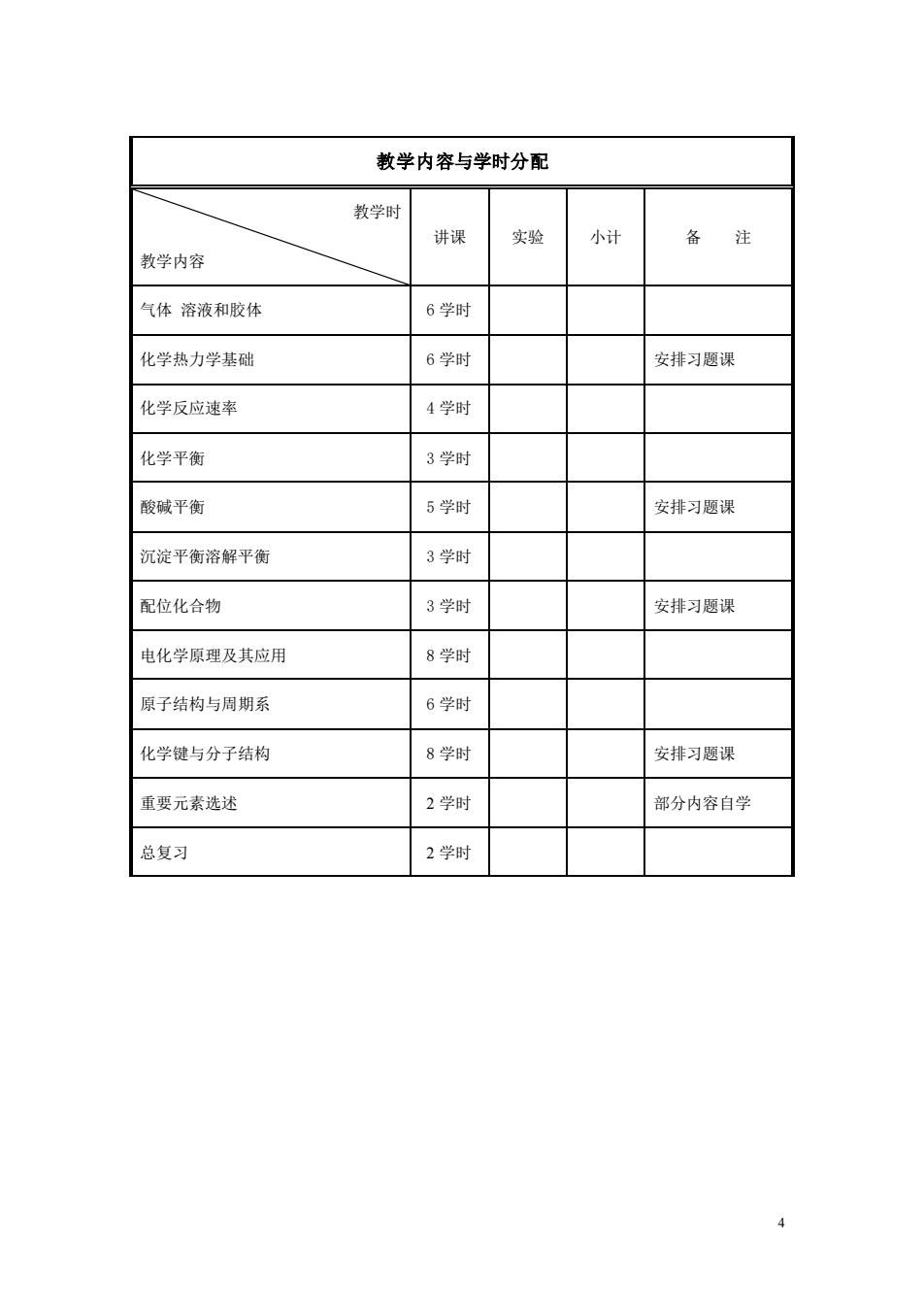
教学内容与学时分配 教学时 讲课 实验 小计 备注 教学内容 气体溶液和胶体 6学时 化学热力学基础 6学时 安排习题课 化学反应速率 4学时 化学平衡 3学时 酸碱平衡 5学时 安排习题课 沉淀平衡溶解平衡 3学时 配位化合物 3学时 安排习题课 电化学原理及其应用 8学时 原子结构与周期系 6学时 化学键与分子结构 8学时 安排习题课 重要元素选述 2学时 部分内容自学 总复习 2学时
4 教学内容与学时分配 教学时 教学内容 讲课 实验 小计 备 注 气体 溶液和胶体 6 学时 化学热力学基础 6 学时 安排习题课 化学反应速率 4 学时 化学平衡 3 学时 酸碱平衡 5 学时 安排习题课 沉淀平衡溶解平衡 3 学时 配位化合物 3 学时 安排习题课 电化学原理及其应用 8 学时 原子结构与周期系 6 学时 化学键与分子结构 8 学时 安排习题课 重要元素选述 2 学时 部分内容自学 总复习 2 学时
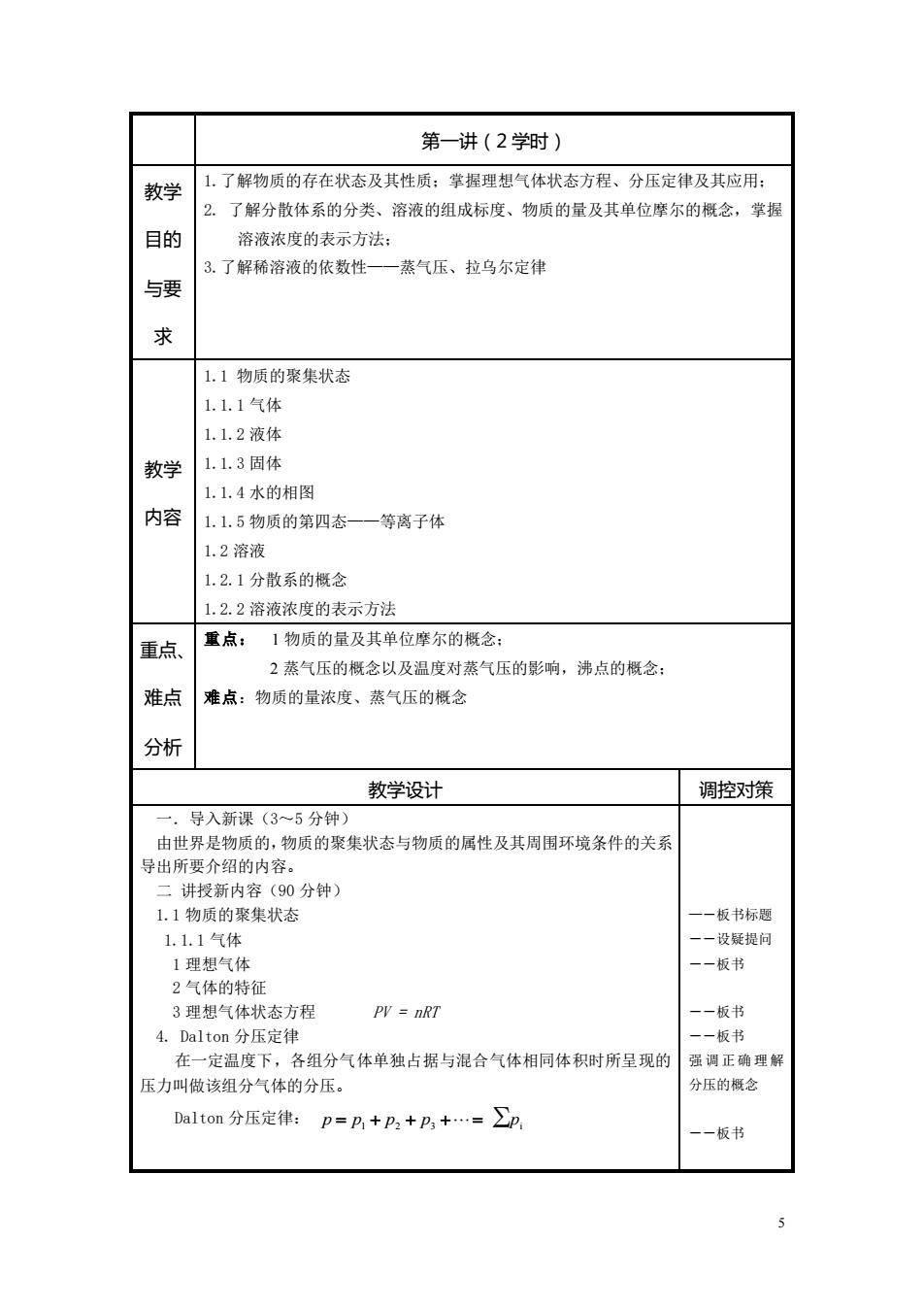
第一讲(2学时) 教学 1.了解物质的存在状态及其性质:掌握理想气体状态方程、分压定律及其应用: 2. 了解分散体系的分类、溶液的组成标度、物质的量及其单位摩尔的概念,掌握 目的 溶液浓度的表示方法: 3.了解稀溶液的依数性一一蒸气压、拉乌尔定律 与要 求 1.1物质的聚集状态 1.1.1气体 1.1.2液体 教学 1.1.3固体 1.1.4水的相图 内容 1.1.5物质的第四态一 等离子体 1.2溶液 1.2.1分散系的概念 1.2.2溶液浓度的表示方法 重点、 重点: 1物质的量及其单位摩尔的概念: 2蒸气压的概念以及温度对蒸气压的影响,沸点的概念: 难点 难点:物质的量浓度、蒸气压的概念 分析 教学设计 调控对策 一.导入新课(3~5分钟)》 由世界是物质的,物质的聚集状态与物质的属性及其周围环境条件的关系 导出所要介绍的内容。 二讲授新内容(90分钟) 1.1物质的聚集状态 ~板书标题 1.1.1气体 一一设疑提问 1理想气体 一一板书 2气体的特征 3理想气体状态方程 PY =nRT 一一板书 4.Dalton分压定律 一一板书 在一定温度下,各组分气体单独占据与混合气体相同体积时所呈现的 强调正确理解 压力叫做该组分气体的分压。 分压的概念 Dalton分压定律: p=p,+p,+p,+…=∑p, 一板书
5 第一讲(2 学时) 教学 目的 与要 求 1.了解物质的存在状态及其性质;掌握理想气体状态方程、分压定律及其应用; 2. 了解分散体系的分类、溶液的组成标度、物质的量及其单位摩尔的概念,掌握 溶液浓度的表示方法; 3.了解稀溶液的依数性——蒸气压、拉乌尔定律 教学 内容 1.1 物质的聚集状态 1.1.1 气体 1.1.2 液体 1.1.3 固体 1.1.4 水的相图 1.1.5 物质的第四态——等离子体 1.2 溶液 1.2.1 分散系的概念 1.2.2 溶液浓度的表示方法 重点、 难点 分析 重点: 1 物质的量及其单位摩尔的概念; 2 蒸气压的概念以及温度对蒸气压的影响,沸点的概念; 难点:物质的量浓度、蒸气压的概念 教学设计 调控对策 一.导入新课(3~5 分钟) 由世界是物质的,物质的聚集状态与物质的属性及其周围环境条件的关系 导出所要介绍的内容。 二 讲授新内容(90 分钟) 1.1 物质的聚集状态 1.1.1 气体 1 理想气体 2 气体的特征 3 理想气体状态方程 PV = nRT 4. Dalton 分压定律 在一定温度下,各组分气体单独占据与混合气体相同体积时所呈现的 压力叫做该组分气体的分压。 Dalton 分压定律: p = p1 + p2 + p3 +=∑pi —―板书标题 ――设疑提问 ――板书 ――板书 ――板书 强调正确理解 分压的概念 ――板书

卫=n p n 称为摩尔分数, 用表示。故有x,=1 所以,某一组分气体的分压和该气体组分的摩尔分数成正比。 一板书 P=px 一一板书 1.1.2液体 1蒸气压的概念及与温度、外压的关系 2正常沸点的概念 注意掌握学生 3凝固点的概念 的理解程度 1.1.3固体 *1.1.4相平衡、水的相图 一板书标题 (1)相的概念 一一设疑提问 (2)水的三相点 一一板书 1.2溶液 1.2.1分散系的概念 一一板书 按分散质颗粒大小分散系的分类及其性质 1.2.2溶液浓度的表示方法 溶液的浓度是指一定量的溶液中所含溶质的量或一定量溶剂中所含溶 质的量,我们用A表示溶剂,用B表示溶质,常用的浓度表示方法有如下几 一一板书 种: 1.质量分数溶液中某一组分的质量与溶液总质量之比。其数学表达式 一一板书 为, Qg=m 例题 m 式中,⊙为溶质的质量分数,单位为1:为溶质的质量,SI单位为 μg、g、kg等: m为溶液的质量,SI单位为kg: 2.物质的量浓度 物质的量浓度是指单位体积溶液中所含溶质物质的量,用符号℃表示, 一一板书 即 c -强调概念 一一板书 式中,为溶质的物质的量,单位为mol:V为溶液的体积,单位为dm: 则浓度的单位为moldm。 3.质量摩尔浓度 一一板书 质量摩尔浓度是指每kg溶剂中所含溶质的物质的量,常用表示,其 数学表达式为: be=ng m 板书 式中,为溶质的物质的量,单位为mol:m溶剂的质量,单位为kg。 例题 所以质量摩尔浓度的单位为mol-kg。 一板书 4.摩尔分数 溶液中某一组分物质的量与全部溶液的物质的量之比称为该物质的摩 尔分数,用x来表示。对于一个两组分溶液体系来说,溶质的摩尔分数与溶 6
6 n n p pi i = n ni 称为摩尔分数,用 xi表示。故有 ∑xi = 1 所以,某一组分气体的分压和该气体组分的摩尔分数成正比。 i i p = px 1.1.2 液体 1 蒸气压的概念及与温度、外压的关系 2 正常沸点的概念 3 凝固点的概念 1.1.3 固体 *1.1.4 相平衡、水的相图 (1)相的概念 (2)水的三相点 1.2 溶液 1.2.1 分散系的概念 按分散质颗粒大小分散系的分类及其性质 1.2.2 溶液浓度的表示方法 溶液的浓度是指一定量的溶液中所含溶质的量或一定量溶剂中所含溶 质的量,我们用 A 表示溶剂,用 B 表示溶质,常用的浓度表示方法有如下几 种: 1.质量分数 溶液中某一组分的质量与溶液总质量之比。其数学表达式 为, m mB B = 式中, ωB 为溶质的质量分数,单位为 1;mB 为溶质的质量,SI 单位为 μg、mg、kg 等; m 为溶液的质量,SI 单位为 kg; 2.物质的量浓度 物质的量浓度是指单位体积溶液中所含溶质物质的量,用符号 c 表示, 即 V n c B = 式中,nB为溶质的物质的量,单位为 mol;V 为溶液的体积,单位为 dm3; 则浓度的单位为 mol∙dm-3。 3. 质量摩尔浓度 质量摩尔浓度是指每 kg 溶剂中所含溶质的物质的量,常用 bB表示,其 数学表达式为: A B B = m n b 式中,nB为溶质的物质的量,单位为 mol;mA 溶剂的质量,单位为 kg。 所以质量摩尔浓度的单位为 mol∙kg -1。 4.摩尔分数 溶液中某一组分物质的量与全部溶液的物质的量之比称为该物质的摩 尔分数,用 x 来表示。对于一个两组分溶液体系来说,溶质的摩尔分数与溶 ――板书 ――板书 注意掌握学生 的理解程度 —―板书标题 ――设疑提问 ――板书 ――板书 ――板书 ――板书 例题 ――板书 --强调概念 ――板书 ――板书 ――板书 例题 ――板书

剂的摩尔分数分别为: 一一板书 XB=一 XA=- n +nB nA +n8 式中,n,为溶剂的物质的量,单位为mol:m为溶质的物质的量,单位 为mol。 显然,对两组分体系有x十=1。同理,多组分体系中有∑x=1。 三小结(3~5分钟) 课后补遗 第二讲(2学时) 教学目的 了解稀溶液的依数性,并掌握有关计算及应用 与要求 1.2.3稀溶液的依数性 ①溶液蒸气压下降 教学内容 ②溶液的沸点升高 ③溶液的凝固点降低 ④渗透压 重点、难点 重点:1溶液依数性的概念: 2相关计算: 分析 难点:拉乌尔定律 教学设计 调控对策 一.导入新课(3~5分钟) 溶液的某些性质与溶液中溶质的本性有关,如溶液的颜色、密度、酸碱性 和导电性等:对于稀溶液,另一类性质则与溶液中溶质的独立质点数有关, 而与溶质本身性质无关,如溶液的蒸气压下降、凝固点降低、沸点升高和渗 透压等。后一类性质称为稀溶液的通性,或者称为依数性。 二讲授新内容(90分钟) 1.2.3稀溶液的依数性 一一板书 ①溶液蒸气压下降 1886年法国化学家拉乌尔(F.Raoult)根据一系列实验结果提出:“在 一一板书 一定温度下,难挥发非电解质稀溶液的蒸气压等于纯溶剂的饱和蒸气压与溶 剂的摩尔分数的乘积”,这就是拉乌尔定律。它可用下式来表达: D-D XA 一一板书 式中,p为溶液的蒸气压:*为纯溶剂的饱和蒸气压,:为溶剂的摩尔 分数。 因为xA十厢=1, 所以p=*=*(1一)=佛一* 一一用图说明 又因*一p=△p >
7 剂的摩尔分数分别为: A B A A A B B B n n n x n n n x + = + = 式中,nA为溶剂的物质的量,单位为 mol;nB为溶质的物质的量,单位 为 mol。 显然,对两组分体系有 xA+xB=1。同理,多组分体系中有 xi = 1。 三 小结(3~5 分钟) ――板书 课后补遗 第二讲(2 学时) 教学目的 与要求 了解稀溶液的依数性,并掌握有关计算及应用 教学内容 1.2.3 稀溶液的依数性 ①溶液蒸气压下降 ②溶液的沸点升高 ③溶液的凝固点降低 ④渗透压 重点、难点 分析 重点: 1 溶液依数性的概念; 2 相关计算; 难点:拉乌尔定律 教学设计 调控对策 一.导入新课(3~5 分钟) 溶液的某些性质与溶液中溶质的本性有关,如溶液的颜色、密度、酸碱性 和导电性等;对于稀溶液,另一类性质则与溶液中溶质的独立质点数有关, 而与溶质本身性质无关,如溶液的蒸气压下降、凝固点降低、沸点升高和渗 透压等。后一类性质称为稀溶液的通性,或者称为依数性。 二 讲授新内容(90 分钟) 1.2.3 稀溶液的依数性 ①溶液蒸气压下降 1886 年法国化学家拉乌尔(F.Raoult)根据一系列实验结果提出:“在 一定温度下,难挥发非电解质稀溶液的蒸气压等于纯溶剂的饱和蒸气压与溶 剂的摩尔分数的乘积”,这就是拉乌尔定律。它可用下式来表达: p=p* xA 式中,p 为溶液的蒸气压;p*为纯溶剂的饱和蒸气压,xA 为溶剂的摩尔 分数。 因为 x A + xB = 1, 所以 p=p* xA = p*(1-xB)=p*-p* xB 又因 p*-p=Δp ――板书 ――板书 ――板书 ――用图说明

所以△D=咪 拉乌尔定律也可以这样描述:“在一定温度下,稀溶液的蒸气压下降△和 强调概念 溶质的摩尔分数成正比”。拉乌尔定律只适用于非电解质的稀溶液。 2.溶液的沸点升高 一板书 若T。*、T。分别为纯溶剂的沸点和溶液的沸点,则沸点升高为△T6 △Tb=Tb*-T6 一一板书 和溶液的蒸气压下降一样,也可导出 △Tb=KbbB 式中,K,为溶剂摩尔沸点升高常数,单位为K.kg.mol-1:K,只取决于溶 剂本身的性质,而与溶质无关,不同溶剂的K值不同。 3.溶液的凝固点降低 一一板书 难挥发的非电解质稀溶液的凝固点下降与溶液的质量摩尔浓度成正 比。即 △T=KbB(△T=T*-Tr) 一一板书 式中,△T:为溶液的凝固点降低:K:为凝固点摩尔降低常数,单位为 K.kg.mol1。K也只取决于溶剂的性质,而与溶质的性质无关。 注意:K、K,的意义及影响因素:沸点和凝固点的概念:结冰只有溶 一一强点注意 剂结冰。 4.溶液的渗透压 产生渗透现象必须具备两个条件:一是要有半透膜,二是半透膜两侧 一板书 存在溶液浓度差,方向是溶剂由稀溶液向浓溶液渗透。 一用图解释 1886年荷兰物理学家范特霍甫(J.Von't Hoff)总结大量实验结果指出: “稀溶液的渗透压与浓度和绝对温度的关系同理想气体方程式一致”,表示 为: IW=nRT或Ⅱ=cRT 一一板书 式中,Ⅱ为渗透压kPa:c为溶液的物质量浓度mol dm3:R为气体常 数8.314 kPadm3-K1mol1:T为绝对温度K。 可见,在一定温度下,稀溶液的渗透压与溶液的浓度成正比而与溶质的 本性无关。 虽然稀溶液的渗透压与浓度、温度的关系和理想气体完全相符,但稀溶液 的渗透压和气体的压力本质上并无相同之处。气体压力是由于分子撞击容器 壁而产生的,而渗透压并不是溶质分子直接运动的结果,是与溶剂分子的移 动趋势有关的性质。 1.4.3稀溶液依数性的应用 1用于求溶液的沸点和凝固点及渗透压 一举例说明 2求分子量 3用来解释生物学现象 注意:1K.、K只与溶剂的性质有关: 2大分子的分子量一般用渗透压来求。 1.4.3强电解质溶液的依数性 ·强调 若将1 mol NaC1溶于1kg水中,根据△T=·ba计算,其溶液的凝 固点降低1.86K,而实际测定降低了3.50K,差不多为1.86K的两倍。这 表明NaCl在水中溶解以后要离解成为Na和C1ˉ,此时溶液中粒子数增加了
8 所以 Δp=p* xB 拉乌尔定律也可以这样描述:“在一定温度下,稀溶液的蒸气压下降Δp 和 溶质的摩尔分数成正比”。拉乌尔定律只适用于非电解质的稀溶液。 2. 溶液的沸点升高 若 Tb*、Tb 分别为纯溶剂的沸点和溶液的沸点,则沸点升高为ΔTb ΔTb=Tb*-Tb 和溶液的蒸气压下降一样,也可导出 ΔTb=Kb •bB 式中,Kb 为溶剂摩尔沸点升高常数,单位为 K∙kg∙mol-1 ;Kb 只取决于溶 剂本身的性质,而与溶质无关,不同溶剂的 Kb 值不同。 3. 溶液的凝固点降低 难挥发的非电解质稀溶液的凝固点下降与溶液的质量摩尔浓度成正 比。即 ΔTf =Kf•bB(ΔTf=Tf*-Tf) 式中,ΔTf 为溶液的凝固点降低;Kf 为凝固点摩尔降低常数,单位为 K∙kg∙mol-1。Kf也只取决于溶剂的性质,而与溶质的性质无关。 注意:Kf、Kb 的意义及影响因素;沸点和凝固点的概念;结冰只有溶 剂结冰。 4. 溶液的渗透压 产生渗透现象必须具备两个条件:一是要有半透膜,二是半透膜两侧 存在溶液浓度差,方向是溶剂由稀溶液向浓溶液渗透。 1886 年荷兰物理学家范特霍甫(J.Von’t Hoff)总结大量实验结果指出: “稀溶液的渗透压与浓度和绝对温度的关系同理想气体方程式一致”,表示 为: ΠV=nRT 或 Π=cRT 式中, Π 为渗透压 kPa; c 为溶液的物质量浓度 mol∙dm-3; R 为气体常 数 8.314 kPa∙dm3 ∙K -1 ∙mol-1 ;T 为绝对温度 K。 可见,在一定温度下,稀溶液的渗透压与溶液的浓度成正比而与溶质的 本性无关。 虽然稀溶液的渗透压与浓度、温度的关系和理想气体完全相符,但稀溶液 的渗透压和气体的压力本质上并无相同之处。气体压力是由于分子撞击容器 壁而产生的,而渗透压并不是溶质分子直接运动的结果,是与溶剂分子的移 动趋势有关的性质。 1.4.3 稀溶液依数性的应用 1 用于求溶液的沸点和凝固点及渗透压 2 求分子量 3 用来解释生物学现象 注意:1 Kb、Kf只与溶剂的性质有关; 2 大分子的分子量一般用渗透压来求。 1.4.3 强电解质溶液的依数性 若将 1 mol NaCl 溶于 1 kg 水中,根据ΔTf =Kf•bB 计算,其溶液的凝 固点降低 1.86 K,而实际测定降低了 3.50K,差不多为 1.86 K 的两倍。这 表明 NaCl 在水中溶解以后要离解成为 Na+和 Cl-,此时溶液中粒子数增加了 强调概念 ――板书 ――板书 ――板书 ――板书 ――强点注意 ――板书 ――用图解释 ――板书 ――举例说明 ――强调

一举例 倍,粒子浓度为2m1kg。可是实验测定值并不恰好是分子浓度的两倍。 一强调电解 若正好是两倍时,凝固点降低为3.72K,而实测值只有3.50K。这是由于强 质的依数性,要 电解质离解以后,离子之间互相牵制形成离子氛,使得离子不能表现为独立 求掌握定性比 离子的行为。 较 三小结(3~5分钟) 1分散系的概念及类型: 2溶液浓度的表示方法: 3稀溶液的依数性及应用: 4电解质溶液的依数性(能够定性判断): 四布置作业: 课后补遗 第三讲(2学时) 教学目的 1.了解溶胶的特点、 性质,掌握胶团结构,掌握溶胶的稳定性和聚沉 2.了解高分子溶液:了解表面活性物质和乳浊液。 与要求 1.3胶体 ①吸附作用 ②溶胶的制备 教学内容 ③溶胶的性质 ④胶团结构 ⑤溶胶的稳定性和聚沉 重点、难点 重点:胶团结构 溶胶的稳定性和聚沉 分析 难点: 胶团结构 教学设计 调控对策 一.导入新课(3~5分钟) 由世界是物质的,物质的聚集状态与物质的属性及其周围环境条件的关系 导出所要介绍的内容。 二讲授新内容(90分钟) 1.3胶体溶液 一板书标题 1.3.1胶体的概念及分类 一一设疑提问 1.吸附作用 一一板书 ①吸附的概念 吸附质吸附剂 9
9 一倍,粒子浓度为 2 mol∙kg-1。可是实验测定值并不恰好是分子浓度的两倍。 若正好是两倍时,凝固点降低为 3.72K,而实测值只有 3.50K。这是由于强 电解质离解以后,离子之间互相牵制形成离子氛,使得离子不能表现为独立 离子的行为。 三 小结(3~5 分钟) 1 分散系的概念及类型; 2 溶液浓度的表示方法; 3 稀溶液的依数性及应用; 4 电解质溶液的依数性(能够定性判断); 四 布置作业: ――举例 ――强调电解 质的依数性,要 求掌握定性比 较 课后补遗 第三讲(2 学时) 教学目的 与要求 1. 了解溶胶的特点、性质,掌握胶团结构,掌握溶胶的稳定性和聚沉 2. 了解高分子溶液;了解表面活性物质和乳浊液。 教学内容 1.3 胶体 ①吸附作用 ②溶胶的制备 ③溶胶的性质 ④胶团结构 ⑤溶胶的稳定性和聚沉 重点、难点 分析 重点: 胶团结构 溶胶的稳定性和聚沉 难点: 胶团结构 教学设计 调控对策 一.导入新课(3~5 分钟) 由世界是物质的,物质的聚集状态与物质的属性及其周围环境条件的关系 导出所要介绍的内容。 二 讲授新内容(90 分钟) 1.3 胶体溶液 1.3.1 胶体的概念及分类 1. 吸附作用 ①吸附的概念 吸附质 吸附剂 —―板书标题 ――设疑提问 ――板书

②吸附的类型 一板书 根据吸附状况分:(1)分子吸附 (2)离子吸附 离子吸附有:离子选择吸附和离子交换吸附。离子选择吸附规律为:固 体吸附剂优先吸附与其结构相似极性相近的离子。 1.3.2溶胶的性质 一一板书 1光学性质 一一板书 2动力学性质 一一板书 3电学性质 胶体粒子带电主要有两种原因: 一一板书 (1)吸附带电。胶体粒子具有很大的比表面,在液相中存在电解质时, 胶体粒子会选择性地吸附某些离子而带电。例如利用FeCl,水解制备Fe(OH): 胶体溶液时, FeCl3+H20 Fe(0H)3 3HCl 一一板书 FeC1,十2H20=Fe(OHm)2C1十2HC1 Fe(OH)2Cl =Fe0t十C1十H0 按优先吸附规则,Fe(O),优先吸附FeO而带正电荷。 (2)电离带电。胶体粒子表面上的分子可以电离,电离后的粒子即带 电。例如硅酸溶胶,它是许多H2S0分子脱水聚成的胶体粒子,表面上的 H2Si0分子电离, HSi0,=H十HSi0一2H十Si0,2 Si02留在胶粒表面上而H进入液相中,使得胶体粒子带负电荷。玻璃 在水中也是如此,它表面上的Na、Ca"溶于水中而使其带负电。蛋白质在水 溶液中的带电也是电离引起的。 1.5.4胶团结构 一一举例说明 Fe(OH):]nFeO*(n-x)CI-).xCI 胶团结构的写 法,强调电位离 胶核 电位离子 反离子 区离 子和反离子,溶 吸跗层 扩散层 胶粒 胶带电是胶核 胶团 带电 式中m为Fe(OH),分子数,n为电位离子数,m>n 10
10 ② 吸附的类型 根据吸附状况分:(1)分子吸附 (2)离子吸附 离子吸附有:离子选择吸附和离子交换吸附。离子选择吸附规律为:固 体吸附剂优先吸附与其结构相似极性相近的离子。 1.3.2 溶胶的性质 1 光学性质 2 动力学性质 3 电学性质 胶体粒子带电主要有两种原因: (1)吸附带电。胶体粒子具有很大的比表面,在液相中存在电解质时, 胶体粒子会选择性地吸附某些离子而带电。例如利用 FeCl3 水解制备 Fe(OH)3 胶体溶液时, FeCl3+ H2O Fe(OH)3 + 3HCl FeCl3 十 2H2O Fe(OH)2Cl 十 2HCl Fe(OH)2Cl FeO+十 C1-十 H2O 按优先吸附规则,Fe(OH)3 优先吸附 FeO+而带正电荷。 (2)电离带电。胶体粒子表面上的分子可以电离,电离后的粒子即带 电。例如硅酸溶胶,它是许多 H2SiO3 分子脱水聚成的胶体粒子,表面上的 H2SiO3 分子电离, H2SiO3 H + 十 HSiO3 - 2H+十 SiO3 2- SiO3 2-留在胶粒表面上而 H +进入液相中,使得胶体粒子带负电荷。玻璃 在水中也是如此,它表面上的 Na+、Ca2+溶于水中而使其带负电。蛋白质在水 溶液中的带电也是电离引起的。 1.5.4 胶团结构 ( ) ( ) - - Fe OH 3 nFeO n-x Cl xCl x m + + 式中 m 为 Fe(OH)3 分子数,n 为电位离子数,m>>n ――板书 ――板书 ――板书 ――板书 ――板书 ――板书 ――举例说明 胶团结构的写 法,强调电位离 子和反离子,溶 胶带电是胶核 带电 胶核 电位离子 反离子 反离子 吸附层 扩散层 胶团 胶粒