
化工热力学在化学工程学科中的作用和地位 第六级 过程发展 全流程的 第五级 最佳化设 化工系统工程 计和控制 流程配置 吸收系 反应系 蒸馏系 任了的州露受 第四级 化工原理 统模拟 统模拟 统模拟 设备设计 吸收塔 反应器 换热器蒸馏塔 的香雄郑化 第三级 化学反应工程 计算 计算 计算 计算 令华而令候 “三传一反” 反应速 传质 传热 流体力 工程兴 第二级 化工热力学★ 度计算 计算 计算 学计算 平衡计算 第一级 相平衡 化学反 物料平 热平衡 楠平衡 任下海力兴 应平衡 计算及 计算 物性常数和 计算 衡计算 计算 其分析 热力学性质计算 表面张 导热系 密度 粘度 烙的 海收尝和热力学 力计算 数计算 计算 计算 计算 化工热力学是“三传一反”的基础! 0942
化工热力学在化学工程学科中的作用和地位 化学反应工程 化工原理 化工系统工程 化工热力学 化工热力学是“三传一反”的基础! 09:42
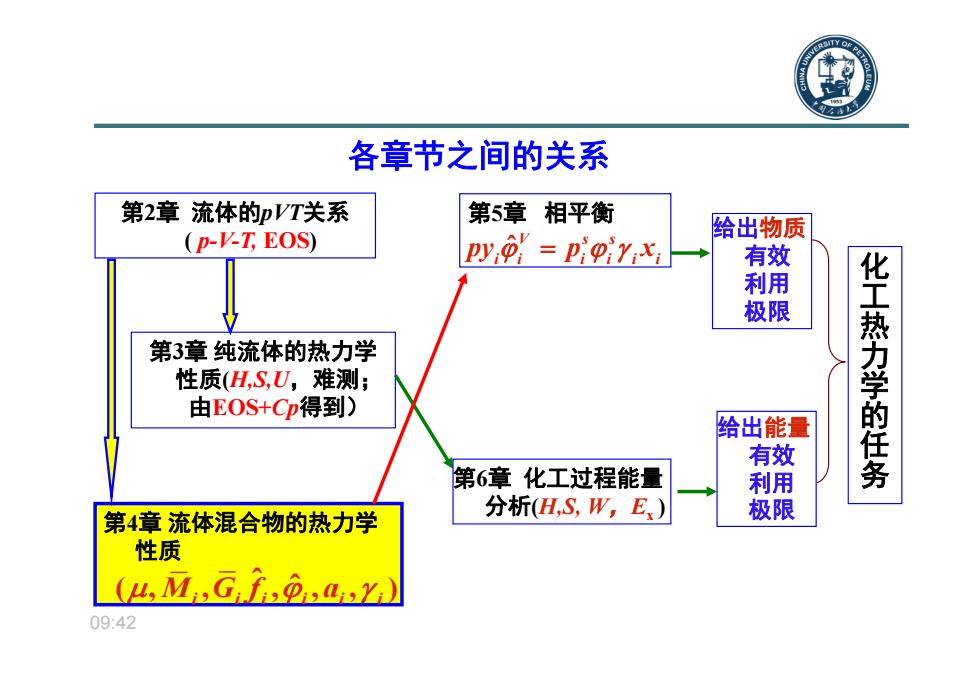
各章节之间的关系 第2章流体的pVT关系 第5章相平衡 (p-V-T EOS) 给出物质 py=pigirix 有效 利用 极限 第3章纯流体的热力学 性质(H,S,U,难测; 由EOS+Cp得到) 给出能量 化工热力学的任务 有效 第6章化工过程能量 利用 第4章流体混合物的热力学 分析H,S,W,E) 极限 性质 (u.M.Gf9.aY) 09:42
09:42 各章节之间的关系 第3章 纯流体的热力学 性质(H,S,U,难测; 由EOS+Cp得到) 第5章 相平衡 给出物质 有效 利用 极限 给出能量 有效 利用 极限 化工热力学的任务 第4章 流体混合物的热力学 性质 第2章 流体的pVT关系 ( p-V-T, EOS) ˆV ss ii i i ii py p x ˆ (, , , , , ) ˆ M Gf a i ii i i i 第6章 化工过程能量 分析(H,S, W,Ex )

中圆不油大学 CHINA UNIVERSITY OF PETROLEUM 第2章流体的p-VT关系和状态方程 2.1纯流体的p-V-T关系(★) 2.2流体的状态方程(★) 2.3对应态原理和普遍化关联式(★) 2.4真实气体混合物的p-VT关系 0p31中0g厘
第2章 流体的p-V-T 关系和状态方程 2.1 纯流体的p-V-T 关系() 2.2 流体的状态方程() 2.3 对应态原理和普遍化关联式() 2.4 真实气体混合物的p-V-T关系

本章小结 2.1纯流体的p-V-T关系 ★p-以T相图p-T图、P-图)是EOS的基础,必须掌握相图上和点、线、 面相关的概念,相互联系。 p =0 =0 >临界点(T:P。,V)、临界等温的数学特征 av T=Te >超临界流体必要条件:T下T和p>P >超临界流体的特征 2.2流体的状态方程(★) >立方型EOS(RK方程、SRK方程、PR方程) >virial方程 方程形式,特点及适用范围,求解方式
2.1 纯流体的p-V-T 关系 p-V-T相图(p-T图、p-V图)是EOS的基础,必须掌握相图上和点、线、 面相关的概念,相互联系。 临界点(Tc、 pc、Vc)、临界等温的数学特征 超临界流体必要条件: T>Tc和p>pc 超临界流体的特征 2.2 流体的状态方程() 立方型EOS(RK方程、 SRK方程、 PR方程) virial方程 方程形式,特点及适用范围,求解方式。 本章小结 0 c V T T p 0 c 2 2 T T Vp

本章小结 国 2.3对应态原理和普遍化关联式(★) >偏心因子概念 >三参数普遍化关系式Z=f(T,P,o) ·普遍化压缩因子法 普遍化第二virial系数法 Z=1+ 1+ Bp B即 BPe=B+@B RT RT人T 公式、判据、查图方法。 2.4真实气体混合物的p-T关系 >混合规则
本章小结 2.3 对应态原理和普遍化关联式() 偏心因子概念 三参数普遍化关系式 Z = f (Tr , pr, ω) • 普遍化压缩因子法 • 普遍化第二virial系数法 公式、判据、查图方法。 2.4 真实气体混合物的p-V-T关系 混合规则 rr cc 1 1 Tp RTBp RTBp Z c 0 1 c Bp B B RT

中因石油大学 CHINA UNIVERSITY OF PETROLEUM 第3章流体的热力学性质计算 3.1热力学性质间的关系(★) 3.2.理想气体热力学性质的计算(★) 3.3真实气体热力学性质的计算 3.4纯流体的热力学性质图和表 山0n0p1110g0
第3章 流体的热力学性质计算 3.1 热力学性质间的关系 ( ) 3.2 理想气体热力学性质的计算 ( ) 3.3 真实气体热力学性质的计算 3.4 纯流体的热力学性质图和表

3.1热力学性质间的关系 3.1.1热力学基本方程—适用于定组成的均相流体 对单位质量定组成的均匀流体, dU Tds-pdv (3-1) 在非流动状态下,不考虑动、位 能的变化,可推出其热力学性质 dH TdS+Vdp 6-2) 间的关系。 dA=-pdV-SdT (3-3) 即“物化”中的四大微分方程 dG=Vdp-SdT -4) 注意几点: ◆封闭或定组成的散开体系均适用; ◆均相体系(单相); ◆平衡态间的变化; ◆式中容量性质为单位质量或单位摩尔的量,即强度性质
注意几点: 封闭或定组成的敞开体系均适用; 均相体系(单相); 平衡态间的变化; 式中容量性质为单位质量或单位摩尔的量,即强度性质 3.1 热力学性质间的关系 对单位质量定组成的均匀流体, 在非流动状态下,不考虑动、位 能的变化,可推出其热力学性质 间的关系。 即“物化”中的四大微分方程 dU TdS pdV dH TdS Vdp dA pdV SdT dG Vdp SdT (3-2) (3-3) (3-4) (3-1) 3.1.1 热力学基本方程 ——适用于定组成的均相流体

3.1热力学性质间的关系 3.1.3 Maxwell:关系式 dz=Mdx+Ndy aN a小 dU TdS-pdv at as l as dH TdS +Vdp ar= av ap )s a dA=-pdV-SdT OT) dG=Vdp-SdT
3.1 热力学性质间的关系 3.1.3 Maxwell关系式 dz Mdx Ndy x y x N y M G V p S T A p V S T H T S V p U T S p V d d d d d d d d d d d d S S V p V T S S p V p T V V T S T p p T p S T V

Maxwell:关系式的应用 国 说明: ◆U,A,G的变化可以从H,S的变化中求出; U=H-PV G-H-TS A=U-TS ◆Cp、C—对真实气体是T,p和T,V的函数。 ◆理想气体Cp-C=R
Maxwell关系式的应用 说明: U、 A,G的变化可以从H、S的变化中求出; U=H–pV G=H–TS A=U–TS Cp、CV——对真实气体是T、p和T、V的函数。 理想气体Cp - CV =R

3.2理想气体热力学性质的计算 (①)热力学能 对理想气体,Cy,C仅仅是T的函数 AU-C,dT (2)焓 AH-CHOT (3)熵 S=号ar-R P
3.2 理想气体热力学性质的计算 (2) 焓 对理想气体, CV ,Cp仅仅是T的函数 21 Δ did TT H Cp T (3) 熵 (1) 热力学能 21 Δ d TT U CV T 1 2 Δ d ln 2 1 p p T R T C S T T p