
人教版选修三 原子结构和元素的性质 (第二课时) 电离能 潢川高中陈丹
电离能 潢川高中 陈 丹 原子结构和元素的性质 人教版选修三 (第二课时)
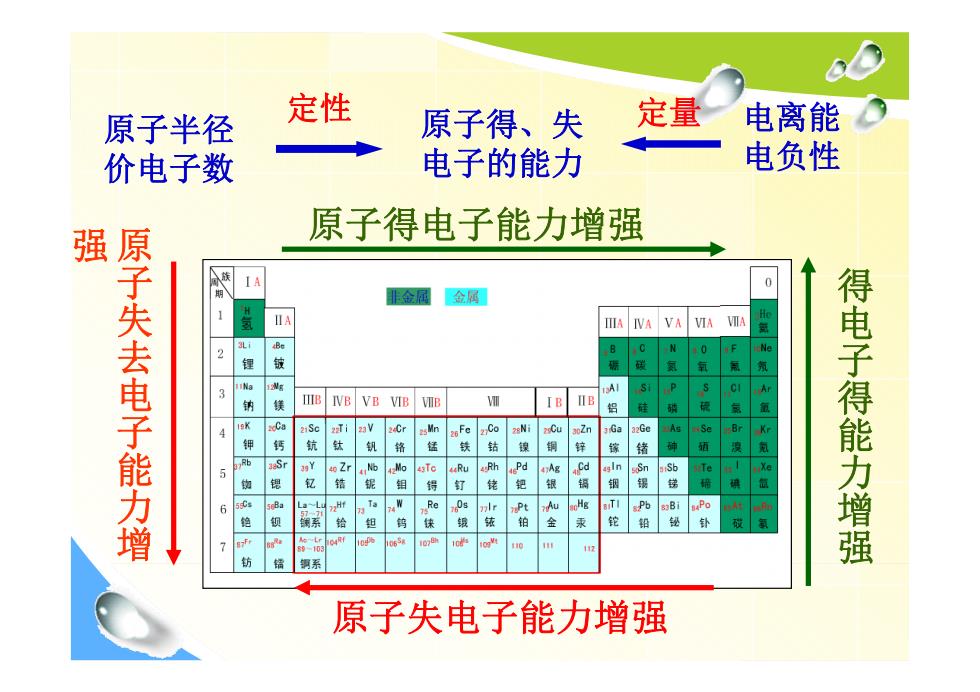
原子半径 定性 原子得、失 定量 电离能 价电子数 电子的能力 电负性 原子得电子能力增强 0 金属金属 IIA IVA VA VIA VIIA VB VIB Ca 得电子得能力增强 铜系 原子失电子能力增强
原子得、失 电子的能力 原子半径 价电子数 定性 电离能 电负性 定量 原子得电子能力增强 原子失电子能力增强 强 原子失去电子能力增 得电子得能力增强

一、电离能的定义及表示方法 气态基态电中性原子失去一个电子转化 为气态基述正离子所需要的最(能量叫做 第一电离能,用I表示,单位J/mol 保证“能量最低” 标准同一
一 、电离能的定义及表示方法 气态基态电中性原子失去一个电子转化 为气态基态正离子所需要的最低能量叫做 第一电离能,用I1表示,单位:kJ/mol 保证“能量最低” 标准同一
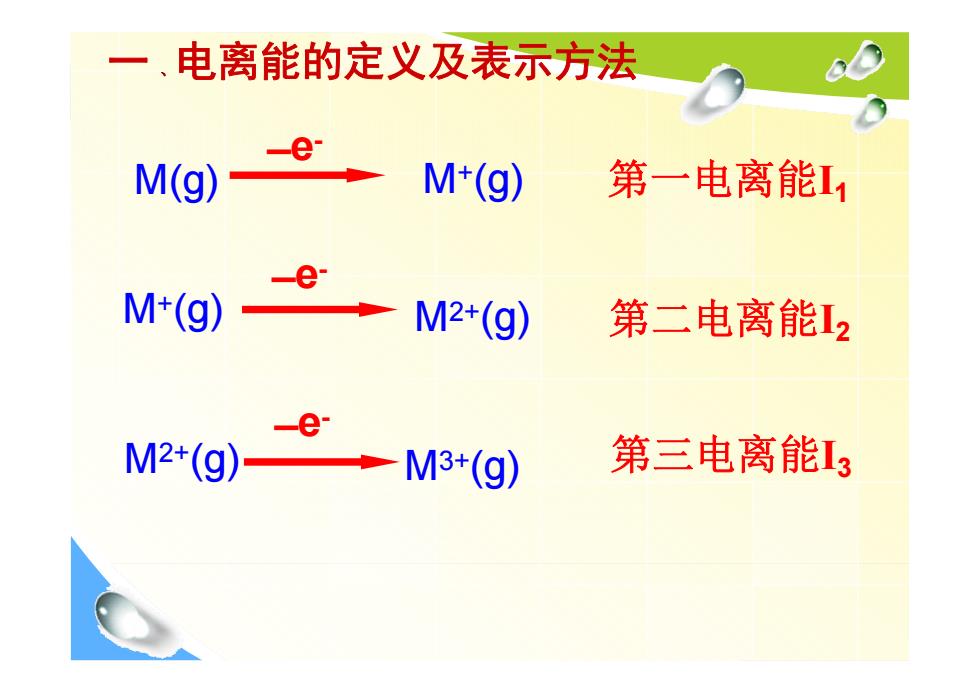
一、电离能的定义及表示方法 -e- M(g) M+(g) 第一电离能11 e M+(g) M2+(g) 第二电离能12 e M2+(g)· M3+(g) 第三电离能13
一 、电离能的定义及表示方法 M(g) M+(g) 第一电离能I1 M2+(g) 第二电离能I2 M3+(g) 第三电离能I3 M+(g) M2+(g) ̶ e- ̶ e- ̶ e-
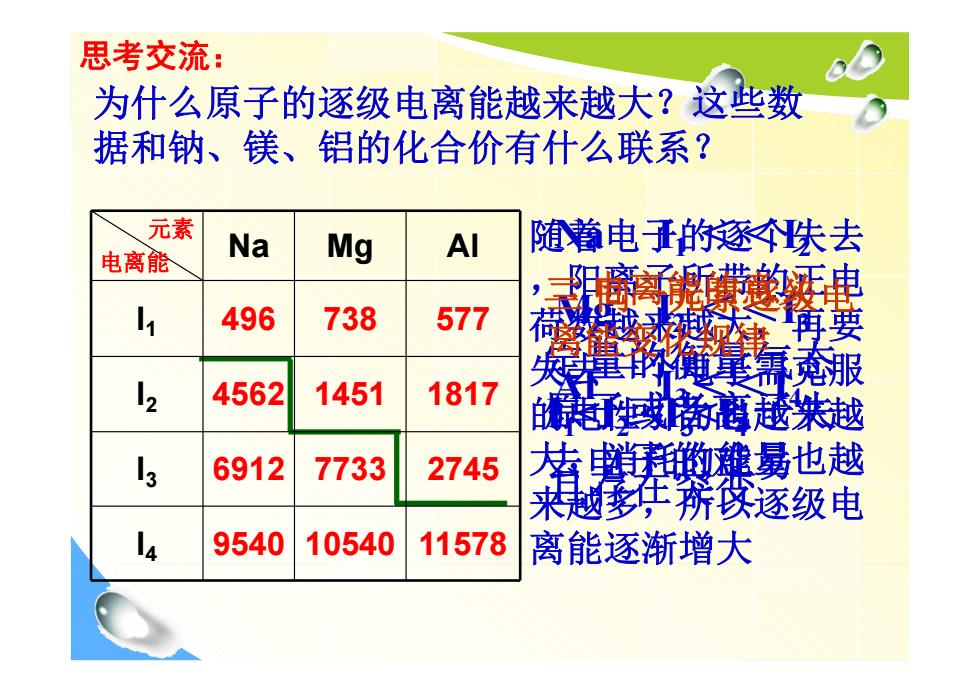
思考交流: 为什么原子的逐级电离能越来越大?这些数 据和钠、镁、铝的化合价有什么联系? 元素 随着电的逐个失去 电离能 Na Mg Al 496 738 577 黄 何 项理的链屢氰服 2 4562 1451 1817 超帝商越米越 6912 7733 2745 若锁雄最也越 来越多年疣欧逐级电 14 9540 10540 11578 离能逐渐增大
思考交流: 为什么原子的逐级电离能越来越大?这些数 据和钠、镁、铝的化合价有什么联系? 元素 电离能 Na Mg Al I1 496 738 577 I2 4562 1451 1817 I3 6912 7733 2745 I4 9540 10540 11578 随着电子的逐个失去 ,阳离子所带的正电 荷数越来越大,再要 失去一个电子需克服 的电性引力也越来越 大,消耗的能量也越 来越多,所以逐级电 离能逐渐增大 Na I 1 << I 2 Mg I 2 << I3 Al I 3<< I 4 二 电离能的意义 定量的衡量气态 原子或者离子失 去电子的难易 三 同一元素逐级电 离能变化规律 Ⅰ 1<Ⅰ 2 <Ⅰ 3<Ⅰ 4 且存在突变
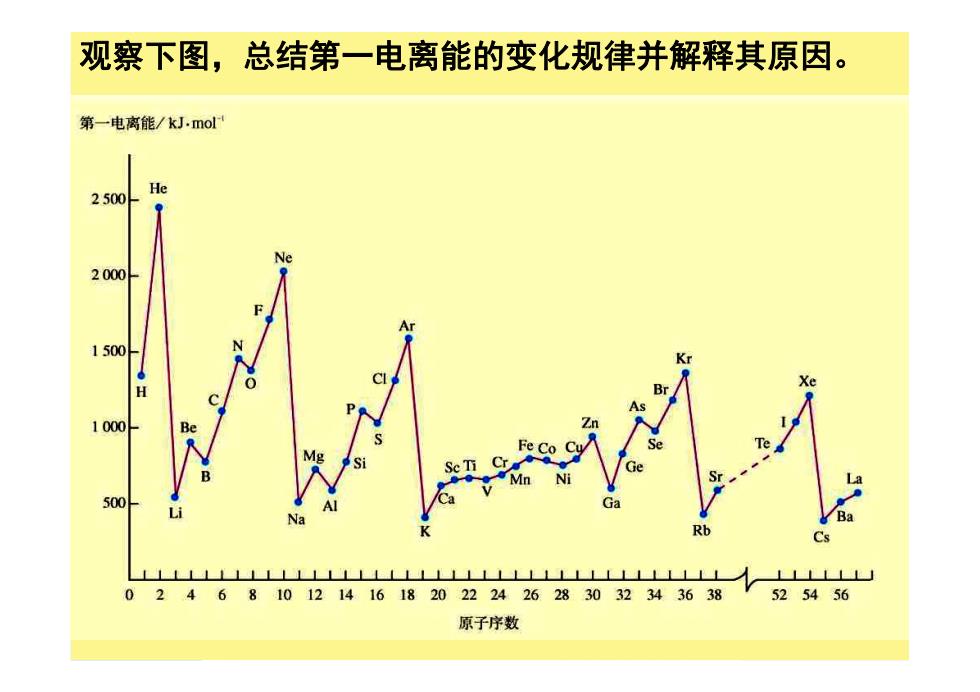
观察下图,总结第一电离能的变化规律并解释其原因。 第一电离能/kJ.mol He 2500 Ne 2000 1500 1000 Be Fe 500 Rb L山 0 2468101214161820222426283032343638 525456 原子序数
观察下图,总结第一电离能的变化规律并解释其原因
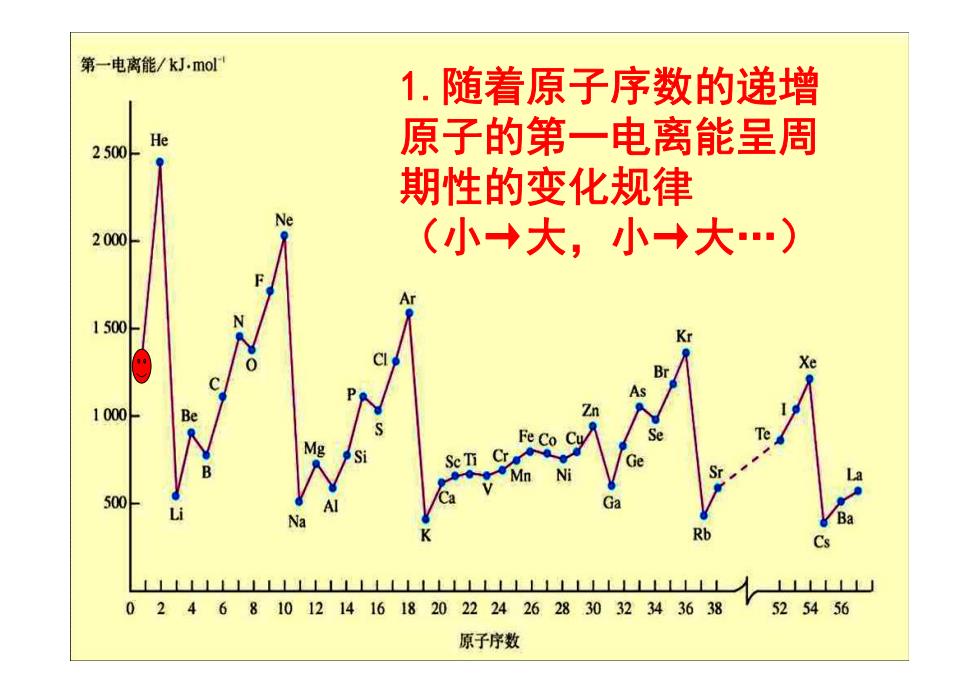
第一电离能/kJ.mol 1.随着原子序数的递增 He 2500 原子的第一电离能呈周 期性的变化规律 Ne 2000 (小→大,小→大.) 1500 Xe 1000 Be 500 Na Ba Rb Cs LNLLLLLLILLLL11111111111111111 ⊥LLLLL 02468101214161820222426283032343638 V525456 原子序数
1.随着原子序数的递增 原子的第一电离能呈周 期性的变化规律 (小→大,小→大.)

第一电离能/kJ.mol 2.同周期元素从左向右第 一 He 电离能呈增大的趋势 2500 IIA和VA存在特殊性 Ne 2000 Ar 1500 Kr 1000 500 Rb Cs LLLLLLLLLILL LLLLlLlLllLLL 02468101214161820222426283032343638 525456 原子序数
2.同周期元素从左向右第 一电离能呈增大的趋势 ⅡA和ⅤA存在特殊性
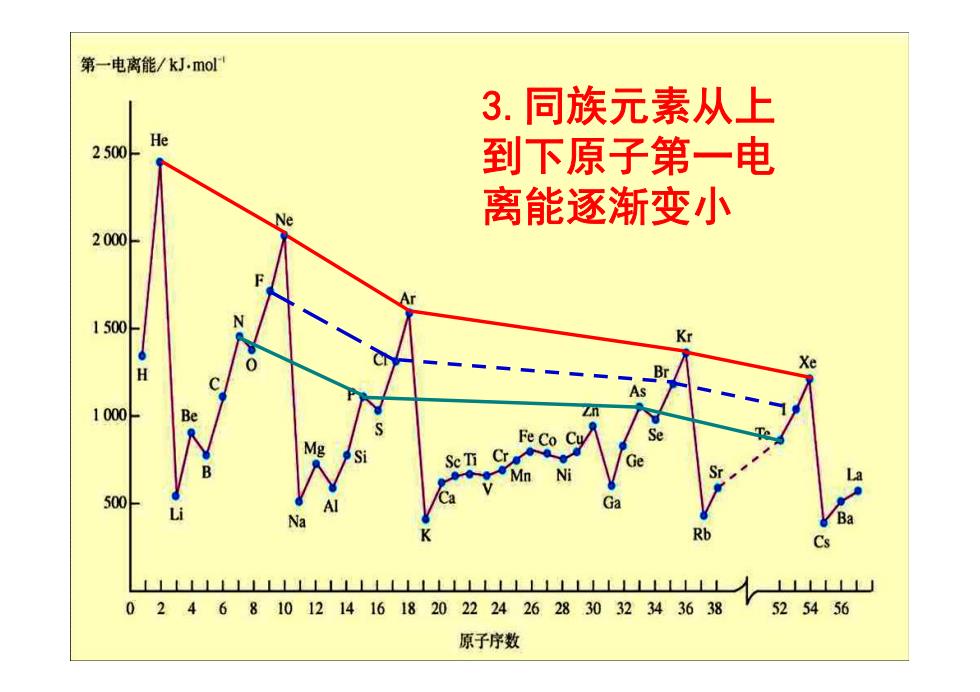
第一电离能/kJ.mol 3.同族元素从上 He 2500 到下原子第一电 se 离能逐渐变小 2000 1500 Kr Xe H 1000 500 Ba Cs LLLLLLLLLLLLLLLLLLLLLLLLLLLLLLLLLLLLLL LLL 02468101214161820222426283032343638 V525456 原子序数
3.同族元素从上 到下原子第一电 离能逐渐变小
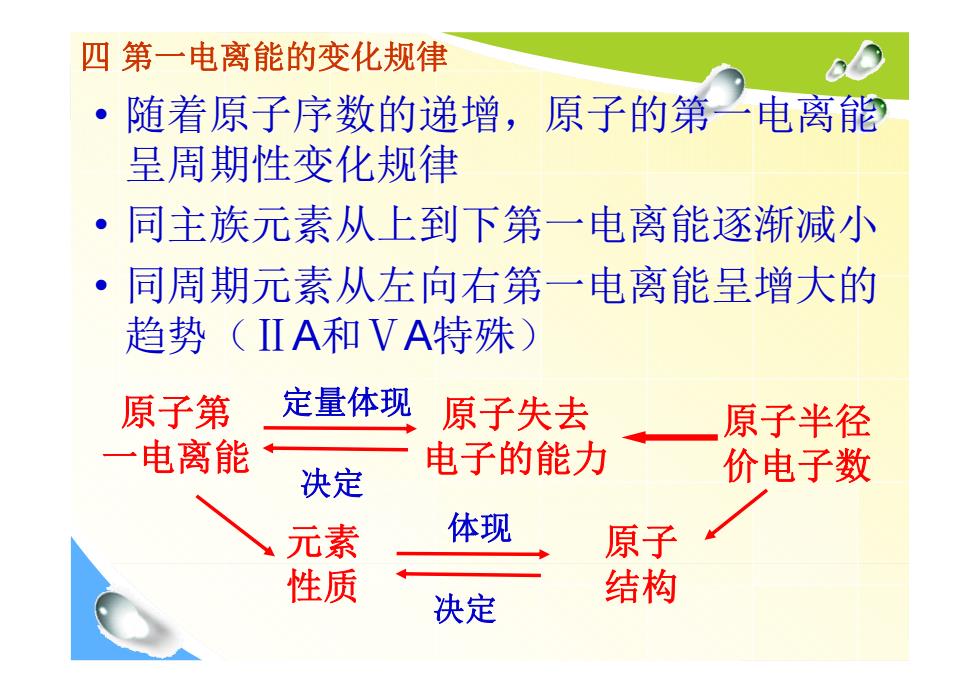
四第一电离能的变化规律 随着原子序数的递增,原子的第一电离能 呈周期性变化规律 同主族元素从上到下第一电离能逐渐减小 同周期元素从左向右第一电离能呈增大的 趋势(IⅡA和VA特殊) 原子第 定量体现 原子失去 原子半径 一电离能 电子的能力 决定 价电子数 元素 体现 原子 性质 决定 结构
四 第一电离能的变化规律 • 随着原子序数的递增,原子的第一电离能 呈周期性变化规律 • 同主族元素从上到下第一电离能逐渐减小 • 同周期元素从左向右第一电离能呈增大的 趋势(ⅡA和ⅤA特殊) 原子第 一电离能 原子失去 电子的能力 原子半径 价电子数 原子 结构 元素 性质 定量体现 决定 体现 决定