
息县一高 袅袅兮秋风,洞庭液兮木叶下
息县一高 袅袅兮秋风,洞庭波兮木叶下

息县一高 主题:化学反应与能量 第一课时:化学反应与热能 息县第一高级中学 赵明
息县一高 第一课时:化学反应与热能 息县第一高级中学 赵明 主题:化学反应与能量

息县一高 生活中的化学“自热火锅” 规保 机肠拍档 渝珍 大锅采餐任典低 质 要成份 品名你: 氢氧 发热包使用方法 钠 发热包 粉 鼎食品专 望料袋 水 将发热包从外透明 发热包主要成分 袋中取出,平整放 、碳酸 发热包 于外盒底部, 加冷 青物微开成度用 水(只能用冷水)至 发热包加水台阶线
息县一高 生活中的化学 “自热火锅” 发 热 包 主 要 成 分 发热包使用方法
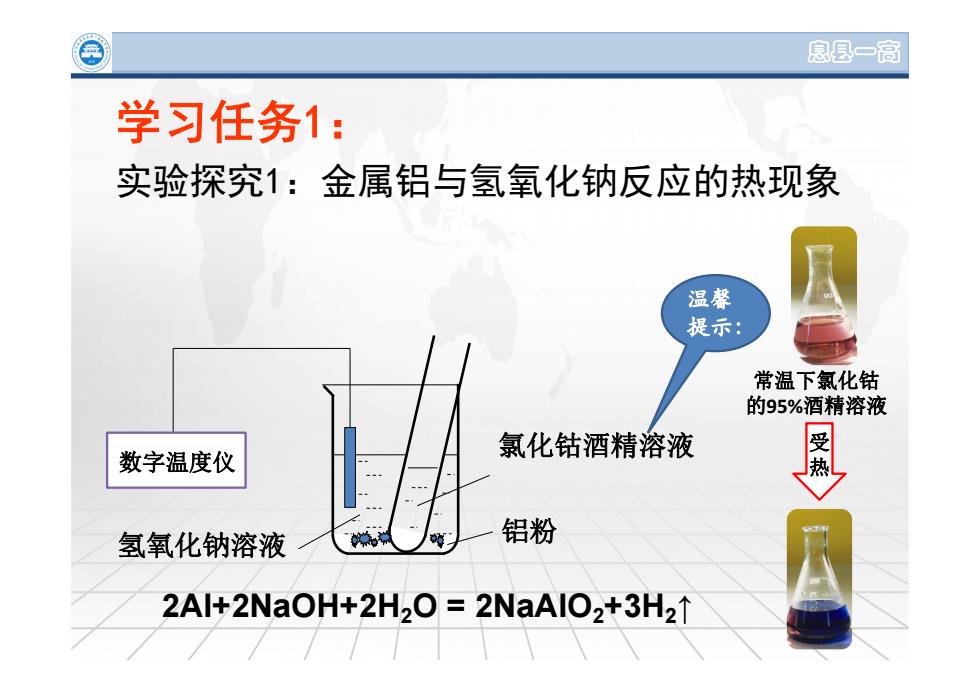
息县一高 学习任务1: 实验探究1:金属铝与氢氧化钠反应的热现象 温馨 提示: 常温下氯化钴 的95%酒精溶液 受 数字温度仪 氯化钴酒精溶液 氢氧化钠溶液 铝粉 2Al+2NaOH+2H2O=2NaAlO2+3H21
息县一高 实验探究1:金属铝与氢氧化钠反应的热现象 学习任务1: 常温下氯化钴 的95%酒精溶液 受 热 温馨 提示: 2Al+2NaOH+2H 2O = 2NaAlO 2+3H 2 ↑ 氯化钴酒精溶液 氢氧化钠溶液 铝粉 数字温度仪

息县一高 学习任务2: 实验探究2:氢氧化钡与氯化铵反应的热现象 浸有稀硫酸的棉花 饱和硝酸钾溶液 数字温度仪 氢氧化钡晶体与 氯化铵的混合物 Ba(OH)28H2O+2NHCI=BaCl2+2NH31 +10H2O
息县一高 实验探究2:氢氧化钡与氯化铵反应的热现象 学习任务2: Ba(OH) 2ꞏ8H 2O+2NH 4Cl = BaCl 2+2NH 3↑ +10H 2 O 饱和硝酸钾溶液 氢氧化钡晶体与 氯化铵的混合物 浸有稀硫酸的棉花 数字温度仪

息县一高 明显升温 明显降温
息县一高 明显升温 明显降温
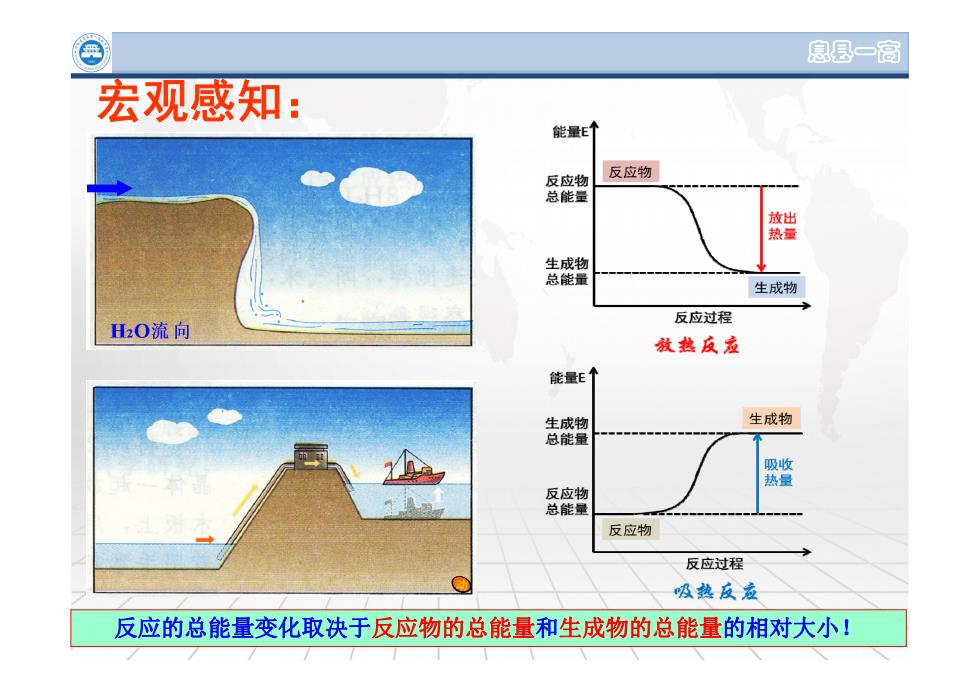
息县一高 宏观感知: 能量E个 反应物 反应物 总能量 热兰 生成物 总能量 生成物 反应过程 H2O流向 放热反孟 能量E个 生成物 生成物 总能量 吸收 热量 反应物 总能量 反应物 反应过程 吸热反意 反应的总能量变化取决于反应物的总能量和生成物的总能量的相对大小!
息县一高 反应的总能量变化取决于反应物的总能量和生成物的总能量的相对大小! 宏观感知:

息县一高 学习任务3 微观探析和模型认知 氢气在氯气中燃烧,苍白色的火焰 点燃 H2+Cl2 2HCI 反应为什么放热?热量从哪儿来? 合作交流-一-自主学习-阅读课 本32页相关内容
息县一高 学习任务3 微观探析和模型认知 氢气在氯气中燃烧,苍白色的火焰 反应为什么放热?热量从哪儿来? 合作交流-自主学习-阅读课 本32页相关内容 H 2 + Cl2 2HCl 点燃

息县一高 H2 十 Cl2 点炼 2HCI H—H CI-CI 断开1molH一H键要 断开1molC一C1键要 吸收436kJ的能量 吸收243kJ的能量 2H 2CI 形成2molH一Cl键要 2H-CI 放出2×431kJ的能量 Q=(431+431)kJ-(436+243)kJ=183kJ放出热量 862kJ> 679kJ
息县一高 H2 + Cl2 2HCl 2H H—H 断开1molH-H键要 吸收436kJ的能量 Cl —Cl 断开1molCl —Cl键要 吸收243kJ的能量 2Cl 2H—Cl 形成2molH —Cl键要 放出2×431kJ的能量 Q = (431+431)kJ – (436 + 243)kJ = 183kJ 放出热量 862kJ > 679kJ

息县一高 H2+Cl2 点燃 2HCI 下图能量变化以2摩尔氯化氢生成为例 E (kJ) 2H+2CI 679kJ 862kJ 断键吸收能量 成键放出能量 H2+Cl2 反应物 反应物 △E=183kJ 总能量 2HCI 生成物 生成物 总能量 反应历 程
息县一高 E (kJ) 反 应 历 程 H2 + Cl2 2H + 2Cl 2HCl △E = 183 kJ 断键吸收能量 679 kJ 反应物 反应物 总能量 生成物 生成物 总能量 成键放出能量 862 kJ H2+Cl2 2HCl 下图能量变化以2摩尔氯化氢生成为例