
化学科学中最有 创造性的工作就 是设计和制备物 质,为人类造福
化学科学中最有 创造性的工作就 是设计和制备物 质,为人类造福

再探乙酸乙酯的制备
再探乙酸乙酯的制备

实验重现 在一支试管中加入3L无水乙醇,然后边振荡试管边慢慢加入2 mL浓硫酸和2mL冰醋酸;按图连接好装置,用酒精灯缓慢加热, 将产生的蒸气经导管通到滴有酚酞的饱和碳酸钠溶液的液面上。 乙醇+乙酸 +农硫酸 饱和 Na2CO: 溶液 反应 浓硫酸 CH3COOH④+C2HsOH① CH3C002Hs)+H200 原理 (1) 加热试管,溶液逐渐沸腾,并有蒸汽蒸出,经长导管冷凝为液 实验 体后滴入试管,反应液逐渐变为浅棕色。 现象 (2) 饱和碳酸钠溶液的液面上有不溶于水的透明液体产生。 (3) 震荡试管,静止后溶液分层,滴有酚酞的饱和碳酸钠溶夜颜色变浅, 上层液体无色、有香味
实验重现 在一支试管中加入3 mL 无水乙醇,然后边振荡试管边慢慢加入2 mL 浓硫酸和2 mL 冰醋酸;按图连接好装置,用酒精灯缓慢加热, 将产生的蒸气经导管通到滴有酚酞的饱和碳酸钠溶液的液面上。 CH 3 COOH (l) +C 2 H 5 OH (l) CH 3 COOC 2 H 5 (l)+H 2 O(l) 浓硫酸 △ 反应 原理 实验 现象 (2)饱和碳酸钠溶液的液面上有不溶于水的透明液体产生。 (3)震荡试管,静止后溶液分层,滴有酚酞的饱和碳酸钠溶夜颜色变浅, 上层液体无色、有香味。 (1)加热试管,溶液逐渐沸腾,并有蒸汽蒸出,经长导管冷凝为液 体后滴入试管,反应液逐渐变为浅棕色

问题探究分组讨论实验中采取了哪些有利于乙酸乙酯制备的措施? 多(平衡) 加入乙醇过量、浓硫酸吸水、加 热及时蒸出产物,提高平衡产率 快(速率) 加热、加入浓硫酸作催化剂、使用 物质 无水乙醇和冰醋酸,均可加快反应 制备 好(纯度) 饱和碳酸钠吸收乙醇,中和乙酸, 实验 降低乙酸乙酯的溶解度,提高纯度 原则 省(成本) 廉价原料过量,提高昂贵原料转 化率,提高平衡产率,节省成本。 绿色、安全
问题探究 多 快 好 省 (速率) (平衡) (成本) (纯度) 分组讨论实验中采取了哪些有利于乙酸乙酯制备的措施? 加入乙醇过量、浓硫酸吸水、加 热及时蒸出产物,提高平衡产率 加热、加入浓硫酸作催化剂、使用 无水乙醇和冰醋酸,均可加快反应 饱和碳酸钠吸收乙醇,中和乙酸, 降低乙酸乙酯的溶解度,提高纯度 廉价原料过量,提高昂贵原料转 化率,提高平衡产率,节省成本。 绿色、安全 物质 制备 实验 原则 问题探究

发现质疑 各小组结合乙酸乙酯制备实验展开讨论,每个小组至少提 出一个问题?【课前预习】 7有及有比农硫骏更多的 律化剂:这种雅化剂不易引发别反应 6在样少2酵尔乙酸的掉传7 只用乙醇和乙商爱制天乙酸乙酯写 牛直接力热有期些整端】 3在加热过程中反在家渐变为浅棉包,莫限田是了 2可不西人先办入乙两发、再力=入农石东西酸和乙西享 )本欢实王十渔鱼利淡州函量有导罩大原因误计人? 8 过量南2骏与2吨座达的年同有太? 能不能酒过理花家量计加以强明
发现质疑 各小组结合乙酸乙酯制备实验展开讨论,每个小组至少提 出一个问题?【课前预习】

问题探究 1、本实验中催化剂浓硫酸的量有异常,其原因是什么? 2、过量乙醇对乙酸与乙醇酯化反应的产率影响有多大? 能不能通过理论定量计算加以说明。 3、在加热过程中反应液逐渐变为浅棕色,其原因是什么? 直接加热有那些弊端?
1、本实验中催化剂浓硫酸的量有异常,其原因是什么? 问题探究 2、过量乙醇对乙酸与乙醇酯化反应的产率影响有多大? 能不能通过理论定量计算加以说明。 3、在加热过程中反应液逐渐变为浅棕色,其原因是什么? 直接加热有那些弊端?

问题 1、本实验中催化剂浓硫酸的量有异常,其原因是什么? 探究 OH CH.C.OH CH.COH OH ① ② CH3-C-OH ③ HOC2H5 QH CH3-C-OH2 CH3C-OC2H5 0C2H5 浓硫酸作用 微观 脱水剂 宏观 催化剂 吸水剂
问题 1、本实验中催化剂浓硫酸的量有异常,其原因是什么? 探究 浓硫酸作用 微观 脱水剂 宏观 催化剂 吸水剂 H2O O CH3C-OH H + +OH CH3C-OH HOC2H5 CH3 -C-OH OH HOC2H5 + CH3 -C-OH2 OH OC2H5 + +OH CH3C-OC2H5 O CH3C-OC2H5 H+ + H+ ① ② ③ ④ ⑤

问题 2、过量乙醇对乙酸与乙醇酯化反应的产率影响有多大?能 探究 不能通过理论定量计算加以说明。 K→现有条件难以查到数据 已知:△G=AH-T△S,△G-一RT1nK。R为气体常数。请估算乙酸和乙 醇生成酯的反应在常温常压下的平衡常数。 0 CH,-C+o+H40-cm,CH、一 CH,-Co-CH,CH +H0-H 断裂的键为碳氧键和氢氧键,生成的键也为碳氧键和氢氧键, 反应前后键能变化很小,因此该反应反应热△H≈0kJo。 反应物和生成物均为液态,反应熵变很小,△S≈0kJo1kl △G=△H-T△S≈0 -RT1nK≈0 K=1
2、过量乙醇对乙酸与乙醇酯化反应的产率影响有多大?能 不能通过理论定量计算加以说明。 问题 探究 K 现有条件难以查到数据 CH3-C-OH + H-O-CH2CH3 - O - CH3-C-O-CH2CH3 - O - + H-O -H 断裂的键为碳氧键和氢氧键 ,生成的键也为碳氧键和氢氧键, 因此该反应反应热 ΔH ≈ 0 kJ·mol -1 。 反应物和生成物均为液态,反应熵变很小,ΔS ≈0 kJ·mol -1·k-1 ΔG =ΔH-T ΔS -RT lnK ≈0 K=1 反应前后键能变化很小, ≈0 已知:ΔG =ΔH-T ΔS ,ΔG=-RT lnK。R为气体常数。请估算乙酸和乙 醇生成酯的反应在常温常压下的平衡常数

问题 2、过量乙醇对乙酸与乙醇酯化反应的产率影响有多大?能 探究 不能通过理论定量计算加以说明。 根据估算的平衡常数,计算常温常压下,无水乙醇与冰醋酸分别以 物质的量比1:1,和10:1投料时,反应的平衡产率? 浓硫酸 CH,c0OHM+C,H,oH0 CH COOC2 Hs(1)+H2 O(1) 设平衡时反应的乙醇物质的量为X x2 10:1时 =1 x≈0.91 平衡产率=91% (10-x)(1-x) 个41% x2 1:1时 =1 x=0.5 平衡产率=50% (1-x)(1-x) 精 10:1时 计算120C时 平衡产率=97% 30% 1:1时 平衡产率=67%
CH 3 COOH (l) +C 2 H 5 OH (l) CH 3 COOC 2 H 5 (l)+H 2 O(l) 浓硫酸 △ 问题 探究 根据估算的平衡常数,计算常温常压下,无水乙醇与冰醋酸分别以 物质的量比1∶1,和10∶1投料时,反应的平衡产率? 2、过量乙醇对乙酸与乙醇酯化反应的产率影响有多大?能 不能通过理论定量计算加以说明。 设平衡时反应的乙醇物质的量为 x 10∶1时 (10- x)(1- x) =1 x ≈ 0.91 平衡产率= 91% x 2 (1- x) (1- x) =1 x = 0.5 x 2 1∶1时 平衡产率= 50% 41% 精确计算120℃时 1∶1时 平衡产率= 67% 10∶1时 平衡产率= 97% 30%
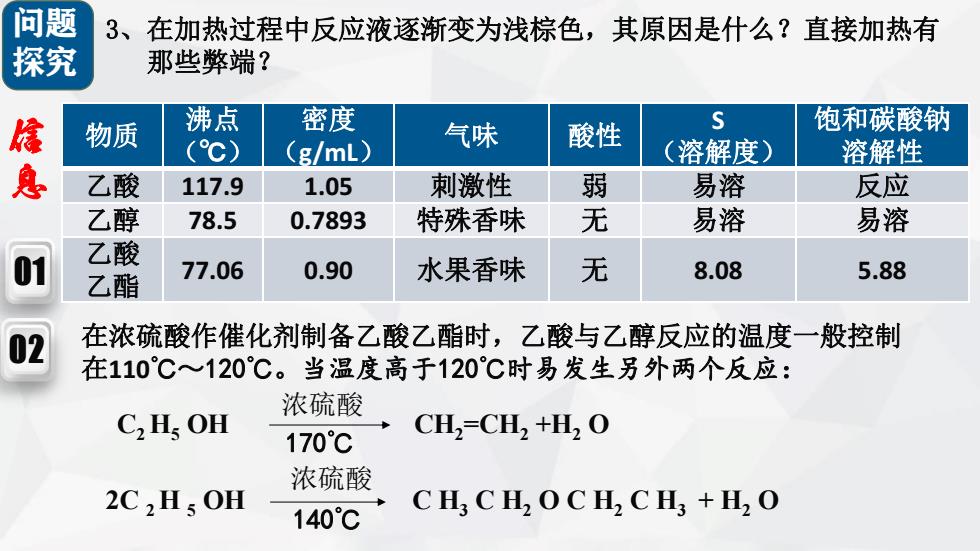
问题 3、在加热过程中反应液逐渐变为浅棕色,其原因是什么?直接加热有 探究 那些弊端? 途 物质 沸点 密度 气味 酸性 s 饱和碳酸钠 (℃) (g/mL) (溶解度) 溶解性 乙酸 117.9 1.05 刺激性 弱 易溶 反应 乙醇 78.5 0.7893 特殊香味 无 易溶 易溶 乙酸 乙酯 77.06 0.90 水果香味 无 8.08 5.88 02 在浓硫酸作催化剂制备乙酸乙酯时,乙酸与乙醇反应的温度一般控制 在110℃~120℃。当温度高于120°℃时易发生另外两个反应: 浓硫酸 C2 Hs OH 170℃ CH2=CH2 +H2 O 浓硫酸 2C2Hs OH 140°C CH,CHOCH2 CH3+O
问题 探究 3、在加热过程中反应液逐渐变为浅棕色,其原因是什么?直接加热有 那些弊端? 01 02 物质 沸点 (℃) 密度 (g/mL) 气味 酸性 S (溶解度) 饱和碳酸钠 溶解性 乙酸 117.9 1.05 刺激性 弱 易溶 反应 乙醇 78.5 0.7893 特殊香味 无 易溶 易溶 乙酸 乙酯 77.06 0.90 水果香味 无 8.08 5.88 浓硫酸 170℃ C2 H5 OH CH2 =CH2 +H2 O 在浓硫酸作催化剂制备乙酸乙酯时,乙酸与乙醇反应的温度一般控制 在110℃~120℃。当温度高于120℃时易发生另外两个反应: 信 息 浓硫酸 140℃ 2C 2 H 5 OH C H3 C H2 O C H2 C H3 + H2 O