
第三章第二节铁的重要化合物一一铁盐和亚铁盐 【素养目标】 1.依据化合价理论,结合实验探究,掌握F©、Fe3相互转化的途径,强化变化 观念。 2通过实验探究学会Fe2*、Fe3*的检验方法,培养证据推理意识,提升实验探究 能力与创新意识。 【教学重点、难点】 1.Fe*、Fe2*的检验2.探究Fc2+与Fe的相互转化的条件 【引入】播放新闻视频“麦片中通过添加铁粉来增加铁含量”,引起同学们对人 体如何补铁进行的思考:做为一名药品质检员,你是不是要考虑这样两个问题 药品有没有变质?药品是真的吗? 学完本节课的内容,掌握本节课的重难点(幻灯片展示素养目标和教学重点和难 点),争取做一名质检员。 【师生共同回忆】从物质的分类角度认识常见的铁盐和盐铁盐,完成学案上表格 亚铁盐 铁盐 组成 含有的盐 含有的盐 常见物质FeSO47HO、FeC等FeCl、Fez(SO等 【学生自主学习】请同学们结合上节课学过铁的氢氧化物的知识,自主阅读学习 课本60一61页内容,分组讨论,总结出Fe”、Fe”的检验方法。 方法 Fe2 ① ② ⑨ 【学生】汇报本小组讨论结果 【总结】以上几位同学提出了,观察颜色、加入NaOH、加KSCN试剂等3种方 法检验离子。 【重点讲解】课本61页【实验3-10】在两支试管里分别加入5mL的FeCl:溶液
第三章第二节 铁的重要化合物——铁盐和亚铁盐 【素养目标】 1.依据化合价理论,结合实验探究,掌握 Fe2+、Fe3+相互转化的途径,强化变化 观念。 2.通过实验探究学会 Fe2+ 、Fe3+ 的检验方法,培养证据推理意识,提升实验探究 能力与创新意识。 【教学重点、难点】 1. Fe3+、Fe2+的检验 2. 探究 Fe2+与 Fe3+的相互转化的条件 【引入】播放新闻视频“麦片中通过添加铁粉来增加铁含量”,引起同学们对人 体如何补铁进行的思考:做为一名药品质检员,你是不是要考虑这样两个问题 药品有没有变质?药品是真的吗? 学完本节课的内容,掌握本节课的重难点(幻灯片展示素养目标和教学重点和难 点),争取做一名质检员。 【师生共同回忆】从物质的分类角度认识常见的铁盐和盐铁盐,完成学案上表格 亚铁盐 铁盐 组成 含有 的盐 含有 的盐 常见物质 FeSO4ꞏ7H2O、FeCl2等 FeCl3、Fe2(SO4)3 等 【学生自主学习】请同学们结合上节课学过铁的氢氧化物的知识,自主阅读学习 课本 60—61 页内容,分组讨论,总结出 Fe3+、Fe2+的检验方法。 方法 Fe3+ Fe2+ ① ② ③ 【学生】汇报本小组讨论结果 【总结】以上几位同学提出了,观察颜色、加入 NaOH、加 KSCN 试剂等 3 种方 法检验离子。 【重点讲解】课本 61 页【实验 3-10】在两支试管里分别加入 5mL 的 FeCl3 溶液
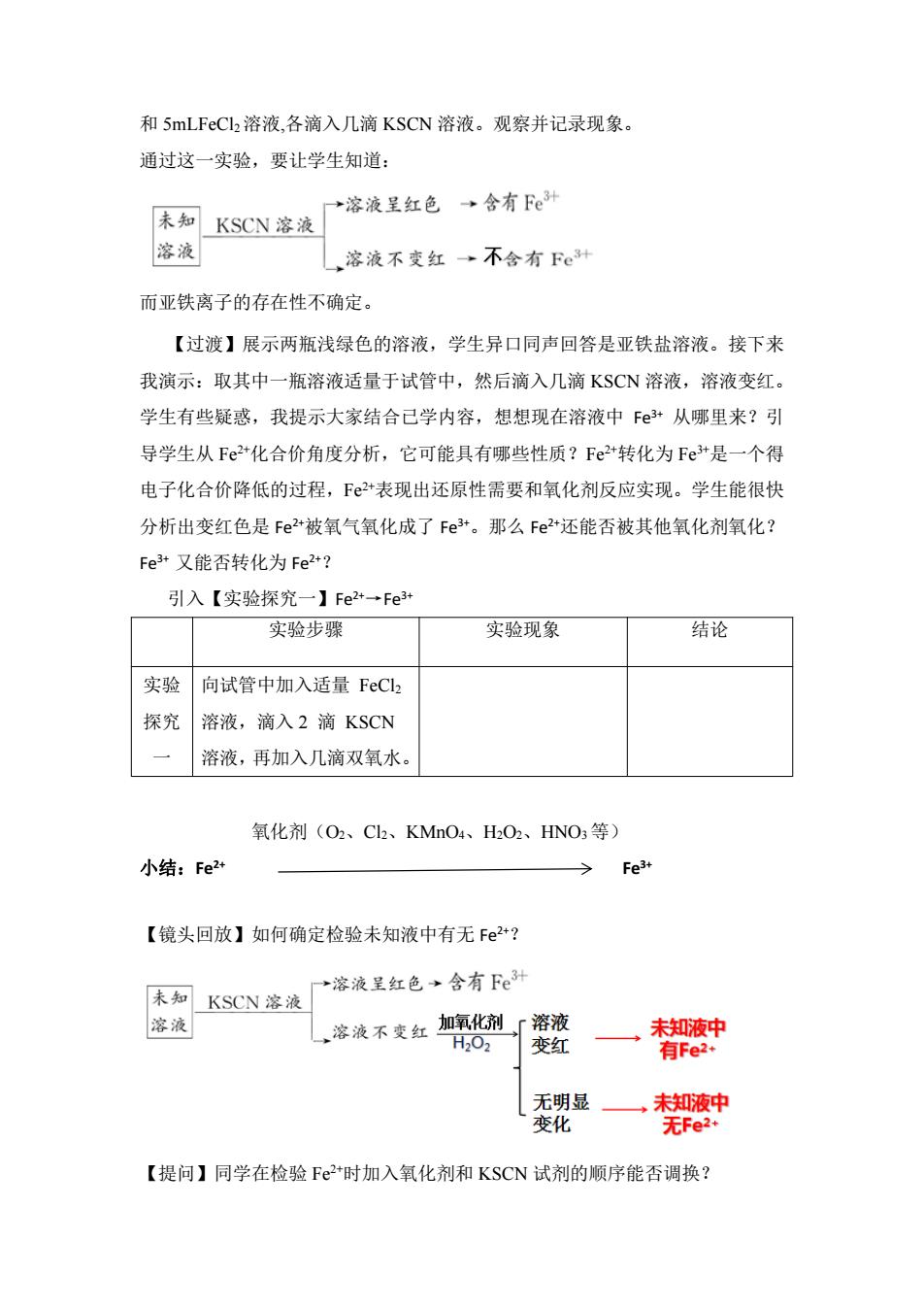
和5 mLFeCl2溶液,各滴入几滴KSCN溶液。观察并记录现象。 通过这一实验,要让学生知道 →溶液星红色→含有e 未知KSCN溶液 溶液 溶液不变红→不含有Fe种 而亚铁离子的存在性不确定。 【过波】展示两瓶浅绿色的溶液,学生异口同声回答是亚铁盐溶液。接下来 我演示:取其中一瓶溶液适量于试管中,然后滴入几滴KSCN溶液,溶液变红 学生有些疑惑,我提示大家结合已学内容,想想现在溶液中F·从哪里来?引 导学生从Fe2+化合价角度分析,它可能具有哪些性质?Fe2+转化为Fe+是一个得 电子化合价降低的过程,F®2*表现出还原性需要和氧化剂反应实现。学生能很快 分析出变红色是Fe2被氧气氧化成了Fe“。那么Fe2+还能否被其他氧化剂氧化? Fe3*又能否转化为Fe2+? 引入【实验探究一】Fe24→Fe3+ 实验步骤 实验现象 结论 实验 向试管中加入适量FeC12 探究 溶液,滴入2滴KSCN 溶液,再加入几滴双氧水 氧化剂(O2、C、KMnO4、HO2、HNO3等) 小结:Fe2 【镜头回放】如何确定检验未知液中有无F2+? 未知KSCN溶液 →溶液呈红色→含有Fe3别 溶液 ,溶液不变红加氧化剂「溶液 H02变红 月Fe 无明显一 未知液中 变化 无Fe2r 【提问】同学在检验F2*时加入氧化剂和KSCN试剂的顺序能否调换?
和 5mLFeCl2溶液,各滴入几滴 KSCN 溶液。观察并记录现象。 通过这一实验,要让学生知道: 而亚铁离子的存在性不确定。 【过渡】展示两瓶浅绿色的溶液,学生异口同声回答是亚铁盐溶液。接下来 我演示:取其中一瓶溶液适量于试管中,然后滴入几滴 KSCN 溶液,溶液变红。 学生有些疑惑,我提示大家结合已学内容,想想现在溶液中 Fe3+ 从哪里来?引 导学生从 Fe2+化合价角度分析,它可能具有哪些性质?Fe2+转化为 Fe3+是一个得 电子化合价降低的过程,Fe2+表现出还原性需要和氧化剂反应实现。学生能很快 分析出变红色是 Fe2+被氧气氧化成了 Fe3+。那么 Fe2+还能否被其他氧化剂氧化? Fe3+ 又能否转化为 Fe2+? 引入【实验探究一】Fe2+→Fe3+ 实验步骤 实验现象 结论 实验 探究 一 向试管中加入适量 FeCl2 溶液,滴入 2 滴 KSCN 溶液,再加入几滴双氧水。 氧化剂(O2、Cl2、KMnO4、H2O2、HNO3等) 小结:Fe2+ Fe3+ 【镜头回放】如何确定检验未知液中有无 Fe2+? 【提问】同学在检验 Fe2+时加入氧化剂和 KSCN 试剂的顺序能否调换?

【讲解】先加入KSCN试剂排除Fe3的干扰,然后再加入氧化剂。 【提问】Fe2+可以被还原剂还原为Fe,Fe*是否一样可以转化为Fe2+呢?我 们同样从氧化还原理论理论角度分析,可以加入还原剂实现。 引入【实验探究2】Fe→Fe2 实验向试管中加入约2mL 探究FeCl溶液,加入少量铁 粉,充分振荡,滴加几滴 KSCN溶液。 还原剂(Fe、Cu、KI、维C等) 小结:Fe 这些内容在生产和生活中有何应用呢? 【教师】实验室在保存FSO4溶液时,要加入少量的Fe粉,这是为什么? 【学生】2Fe3+Fe=3Fe2+ 【教师】学习了本节内容,你能够成为一名质检员吗? 簧补sG无现象爱来松 铁颗粒 【学生演示】 【学生】阅读二维亚铁颗粒说明书,思考Vc的作用。 【讲解】Vc可以将人体无法吸收的铁盐还原为亚铁盐。 【过渡】同学们是否真正掌握了铁盐和亚铁盐之间的相互转化?我们通过几个小 练习检测一下。 【随堂练习】 1、下列关于Fe2*和e的叙述中,错误的是( A.Fe2+的水溶液为浅绿色 B.Fe3的水溶液为黄色 C.Fe3*具有氧化性,Fe2*具有还原性 D.Fe溶液中滴入含SCN的溶液,立即出现红色沉淀 2、将铁的某种化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量
【讲解】先加入 KSCN 试剂排除 Fe3+的干扰,然后再加入氧化剂。 【提问】 Fe2+可以被还原剂还原为 Fe3+, Fe3+是否一样可以转化为 Fe2+呢?我 们同样从氧化还原理论理论角度分析,可以加入还原剂实现。 引入【实验探究 2】Fe3+→Fe2+ 实验 探究 二 向试管中加入约 2mL FeCl3 溶液,加入少量铁 粉 ,充分振荡,滴加几滴 KSCN 溶液。 还原剂(Fe、Cu、KI、维 C 等) 小结:Fe3+ Fe2+ 这些内容在生产和生活中有何应用呢? 【教师】实验室在保存 FeSO4 溶液时,要加入少量的 Fe 粉,这是为什么? 【学生】2Fe3++Fe= 3Fe2+ 【教师】学习了本节内容,你能够成为一名质检员吗? 【学生演示】 【学生】阅读二维亚铁颗粒说明书,思考 Vc 的作用。 【讲解】Vc 可以将人体无法吸收的铁盐还原为亚铁盐。 【过渡】同学们是否真正掌握了铁盐和亚铁盐之间的相互转化?我们通过几个小 练习检测一下。 【随堂练习】 1、下列关于 Fe2+ 和 Fe3+ 的叙述中,错误的是( ) A.Fe2+ 的水溶液为浅绿色 B.Fe3+ 的水溶液为黄色 C.Fe3+ 具有氧化性,Fe2+ 具有还原性 D.Fe3+ 溶液中滴入含 SCN- 的溶液,立即出现红色沉淀 2、将铁的某种化合物溶于盐酸,滴加 KSCN 溶液不发生颜色变化,再加入适量

氯水,溶液立即呈红色则此铁的化合物是() A、FezO3B、FeCl3C、Fez(SO45D、FeO 3.下列离子的检验方法合理的是() A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2 B.向某溶液中通入C2,然后再加入KSCN溶液变红色,说明原溶液中含 有Fe2 C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红 褐色,说明原溶液中含有Fe2*,不含有Mg 4.某化学小组为验证Fe与Fe*能够相互转化,进行如下实验。 实验操作 对应现象 ①向FeCl,溶液中加入过量铁粉 1.溶液由黄色变为浅绿色 ②滴加KSCN溶液 ⅱ溶液无明显变化 ③再滴加几滴氯水 ⅱ溶液变红 下列分析不合理的是( A.解释现象i的反应:2Fe++Fe一3Fe21 B.实验②与③可以调换顺序 C.溶液变红涉及反应:Ch+2Fe2*一2C1+2Fe3 D.氧化性:Cl>Fe3>Fe2 5.(能力提升)要证明某溶液中不含Fe*而可能含Fe2*,有如下实验操作: ①加足量新制氯水②加足量酸性KMO:溶液③加少量KSCN溶液, 则最佳顺序是 A.①③ B.③② c.③① D.①②③ 六、课后作业 1、阅读课本62页资料卡片并完成实践活动。 2、在作业本上完成课本63页习题的第9、11题
氯水,溶液立即呈红色.则此铁的化合物是( ) A、Fe2O3 B、FeCl3 C、Fe2(SO4)3 D、FeO 3.下列离子的检验方法合理的是 ( ) A.向某溶液中滴入 KSCN 溶液呈红色,说明原溶液中不含 Fe2+ B.向某溶液中通入 Cl2,然后再加入 KSCN 溶液变红色,说明原溶液中含 有 Fe2+ C.向某溶液中加入 KSCN 溶液呈红色,说明原溶液中含有 Fe3+ D.向某溶液中加入 NaOH 溶液得白色沉淀,又观察到沉淀颜色逐渐变为红 褐色,说明原溶液中含有 Fe2+ ,不含有 Mg2+ 4.某化学小组为验证 Fe3+ 与 Fe2+ 能够相互转化,进行如下实验。 实验操作 对应现象 ①向 FeCl3 溶液中加入过量铁粉 ⅰ.溶液由黄色变为浅绿色 ⅱ.溶液无明显变化 ⅲ.溶液变红 ②滴加 KSCN 溶液 ③再滴加几滴氯水 下列分析不合理的是( ) A.解释现象ⅰ的反应:2Fe3+ +Fe===3Fe2+ B.实验②与③可以调换顺序 C.溶液变红涉及反应:Cl2+2Fe2+ ===2Cl- +2Fe3+ D.氧化性:Cl2>Fe3+ >Fe2+ 5.(能力提升)要证明某溶液中不含 Fe3+ 而可能含 Fe2+ ,有如下实验操作: ①加足量新制氯水 ②加足量酸性 KMnO4溶液 ③加少量 KSCN 溶液, 则最佳顺序是 ( ) A.①③ B.③② C.③① D.①②③ 六、课后作业 1、阅读课本 62 页资料卡片并完成实践活动。 2、在作业本上完成课本 63 页习题的第 9、11 题