
第一章过关检测 (时间:90分钟满分:100分) 一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题 意) 1.下列说法中正确的是()。 A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 B.凡是在加热或点燃条件下进行的反应都是吸热反应 C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式 D.氢气在氧气中燃烧生成H2O(g)的热化学方程式是2H2(g十O2(g,一2H2O(g) △H=-483.6kJ 答案:C 解析:热化学方程式需写出物质的聚集状态,A项错误;放热反应也可能在加热或 ,点燃条件下进行,B项错误:D项△H的单位错误,应为kJ-mol-1。 2.下列关于化学反应与能量变化的说法正确的是()。 A.放热反应的发生无需任何条件 B.化学键的断裂和形成与反应放热和吸热无关 C.化学反应过程都伴随着能量的变化 D.硫酸与NaOH的反应是吸热反应 答案:C 解析:放热反应的发生可能需要条件,例如加热、点燃等,A项错误;化学键的断裂 和形成过程中吸收的能量与放出的能量不同,才有化学反应的放热和吸热,B项错 误:化学反应过程都伴随着能量的变化,C项正确:酸碱中和反应都是放热反应,D 项错误。 3.下列关于△H的说法正确的是( 焓H↑ 反应物 生成物 A.反应过程中,消耗的反应物越多,△H越大 B.△>O时反应放热,△H<0时反应吸热 C,△H越大,说明反应放出的热量越多 D.能量变化如图所示的化学反应为放热反应,△H为” 答案D 解析:△H与化学方程式中的化学计量数有关,与反应物的用量无关,A项错误。 △H0时反应吸热,△H<0时反应放热,B项错误。反应放出的热量越多,△H越小
第一章过关检测 (时间:90 分钟 满分:100 分) 一、选择题(本题共 15 小题,每小题 3 分,共 45 分。每小题只有一个选项符合题 意) 1.下列说法中正确的是( )。 A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 B.凡是在加热或点燃条件下进行的反应都是吸热反应 C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式 D.氢气在氧气中燃烧生成 H2O(g)的热化学方程式是 2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ 答案:C 解析:热化学方程式需写出物质的聚集状态,A 项错误;放热反应也可能在加热或 点燃条件下进行,B 项错误;D 项 ΔH 的单位错误,应为 kJ·mol-1。 2.下列关于化学反应与能量变化的说法正确的是( )。 A.放热反应的发生无需任何条件 B.化学键的断裂和形成与反应放热和吸热无关 C.化学反应过程都伴随着能量的变化 D.硫酸与 NaOH 的反应是吸热反应 答案:C 解析:放热反应的发生可能需要条件,例如加热、点燃等,A 项错误;化学键的断裂 和形成过程中吸收的能量与放出的能量不同,才有化学反应的放热和吸热,B 项错 误;化学反应过程都伴随着能量的变化,C 项正确;酸碱中和反应都是放热反应,D 项错误。 3.下列关于 ΔH 的说法正确的是( )。 A.反应过程中,消耗的反应物越多,ΔH 越大 B.ΔH>0 时反应放热,ΔH0 时反应吸热,ΔH<0 时反应放热,B 项错误。反应放出的热量越多,ΔH 越小

反应吸收的热量越多,△H越大,C项错误。由于反应物的总焓大于生成物的总焓, 故由反应物转化为生成物时,该反应为放热反应,△H为“”,D项正确。 4.已知强酸的稀溶液与强碱的稀溶液发生中和反应,生成1olH2O时的热效应 △H=-57.3 kJ-mol-1。向1L0.5molL1NaOH溶液中分别加入:①稀醋酸、②浓疏 酸、③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,其关系正确的 是( )。 A.△H1>△H3>△H2 B.△H=△H=△H3 C.△H1<△H3<△H2 D.△H1=△H3<△H2 答案:A 解析:相同浓度、相同体积的NOH溶液与稀醋酸、浓硫酸、稀硝酸恰好完全反 应,若不考虑弱酸电离吸热和浓硫酸溶于水放热,应放出相同的热量。但实际反应 中,浓硫酸溶于水放热:CH3COOH是弱酸,电离过程吸热。比较△H、△2、△H3 的大小时,要注意其均为负值。 5.下列对H2(g+C2(g)一2HCI(g)△H=-184.6kJmo1的叙述正确的是()。 A.1分子H2和1分子C2反应,放出热量184.6kJ B.1molH2(g)完全反应生成2 mol HCI(g),放出的热量为184.6kJ C.在25℃和101kPa的条件下,1molH(g)与1 mol Cl2(g)完全反应生成2mol HCl(g),放出的热量为184.6kJ D.在25℃和101kPa的条件下,1molH2(g)与1molC(g)完全反应生成2mol HCl(g),吸收的热量为184.6kJ 答案:C 解析:热化学方程式中△H的值与具体化学反应相对应,在反应中各物质前的化学 计量数不再表示粒子数目,只表示物质的“物质的量”,所以A项中分子个数的说 法是错误的。在描述反应时应说明外界条件,而B项中没有温度和压强,该说法 也是错误的。△H<0,反应放热而非吸热,D项错误。 6.下列热化学方程式书写正确的是()。 A.C2H5OH+3O一2C02+3H20△H=-1367.0kJmo1 B.NaOH(aq)+HCI(aq)NaCl(aq)+H2O(1)AH=+57.3 kJ-mol-I C.S(s)+O2(g)-SO2(g)AH=-269.8 kJ-mol-1 D.2NO(gtO2(g)—2NO2(g)△H=-116.2kJ 答案:C 解析:热化学反应方程式要标出物质的聚集状态,A项错误:酸碱中和反应放热,△H 应小于0,B项错误;反应热△H的单位是kJol,D项错误。 7.在一定条件下,CO和CH4燃烧的热化学方程式分别为: 2C0(g+02(g)2C02(g)△H=-566kJmo1
反应吸收的热量越多,ΔH 越大,C 项错误。由于反应物的总焓大于生成物的总焓, 故由反应物转化为生成物时,该反应为放热反应,ΔH 为“-”,D 项正确。 4.已知强酸的稀溶液与强碱的稀溶液发生中和反应,生成 1 mol H2O 时的热效应 ΔH=-57.3 kJ·mol-1。向 1 L 0.5 mol·L -1 NaOH 溶液中分别加入:①稀醋酸、②浓硫 酸、③稀硝酸,恰好完全反应时的热效应分别为 ΔH1、ΔH2、ΔH3,其关系正确的 是( )。 A.ΔH1>ΔH3>ΔH2 B.ΔH1=ΔH2=ΔH3 C.ΔH1<ΔH3<ΔH2 D.ΔH1=ΔH3<ΔH2 答案:A 解析:相同浓度、相同体积的 NaOH 溶液与稀醋酸、浓硫酸、稀硝酸恰好完全反 应,若不考虑弱酸电离吸热和浓硫酸溶于水放热,应放出相同的热量。但实际反应 中,浓硫酸溶于水放热;CH3COOH 是弱酸,电离过程吸热。比较 ΔH1、ΔH2、ΔH3 的大小时,要注意其均为负值。 5.下列对 H2(g)+Cl2(g) 2HCl(g) ΔH=-184.6 kJ·mol-1 的叙述正确的是( )。 A.1 分子 H2 和 1 分子 Cl2 反应,放出热量 184.6 kJ B.1 mol H2(g)完全反应生成 2 mol HCl(g),放出的热量为 184.6 kJ C.在 25 ℃和 101 kPa 的条件下,1 mol H2(g)与 1 mol Cl2(g)完全反应生成 2 mol HCl(g),放出的热量为 184.6 kJ D.在 25 ℃和 101 kPa 的条件下,1 mol H2(g)与 1 mol Cl2(g)完全反应生成 2 mol HCl(g),吸收的热量为 184.6 kJ 答案:C 解析:热化学方程式中 ΔH 的值与具体化学反应相对应,在反应中各物质前的化学 计量数不再表示粒子数目,只表示物质的“物质的量”,所以 A 项中分子个数的说 法是错误的。在描述反应时应说明外界条件,而 B 项中没有温度和压强,该说法 也是错误的。ΔH<0,反应放热而非吸热,D 项错误。 6.下列热化学方程式书写正确的是( )。 A.C2H5OH+3O2 2CO2+3H2O ΔH=-1 367.0 kJ·mol-1 B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1 C.S(s)+O2(g) SO2(g) ΔH=-269.8 kJ·mol-1 D.2NO(g)+O2(g) 2NO2(g) ΔH=-116.2 kJ 答案:C 解析:热化学反应方程式要标出物质的聚集状态,A 项错误;酸碱中和反应放热,ΔH 应小于 0,B 项错误;反应热 ΔH 的单位是 kJ·mol-1 ,D 项错误。 7.在一定条件下,CO 和 CH4 燃烧的热化学方程式分别为: 2CO(g)+O2(g) 2CO2(g) ΔH=-566 kJ·mol-1

CH4(g+2O2(g)一CO2(g+2HO0)△H=-890kJmo 由1 mol CO和3 mol CH4组成的混合气体在上述条件下完全燃烧时,释放的热量 为( ) A.2953kJ B.3236kJ C.2588kJ D.1739kJ 答案:A 解析:根据热化学方程式可知,1 mol CO完全燃烧放出的热量是283kJ,3 mol CH4 完全燃烧放出的热量是890kJ×3=2670kJ,释放的总热量为283kJ+2670kJ=2 953kJ。 8.己知:①2H(g+O2(g)一2H00△H=-571.6 kJ-mol-I;②Ht(aq+OH(aq) H2O①△H=-57.3 kJ-mol-1。下列说法中错误的是()。 A.①式表示25℃和101kPa时,2molH2(g)和1molO2(g)完全燃烧生成2mol H20①放热571.6kJ B.2H2(g十02(g)一2H0(g)中△H-571.6kJmo1 C.将含1 mol NaOH的水溶液与50g98%的浓硫酸混合后放出的热量为57.3kJ D.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量 小于57.3kJ 答案:C 解析:C项过程还伴随着浓硫酸稀释所放出的热量,故放出的热量大于57.3kJ。 9.氧气(O2)和臭氧(O3)是氧元素的两种同素异形体。已知热化学方程式 ①4A1(s+3O2(g)一2Al2O3(S)△H ②4AI(S+2O3(g)2AhO3(S)△H2 ③302(g)一203(g)△H3 下列关系式正确的是() A.△H1-△H2=△H3 B.△H1+△H2=△H3 C.△H2-△H1=△H D.△H1+△H2+△H3=0 答案:A 解析:根据盖斯定律可知:反应式①-②得③,所以△H3=△1-△H2。 10.已知反应X+Y一M+N为放热反应,对该反应的下列说法中正确的是( A.X的能量一定高于M B.Y的能量一定高于N C.X和Y的总能量一定高于M和N的总能量 D.因该反应为放热反应,故不必加热就可发生反应
CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 由 1 mol CO 和 3 mol CH4 组成的混合气体在上述条件下完全燃烧时,释放的热量 为( )。 A.2 953 kJ B.3 236 kJ C.2 588 kJ D.1 739 kJ 答案:A 解析:根据热化学方程式可知,1 mol CO 完全燃烧放出的热量是 283 kJ,3 mol CH4 完全燃烧放出的热量是 890 kJ×3=2 670 kJ,释放的总热量为 283 kJ+2 670 kJ=2 953 kJ。 8.已知:①2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1 ;②H+ (aq)+OH- (aq) H2O(l) ΔH=-57.3 kJ·mol-1。下列说法中错误的是( )。 A.①式表示 25 ℃和 101 kPa 时,2 mol H2 (g)和 1 mol O2(g)完全燃烧生成 2 mol H2O(l)放热 571.6 kJ B.2H2(g)+O2(g) 2H2O(g)中 ΔH>-571.6 kJ·mol-1 C.将含 1 mol NaOH 的水溶液与 50 g 98%的浓硫酸混合后放出的热量为 57.3 kJ D.将含 1 mol NaOH 的稀溶液与含 1 mol CH3COOH 的稀溶液混合后放出的热量 小于 57.3 kJ 答案:C 解析:C 项过程还伴随着浓硫酸稀释所放出的热量,故放出的热量大于 57.3 kJ。 9.氧气(O2)和臭氧(O3)是氧元素的两种同素异形体。已知热化学方程式: ①4Al(s)+3O2(g) 2Al2O3(s) ΔH1 ②4Al(s)+2O3(g) 2Al2O3(s) ΔH2 ③3O2(g) 2O3(g) ΔH3 下列关系式正确的是( )。 A.ΔH1-ΔH2=ΔH3 B.ΔH1+ΔH2=ΔH3 C.ΔH2-ΔH1=ΔH3 D.ΔH1+ΔH2+ΔH3=0 答案:A 解析:根据盖斯定律可知:反应式①-②得③,所以 ΔH3=ΔH1-ΔH2。 10.已知反应 X+Y M+N 为放热反应,对该反应的下列说法中正确的是( )。 A.X 的能量一定高于 M B.Y 的能量一定高于 N C.X 和 Y 的总能量一定高于 M 和 N 的总能量 D.因该反应为放热反应,故不必加热就可发生反应

答案:C 解析:该反应为放热反应,所以反应物的总能量大于生成物的总能量,即X和Y的 总能量一定高于M和N的总能量,A、B两项错误,C项正确:反应的放热、吸热 与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反 应,D项错误。 11.通过以下反应均可获取H2。下列有关说法正确的是()。 ①太阳光催化分解水制氢:2H2O①一2H2(g+O2(g)△H1=+571.6kJmo ②焦炭与水反应制氢:C(s十H2O(g)一CO(g+H2(g)△H=+131.3kJmo ③甲烷与水反应制氢:CH4(g+H2O(g,一CO(g十3H2(g)△H3=+206.1kJmo A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用不同的催化剂,△H不同 D.反应CH4(g)一C(s十2H(g)的△H=+74.8 kJ-mol-! 答案D 解析:太阳光催化分解水制氢气,是光能转化为化学能,A项错误;反应②的△H2>0, 故该反应为吸热反应,B项错误;△H3只与反应的始态和终态有关,使用不同的催化 剂,△H3相同,C项错误;根据盖斯定律,目标反应CH4(g,一C(S十2H2(g)相当于③ ②,故△H=△H3-△H2,△H=206.1 kJ-mol-1-131.3 kJ-mol-1=74.8 kJ-mol-1,D项正确。 12.将1gH2与4gO2在点燃条件下充分反应,放出71.45kJ热量。在相同条件 下,1molH2在足量O2中完全燃烧放出的热量是( A.71.45kJ B.142.9kJ C.571.6kJ D.285.8kJ 答案D 解析:1gH2与4gO2反应时,H2剩余,实际参加反应的H2为0.5g,1molH2的质量 为2g,因此1olH2在02中完全燃烧放出的热量为71.45kJ×4=285.8kJ。 13.已知热化学方程式: ①C2H(g十02(g,一2C02(g+H00△H1=-1301.0kJmo ②C(s+02(g)C02(g)△H2=-393.5kJmo1 ③H2(g+202(g,一H00△H=285.8kJmo 则反应④2C(s+H2(g)C2H(g)的△H为()。 A.+228.2 kJ.mol- B.-228.2 kJ-mol-1 C.+1301.0kJmo D.+621.7 kJ-mol-1
答案:C 解析:该反应为放热反应,所以反应物的总能量大于生成物的总能量,即 X 和 Y 的 总能量一定高于 M 和 N 的总能量,A、B 两项错误,C 项正确;反应的放热、吸热 与反应条件(如加热)无关,某些放热反应也需要加热才能反应,如氢气和氧气的反 应,D 项错误。 11.通过以下反应均可获取 H2。下列有关说法正确的是( )。 ①太阳光催化分解水制氢:2H2O(l) 2H2(g)+O2(g) ΔH1=+571.6 kJ·mol-1 ②焦炭与水反应制氢:C(s)+H2O(g) CO(g)+H2(g) ΔH2=+131.3 kJ·mol-1 ③甲烷与水反应制氢:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1 A.反应①中电能转化为化学能 B.反应②为放热反应 C.反应③使用不同的催化剂,ΔH3 不同 D.反应 CH4(g) C(s)+2H2(g)的 ΔH=+74.8 kJ·mol-1 答案:D 解析:太阳光催化分解水制氢气,是光能转化为化学能,A 项错误;反应②的 ΔH2>0, 故该反应为吸热反应,B 项错误;ΔH3 只与反应的始态和终态有关,使用不同的催化 剂,ΔH3 相同,C 项错误;根据盖斯定律,目标反应 CH4(g) C(s)+2H2(g)相当于③- ②,故 ΔH=ΔH3-ΔH2,ΔH=206.1 kJ·mol-1 -131.3 kJ·mol-1=74.8 kJ·mol-1 ,D 项正确。 12.将 1 g H2 与 4 g O2 在点燃条件下充分反应,放出 71.45 kJ 热量。在相同条件 下,1 mol H2 在足量 O2 中完全燃烧放出的热量是( )。 A.71.45 kJ B.142.9 kJ C.571.6 kJ D.285.8 kJ 答案:D 解析:1 g H2 与 4 g O2 反应时,H2 剩余,实际参加反应的 H2为 0.5 g,1 mol H2 的质量 为 2 g,因此 1 mol H2 在 O2 中完全燃烧放出的热量为 71.45 kJ×4=285.8 kJ。 13.已知热化学方程式: ①C2H2(g)+5 2 O2(g) 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1 ②C(s)+O2(g) CO2(g) ΔH2=-393.5 kJ·mol-1 ③H2(g)+1 2 O2(g) H2O(l) ΔH3=-285.8 kJ·mol-1 则反应④2C(s)+H2(g) C2H2(g)的 ΔH 为( )。 A.+228.2 kJ·mol-1 B.-228.2 kJ·mol-1 C.+1 301.0 kJ·mol-1 D.+621.7 kJ·mol-1
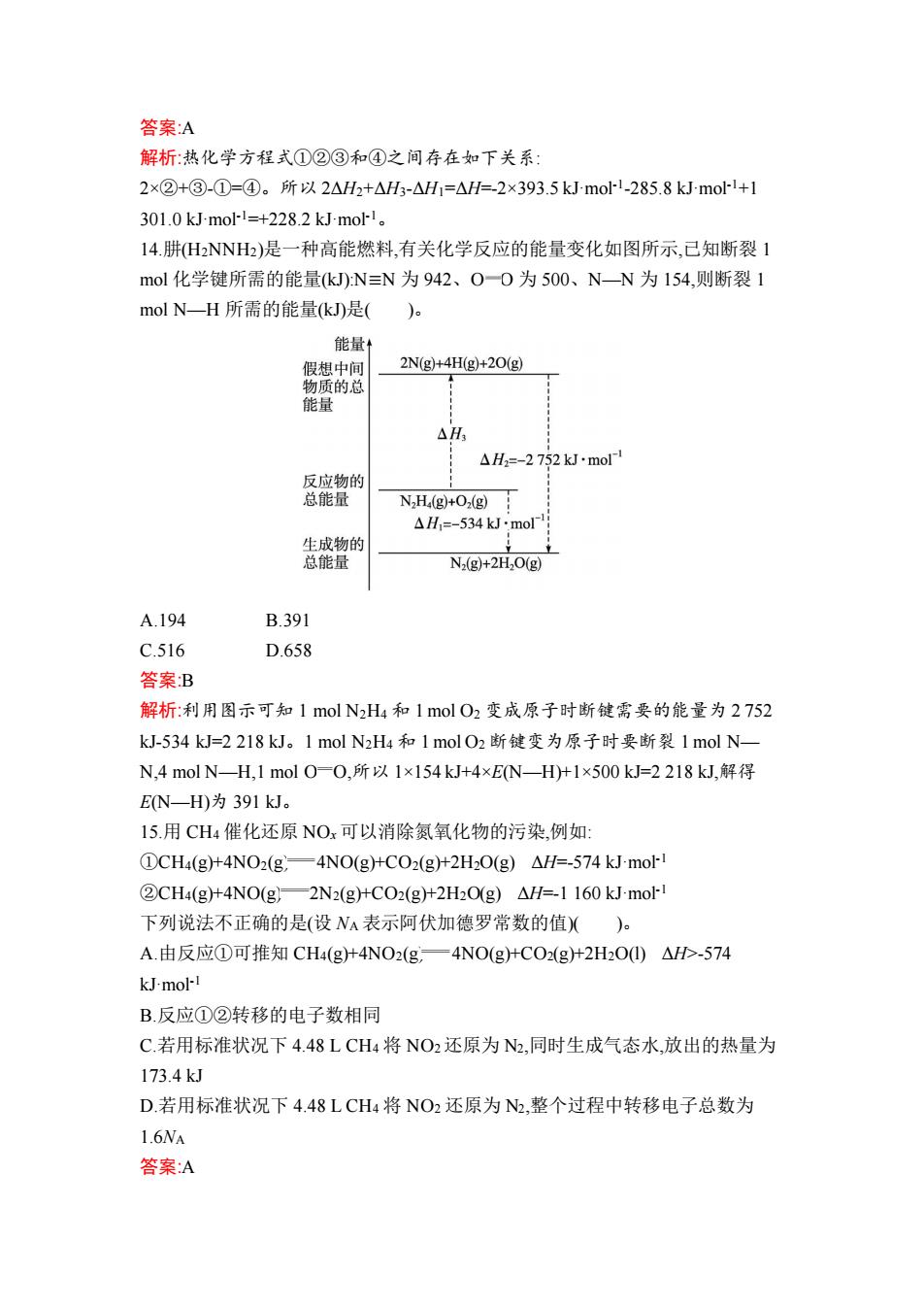
答案:A 解析:热化学方程式①②③和④之间存在如下关系: 2×②+③-①=④。所以2△H2+△H3-△H1=△H=-2×393.5 kJmol-1-285.8 kJ-mol-1+1 301.0kJmo1=+228.2 kJ.mol-1。 14.肼H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,己知断裂1 mol化学键所需的能量(kJ):N≡N为942、O-一0为500、N-N为154,则断裂1 molN一H所需的能量(k是( 能量 假想中间 2N(g)+4H(g)+2O(g) 物质的总 能量 △H △H2=-2752kJ·molr 反应物的 总能量 N2H,(g)+O2(g) △H1=-534 kJ.mol 生成物的 总能量 N2(g)+2H2O(g) A.194 B.391 C.516 D.658 答案B 解析:利用图示可知1molN2H4和1olO2变成原子时断键需要的能量为2752 kJ-534kJ=2218kJ。1molN2H4和1molO2断键变为原子时要断裂1molN一 N,4molN-H,1molO=O,所以1×154kJ+4×EN—H)+1×500kJ=2218kJ,解得 EN—H)为391kJ。 15.用CH4催化还原NOx可以消除氮氧化物的污染,例如 ①CH4(g+4NO2(g,一4NO(gHCO2(g+2HO(g)△H=-574 kJ-mol-1 ②CH4(g+4NO(g)一2N2(g+CO2(g十2HO(g)△H=-1160 kJ-mol-I 下列说法不正确的是(设NA表示阿伏加德罗常数的值)(). A.由反应①可推知CH4(g+4NO2(g,一4NO(g+CO2(g+2H2O0)△HD-574 kJmol-I B.反应①②转移的电子数相同 C.若用标准状况下448LCH4将NO2还原为N2,同时生成气态水,放出的热量为 173.4kJ D.若用标准状况下4.48LCH4将NO2还原为N2,整个过程中转移电子总数为 1.6NA 答案:A
答案:A 解析:热化学方程式①②③和④之间存在如下关系: 2×②+③-①=④。所以 2ΔH2+ΔH3-ΔH1=ΔH=-2×393.5 kJ·mol-1 -285.8 kJ·mol-1+1 301.0 kJ·mol-1=+228.2 kJ·mol-1。 14.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂 1 mol 化学键所需的能量(kJ):N≡N 为 942、O O 为 500、N—N 为 154,则断裂 1 mol N—H 所需的能量(kJ)是( )。 A.194 B.391 C.516 D.658 答案:B 解析:利用图示可知 1 mol N2H4 和 1 mol O2 变成原子时断键需要的能量为 2 752 kJ-534 kJ=2 218 kJ。1 mol N2H4 和 1 mol O2 断键变为原子时要断裂 1 mol N— N,4 mol N—H,1 mol O O,所以 1×154 kJ+4×E(N—H)+1×500 kJ=2 218 kJ,解得 E(N—H)为 391 kJ。 15.用 CH4 催化还原 NOx 可以消除氮氧化物的污染,例如: ①CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1 ②CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1 下列说法不正确的是(设 NA 表示阿伏加德罗常数的值)( )。 A.由反应①可推知 CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(l) ΔH>-574 kJ·mol-1 B.反应①②转移的电子数相同 C.若用标准状况下 4.48 L CH4 将 NO2还原为 N2,同时生成气态水,放出的热量为 173.4 kJ D.若用标准状况下 4.48 L CH4 将 NO2 还原为 N2,整个过程中转移电子总数为 1.6NA 答案:A

解析:水蒸气冷凝为液态水需要释放热量,所以CH4(g十4NO2(g,一 4NO(g)+CO2(g)+2H2O(1) △H0的反应有 (3)等质量的煤分别通过以上两个不同的途径产生的可利用的总能量关系正确的 是 A.a比b多 B.a比b少 C.a与b在理论上相同 D.两者无法比较 (4)根据能量守恒定律,E1、E2、E3、E4之间的关系为 答案(1)煤的利用率高;变成气体燃料后,燃料可充分燃烧(2)②(3)C (4)E1=E2+E3+E4 解析:(2)题给四个反应中①③④为放热反应,△H<0;②为吸热反应,△H0。 (3)根据盖斯定律,等质量的煤分别通过不同的途径产生的可利用的总能量在理论 上相同
解析:水蒸气冷凝为液态水需要释放热量,所以 CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(l) ΔH0 的反应有 。 (3)等质量的煤分别通过以上两个不同的途径产生的可利用的总能量关系正确的 是 。 A.a 比 b 多 B.a 比 b 少 C.a 与 b 在理论上相同 D.两者无法比较 (4)根据能量守恒定律,E1、E2、E3、E4 之间的关系为 。 答案:(1)煤的利用率高;变成气体燃料后,燃料可充分燃烧 (2)② (3)C (4)E1=E2+E3+E4 解析:(2)题给四个反应中①③④为放热反应,ΔH0。 (3)根据盖斯定律,等质量的煤分别通过不同的途径产生的可利用的总能量在理论 上相同

(4)根据盖斯定律可知:E1=E2+E3+E4。 17.(12分)1)已知反应2HI(g)H2(g十H2(g)△H=+11 kJ-mol1,1molH2(g)、1 mol12(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为 kJ。 (2)0.1olCh与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成 TO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式 为 (3)Si与C1两元素的单质反应生成1olSi的最高价化合物,恢复至室温,放热 687kJ,已知该化合物的熔点、沸点分别为-69℃和58℃。写出该反应的热化学 方程式: (4)NaBH4(s)与H2O①)反应生成NaBO2(s)和H2(g)。在25℃、101kPa下,已知每 消耗3.8 g NaBH4(s)放热21.6kJ,该反应的热化学方程式 是 答案:(1)299 (2)2Cl2(g)+TiO2(s)+2C(s)-TiCl4(1)+2CO(g)AH=-85.6 kJ-mol-I (3)Sis+2C2(g)3iC4(①△H=-687 kJ-mol-1 (4)NaBH4(s)+2H2O(I)NaBO2(s)+4H2(g)AH=-216.0 kJ-mol- 解析:(1)设1olHI(g)分子中化学键断裂吸收的能量为x,则2x-436kJ-151kJ=11 kJ,解得x=299kJ。 (2)根据反应物中元素的种类,可判断还原性气体为CO:另一种物质肯定含有C1、 Ti元素,由反应物中有TiO2、生成物的水解产物为TiO2xH20可知,Ti的化合价 始终为+4价,即另一种生成物的分子式为TiC14,由此写出该反应的化学方程 式:2Cl2+TiO2+2C一2CO+TiCl4,0.1molC2完全反应放热4.28kJ,则2mol氯气 完全反应可放出85.6kJ热量,该反应的热化学方程式为2C2(g十Ti02(S十2C(s) TiCl4①0+2CO(g)△H=-85.6 kJmol-1。 (3)Si与C2反应生成SiC4,SiCl4的熔,点为-69℃,沸点为58℃,说明室温下SiCl4 为液体,生成1ol液态SiC4放热687kJ,据此可写出反应的热化学方程式。 (4)根据题中“每消耗3.8 g NaBH4(S)放热21.6k可得出此反应的热化学方程式 为NaBH4(s+2H2O0一NaBO2(s+4H2(g)△H=-216.0 kJ-mol-I。 18.(11分)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的 主要能源物质。 (1)使C2与H2O(g)通过灼热的炭层,生成HC1和CO2,当有1molC2参与反应时 释放出145kJ热量,写出该反应的热化学方程式:
(4)根据盖斯定律可知:E1=E2+E3+E4。 17.(12 分)(1)已知反应 2HI(g) H2(g)+I2(g) ΔH=+11 kJ·mol-1 ,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收 436 kJ、151 kJ 的能量,则 1 mol HI(g)分子中化学键断裂时需吸收的能量为 kJ。 (2)0.1 mol Cl2 与焦炭、TiO2 完全反应,生成一种还原性气体和一种易水解成 TiO2·xH2O 的液态化合物,放热 4.28 kJ,该反应的热化学方程式 为 。 (3)Si 与 Cl 两元素的单质反应生成 1 mol Si 的最高价化合物,恢复至室温,放热 687 kJ,已知该化合物的熔点、沸点分别为-69 ℃和 58 ℃。写出该反应的热化学 方程式: 。 (4)NaBH4(s)与 H2O(l)反应生成 NaBO2(s)和 H2(g)。在 25 ℃、101 kPa 下,已知每 消耗 3.8 g NaBH4(s)放热 21.6 kJ,该反应的热化学方程式 是 。 答案:(1)299 (2)2Cl2(g)+TiO2(s)+2C(s) TiCl4(l)+2CO(g) ΔH=-85.6 kJ·mol-1 (3)Si(s)+2Cl2(g) SiCl4(l) ΔH=-687 kJ·mol-1 (4)NaBH4(s)+2H2O(l) NaBO2(s)+4H2(g)ΔH=-216.0 kJ·mol-1 解析:(1)设 1 mol HI(g)分子中化学键断裂吸收的能量为 x,则 2x-436 kJ-151 kJ=11 kJ,解得 x=299 kJ。 (2)根据反应物中元素的种类,可判断还原性气体为 CO;另一种物质肯定含有 Cl、 Ti 元素,由反应物中有 TiO2、生成物的水解产物为 TiO2·xH2O 可知,Ti 的化合价 始终为+4 价,即另一种生成物的分子式为 TiCl4,由此写出该反应的化学方程 式:2Cl2+TiO2+2C 2CO+TiCl4,0.1 mol Cl2 完全反应放热 4.28 kJ,则 2 mol 氯气 完全反应可放出 85.6 kJ 热量,该反应的热化学方程式为 2Cl2(g)+TiO2(s)+2C(s) TiCl4(l)+2CO(g) ΔH=-85.6 kJ·mol-1。 (3)Si 与 Cl2 反应生成 SiCl4,SiCl4 的熔点为-69 ℃,沸点为 58 ℃,说明室温下 SiCl4 为液体,生成 1 mol 液态 SiCl4 放热 687 kJ,据此可写出反应的热化学方程式。 (4)根据题中“每消耗 3.8 g NaBH4(s)放热 21.6 kJ”可得出此反应的热化学方程式 为 NaBH4(s)+2H2O(l) NaBO2(s)+4H2(g) ΔH=-216.0 kJ·mol-1。 18.(11 分)碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活中的 主要能源物质。 (1)使 Cl2 与 H2O(g)通过灼热的炭层,生成 HCl 和 CO2,当有 1 mol Cl2 参与反应时 释放出 145 kJ 热量,写出该反应的热化学方程式:

(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与CO2反应生成甲醇。 已知H2(g)、CO(g)和CH3OH()①的燃烧热分别为285.8 kJ-mol-1、283.0 kJ-mol-1和 726.5kJmo1。则: ①利用太阳能分解10mol水消耗的能量是 kJ。 ②甲醇不完全燃烧生成CO和液态水的热化学方程式 为 答案:(1)2C2(g+2H2O(g+C(s)一4HCI(g+C02(g) △H=-290.0kJmo1 (2)①2858 ②CH3OHI+O2(g,—CO(g+2H2OI) △H=-443.5kJmo 解析:(1)根据题意写出反应的化学方程式2C2+2H2O+C一4HC1+CO2,1 mol Cl2 参加反应时释放出145kJ热量,则2 mol Cl参加反应放出145kJ×2=290kJ热量, 反应的热化学方程式为2C(g+2H2O(g+C(s)一4HCI(g+CO2(g)△H=-290.0 kJ-mol-1。 (2)①H(g十02(g)一H200△H=-285.8 kJ-mol1,所以H2O0)一H2(gH02(g) △H=+285.8 kJ-mol-1,利用太阳能分解10mol水消耗的能量=285.8kJmo1×10 mol=2 858 kJ. ②由题意可知:a.C0(g)+02(g)C02(g)△H=-283.0 kJmoI 1,b.CH3OH①+02(g,一C02(gH2HO0△H=726.5kJmo1,根据盖斯定律,由 b-a可得:CH3OH0HO2(g)一CO(g+2HO)△H=△H2-△H1=(-726.5 kJ-mol-l)( 283.0kJmo1=-443.5kJmo1。 19.(10分)如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入 几小块镁片,再滴入5L稀盐酸,回答下列问题。 稀盐酸 镁片 饱和石灰水 (1)烧杯中可观察到的现象是 (2)产生上述现象的原因是 (3)写出试管中有关反应的离子方程式:
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与 CO2 反应生成甲醇。 已知 H2(g)、CO(g)和 CH3OH(l)的燃烧热分别为 285.8 kJ·mol-1、283.0 kJ·mol-1 和 726.5 kJ·mol-1。则: ①利用太阳能分解 10 mol 水消耗的能量是 kJ。 ②甲醇不完全燃烧生成 CO 和液态水的热化学方程式 为 。 答案:(1)2Cl2(g)+2H2O(g)+C(s) 4HCl(g)+CO2(g) ΔH=-290.0 kJ·mol-1 (2)①2 858 ②CH3OH(l)+O2(g) CO(g)+2H2O(l) ΔH=-443.5 kJ·mol-1 解析:(1)根据题意写出反应的化学方程式 2Cl2+2H2O+C 4HCl+CO2,1 molCl2 参加反应时释放出 145 kJ 热量,则 2 mol Cl2 参加反应放出 145 kJ×2=290 kJ 热量, 反应的热化学方程式为 2Cl2(g)+2H2O(g)+C(s) 4HCl(g)+CO2(g) ΔH=-290.0 kJ·mol-1。 (2)①H2(g)+1 2 O2(g) H2O(l) ΔH=-285.8 kJ·mol-1 ,所以 H2O(l) H2(g)+1 2 O2(g) ΔH=+285.8 kJ·mol-1 ,利用太阳能分解 10 mol 水消耗的能量=285.8 kJ·mol-1×10 mol=2 858 kJ。 ②由题意可知:a.CO(g)+1 2 O2(g) CO2(g) ΔH1=-283.0 kJ·mol- 1 ,b.CH3OH(l)+3 2 O2(g) CO2(g)+2H2O(l) ΔH2=-726.5 kJ·mol-1 ,根据盖斯定律,由 b-a 可得:CH3OH(l)+O2(g) CO(g)+2H2O(l) ΔH=ΔH2-ΔH1=(-726.5 kJ·mol-1 )-(- 283.0 kJ·mol-1 )=-443.5 kJ·mol-1。 19.(10 分)如图所示,把试管放入盛有 25 ℃饱和石灰水的烧杯中,试管中开始放入 几小块镁片,再滴入 5 mL 稀盐酸,回答下列问题。 (1)烧杯中可观察到的现象是 。 (2)产生上述现象的原因是 。 (3)写出试管中有关反应的离子方程式:

(4)由实验可知,生成物MgC2和H2的总焓 (填“大于“小于”或等于) 反应物镁片和HCI的总焓。 答案(1)烧杯中溶液变浑浊 (2)镁与稀盐酸的反应为放热反应,Ca(OH)2在水中的溶解度随温度升高而减小,从 而析出Ca(OH)2固体 (3)Mg+2H+Mg2+H2↑ (4)小于 解析:镁与稀盐酸的反应是放热反应,释放的能量传递给环境中的饱和石灰水,导 致饱和石灰水的温度升高。而C(OH)2在水中的溶解度随温度升高而减小,因此 饱和石灰水中有Ca(OH)2固体析出,溶液变浑浊。放热反应的实质是反应物的总 焓大于生成物的总焓。 20.(14分)某实验小组用0.50 mol-L-!NaOH溶液和0.50molL1硫酸进行中和反 应反应热的测定。 I.配制0.50molL1NaOH溶液。 (1)若实验中大约要使用245 mLNaOH溶液,至少需要称量NaOH固体 g。 (2)从表中选择,称量NaOH固体所需要的仪器是 (填序号) 托盘天平 名称 小烧杯 坩埚钳 玻璃棒药匙 量筒 带砝码) 仪器 序号回 ② ③ ④ ⑤ ⑥ Ⅱ.测定稀硫酸与稀氢氧化钠溶液中和反应反应热的实验装置如图所示。 温度计 玻璃 搅拌器 内筒 杯盖 隔热层 外壳 (1)若生成1olH20时反应放出的热量为57.3kJ,写出该反应的热化学方程 式 (2)取50 mL NaOH溶液和30mL硫酸进行实验,实验数据如下表。 ①请填写下表中的空白: 起始温度h/℃ 终止 温度差平均值
(4)由实验可知,生成物 MgCl2 和 H2 的总焓 (填“大于”“小于”或“等于”) 反应物镁片和 HCl 的总焓。 答案:(1)烧杯中溶液变浑浊 (2)镁与稀盐酸的反应为放热反应,Ca(OH)2 在水中的溶解度随温度升高而减小,从 而析出 Ca(OH)2 固体 (3)Mg+2H+ Mg2++H2↑ (4)小于 解析:镁与稀盐酸的反应是放热反应,释放的能量传递给环境中的饱和石灰水,导 致饱和石灰水的温度升高。而 Ca(OH)2 在水中的溶解度随温度升高而减小,因此 饱和石灰水中有 Ca(OH)2 固体析出,溶液变浑浊。放热反应的实质是反应物的总 焓大于生成物的总焓。 20.(14 分)某实验小组用 0.50 mol·L -1 NaOH 溶液和 0.50 mol·L -1 硫酸进行中和反 应反应热的测定。 Ⅰ.配制 0.50 mol·L -1 NaOH 溶液。 (1)若实验中大约要使用 245 mL NaOH 溶液,至少需要称量 NaOH 固体 g。 (2)从表中选择,称量 NaOH 固体所需要的仪器是 (填序号)。 名称 托盘天平 (带砝码) 小烧杯 坩埚钳 玻璃棒药匙 量筒 仪器 序号 ① ② ③ ④ ⑤ ⑥ Ⅱ.测定稀硫酸与稀氢氧化钠溶液中和反应反应热的实验装置如图所示。 (1)若生成 1 mol H2O 时反应放出的热量为 57.3 kJ,写出该反应的热化学方程 式: 。 (2)取 50 mL NaOH 溶液和 30 mL 硫酸进行实验,实验数据如下表。 ①请填写下表中的空白: 起始温度 t1/℃ 终止 温度差平均值
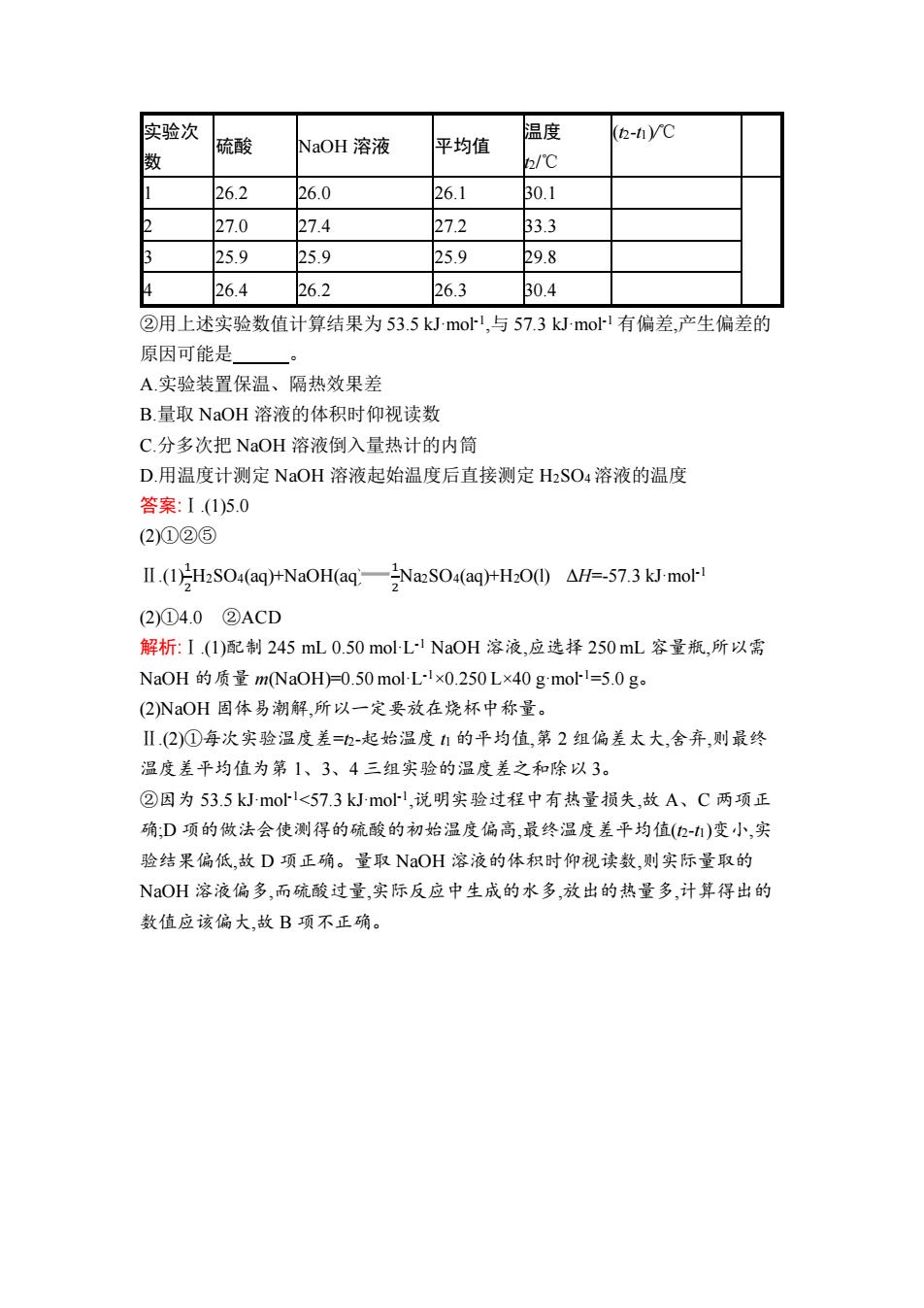
实验次 温度 平均值 (2-i)V℃ 硫酸 NaOH溶液 2/℃ 26.2 26.0 26.1 30.1 27.0 27.4 27.2 33.3 25.9 25.9 25.9 29.8 26.4 26.2 26.3 B0.4 ②用上述实验数值计算结果为53.5 kJmol,与57.3kJmo1有偏差,产生偏差的 原因可能是 A.实验装置保温、隔热效果差 B.量取NaOH溶液的体积时仰视读数 C.分多次把NaOH溶液倒入量热计的内筒 D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 答案:1.(1)5.0 (2)①②⑤ IⅡ.(1Hs04(aq)+NaOH(aq一2Nas04aq)HH200△H=-57.3 kJ-mol-1 (2)①4.0②ACD 解析:I.(1)配制245mL0.50molL1NaOH溶液,应选择250mL容量瓶,所以需 NaOH的质量m(NaOH=0.50 mol-L-!×0.250L×40gmol=5.0g。 (2)NaOH固体易潮解,所以一定要放在烧杯中称量。 Ⅱ.(2)①每次实验温度差=2-起始温度1的平均值,第2组偏差太大,舍弃,则最终 温度差平均值为第1、3、4三组实验的温度差之和除以3。 ②因为53.5 kJ-mol-1<57.3 kJ-mol-1,说明实验过程中有热量损失,故A、C两项正 确:D项的做法会使测得的硫酸的初始温度偏高,最终温度差平均值(2-)变小,实 验结果偏低,故D项正确。量取NaOH溶液的体积时仰视读数,则实际量取的 NaOH溶液偏多,而硫酸过量,实际反应中生成的水多,放出的热量多,计算得出的 数值应该偏大,故B项不正确
实验次 数 硫酸 NaOH 溶液 平均值 温度 t2/℃ (t2-t1)/℃ 1 26.2 26.0 26.1 30.1 2 27.0 27.4 27.2 33.3 3 25.9 25.9 25.9 29.8 4 26.4 26.2 26.3 30.4 ②用上述实验数值计算结果为 53.5 kJ·mol-1 ,与 57.3 kJ·mol-1 有偏差,产生偏差的 原因可能是 。 A.实验装置保温、隔热效果差 B.量取 NaOH 溶液的体积时仰视读数 C.分多次把 NaOH 溶液倒入量热计的内筒 D.用温度计测定 NaOH 溶液起始温度后直接测定 H2SO4溶液的温度 答案:Ⅰ.(1)5.0 (2)①②⑤ Ⅱ.(1)1 2 H2SO4(aq)+NaOH(aq) 1 2 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1 (2)①4.0 ②ACD 解析:Ⅰ.(1)配制 245 mL 0.50 mol·L -1 NaOH 溶液,应选择 250 mL 容量瓶,所以需 NaOH 的质量 m(NaOH)=0.50 mol·L -1×0.250 L×40 g·mol-1=5.0 g。 (2)NaOH 固体易潮解,所以一定要放在烧杯中称量。 Ⅱ.(2)①每次实验温度差=t2-起始温度 t1 的平均值,第 2 组偏差太大,舍弃,则最终 温度差平均值为第 1、3、4 三组实验的温度差之和除以 3。 ②因为 53.5 kJ·mol-1<57.3 kJ·mol-1 ,说明实验过程中有热量损失,故 A、C 两项正 确;D 项的做法会使测得的硫酸的初始温度偏高,最终温度差平均值(t2-t1)变小,实 验结果偏低,故 D 项正确。量取 NaOH 溶液的体积时仰视读数,则实际量取的 NaOH 溶液偏多,而硫酸过量,实际反应中生成的水多,放出的热量多,计算得出的 数值应该偏大,故 B 项不正确