
第一章化学反应的热效应 第一节反应热 第1课时反应热焓变 课后·训练提升 基础巩固 1.下列对化学反应的认识错误的是( A.会引起化学键的变化 B.会产生新的物质 C.必然引起物质状态的变化 D.必然伴随着能量变化 答案:C 解析:化学变化的本质是化学键的断裂和形成,化学变化中会产生新的物质并伴随 能量变化,但物质状态不一定发生变化,如H(g十C2(g)2HCI(g),反应物和生成 物均为气体。 2.下列反应中,属于氧化还原反应同时又是吸热反应的是()。 A.Ba(OH)28H2O与NH4C反应 B.铝与稀盐酸反应 C灼热的炭与水蒸气生成一氧化碳和氢气的反应 D.煤与O2的燃烧反应 答案C 解析:A为非氧化还原反应,B、C、D为氧化还原反应,其中C为吸热反应,B和D 为放热反应。 3.化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程, 示意图如下: 。c8a ② zMdkwn 9元990989方8 99%088恩。 里 dia nnnnn 下列关于合成氨反应的叙述中不正确的是( )。 A.该过程表明,在化学反应中存在化学键的断裂与形成 B.在催化剂的作用下,反应物的化学键变得容易断裂 C.过程②需吸收能量,过程③则放出能量 D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成
第一章 化学反应的热效应 第一节 反应热 第 1 课时 反应热 焓变 课后· 基础巩固 1.下列对化学反应的认识错误的是( )。 A.会引起化学键的变化 B.会产生新的物质 C.必然引起物质状态的变化 D.必然伴随着能量变化 答案:C 解析:化学变化的本质是化学键的断裂和形成,化学变化中会产生新的物质并伴随 能量变化,但物质状态不一定发生变化,如 H2(g)+Cl2(g) 2HCl(g),反应物和生成 物均为气体。 2.下列反应中,属于氧化还原反应同时又是吸热反应的是( )。 A.Ba(OH)2·8H2O 与 NH4Cl 反应 B.铝与稀盐酸反应 C.灼热的炭与水蒸气生成一氧化碳和氢气的反应 D.煤与 O2 的燃烧反应 答案:C 解析:A 为非氧化还原反应,B、C、D 为氧化还原反应,其中 C 为吸热反应,B 和 D 为放热反应。 3.化学家格哈德·埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程, 示意图如下: 下列关于合成氨反应的叙述中不正确的是( )。 A.该过程表明,在化学反应中存在化学键的断裂与形成 B.在催化剂的作用下,反应物的化学键变得容易断裂 C.过程②需吸收能量,过程③则放出能量 D.常温下该反应难以进行,是因为常温下生成物的化学键难以形成

答案D 解析:由图中可知,每3个氢气分子和1个氨气分子断键得到原子,然后生成2个 氨气分子,A项正确:催化剂能改变化学反应的速率,合成氨的反应在催化剂作用 下,反应速率增大,意味着反应物化学键的断裂和生成物化学键的形成变得更容 易,B项正确:化学键的断裂需要吸收能量,而化学键的形成则放出能量,从图中可 看出②为化学键断裂过程,③为新的化学键形成过程,C项正确:化学键的断裂需 要吸收能量,所以该反应在常温下难以进行,D项错误。 4.下列说法中不正确的是()。 A.化学变化过程是原子的重新组合过程 B.根据化学反应中的能量变化情况,化学反应可分为吸热反应和放热反应 C.化学反应中的能量变化多少与其反应物用量有关 D.化学反应中的能量变化都是以热能形式表现出来的 答案D 解析:化学反应中的能量变化通常以热能形式表现出来,有的以光能、电能等形式 表现出来,D项不正确。 5.下列说法中正确的是( A.焓变的单位是kJmol-1,是指1mol物质参加反应时的能量变化 B.反应吸热时△H0,B项错误;反应中物质所具有的总能量减少,反应就放 出热量,反之就吸收热量,C项正确:化学反应的实质是化学键的断裂和形成,断键 时吸收能量,成键时释放能量,所以D项错误。 6.在氢气与氧气的反应中,1molH2(g)中的化学键断裂时需要吸收akJ的能量,1 molO2(g)中的化学键断裂时需要吸收bkJ的能量,1molH2O(g)中的化学键形成 时要释放ckJ的能量。根据上述反应中的能量变化可推出的是()。 A.a+b>c B.a+b<c C.2a+b<2c D.2a+b=2c 答案C 解析:氢气与氧气反应的化学方程式为2H2+0色燃2H20,该反应为放热反 应,△H=(2a+b-2c)kJmol1<0,所以2a+b<2c,C项正确
答案:D 解析:由图中可知,每 3 个氢气分子和 1 个氮气分子断键得到原子,然后生成 2 个 氨气分子,A 项正确;催化剂能改变化学反应的速率,合成氨的反应在催化剂作用 下,反应速率增大,意味着反应物化学键的断裂和生成物化学键的形成变得更容 易,B 项正确;化学键的断裂需要吸收能量,而化学键的形成则放出能量,从图中可 看出②为化学键断裂过程,③为新的化学键形成过程,C 项正确;化学键的断裂需 要吸收能量,所以该反应在常温下难以进行,D 项错误。 4.下列说法中不正确的是( )。 A.化学变化过程是原子的重新组合过程 B.根据化学反应中的能量变化情况,化学反应可分为吸热反应和放热反应 C.化学反应中的能量变化多少与其反应物用量有关 D.化学反应中的能量变化都是以热能形式表现出来的 答案:D 解析:化学反应中的能量变化通常以热能形式表现出来,有的以光能、电能等形式 表现出来,D 项不正确。 5.下列说法中正确的是( )。 A.焓变的单位是 kJ·mol-1 ,是指 1 mol 物质参加反应时的能量变化 B.反应吸热时 ΔH0,B 项错误;反应中物质所具有的总能量减少,反应就放 出热量,反之就吸收热量,C 项正确;化学反应的实质是化学键的断裂和形成,断键 时吸收能量,成键时释放能量,所以 D 项错误。 6.在氢气与氧气的反应中,1 mol H2(g)中的化学键断裂时需要吸收 a kJ 的能量,1 mol O2(g)中的化学键断裂时需要吸收 b kJ 的能量,1 mol H2O(g)中的化学键形成 时要释放 c kJ 的能量。根据上述反应中的能量变化可推出的是( )。 A.a+b>c B.a+b<c C.2a+b<2c D.2a+b=2c 答案:C 解析:氢气与氧气反应的化学方程式为 2H2+O2 2H2O,该反应为放热反 应,ΔH=(2a+b-2c) kJ·mol-1<0,所以 2a+b<2c,C 项正确

7.已知化学反应2C(6+02g)点尴2C0(g),2C0(g+0g)点槛2C02(g)都是放热反应, 据此判断下列说法中正确的是(其他条件与反应式相同)()。 A.28gC0所具有的能量一定高于44gCO2所具有的能量 B.56gC0和32gO2所具有的总能量高于88gCO2所具有的总能量 C.32gO2所具有的总能量高于44gC02所具有的总能量 D.将一定质量的C燃烧,生成CO2与生成CO时放出的热量一样多 答案B 解析:放热反应是反应物的总能量高于生成物的总能量。 8.对于放热反应H2+C2HCL,下列说法中正确的是( A.该反应涉及离子键和共价键的断裂与形成 B.该反应中,化学能只转变为热能 C.断开1molH一H和1molC1C1所吸收的总能量小于形成1 mol H-CI所放 出的能量 D.反应物所具有的总能量高于生成物所具有的总能量 答案D 解析:A项,H2与C2含有的化学键为共价键,该反应只涉及共价键的断裂与形成, 错误B项,该反应的化学能可以转化为热能,也可以转化为光能、电能等其他形 式的能量,错误:C项,该反应为放热反应,所以断开1olH一H和1 mol CI-CI所 吸收的总能量小于形成2 ol H-CI所放出的能量,错误;D项,因为反应为放热反 应,所以反应物所具有的总能量高于生成物所具有的总能量,正确。 9科学家己获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与 白磷分子相似。已知断裂1molN一N吸收193kJ热量,断裂1molN≡N吸收 941kJ热量,则( A.N4的熔点比P4高 B.1molN4气体转化为N2时要吸收724kJ能量 C.N4是N2的同系物 D.1molN4气体转化为N2时要放出724kJ能量 答案D 解析N4与白磷P4)结构相似,由于N4相对分子质量小于P4,故其分子间作用力弱 于P4,其熔,点低于P4,A项错误N4与N2互为同素异形体,而不是同系物,C项错误;
7.已知化学反应 2C(s)+O2(g) 2CO(g),2CO(g)+O2(g) 2CO2(g)都是放热反应, 据此判断下列说法中正确的是(其他条件与反应式相同)( )。 A.28 g CO 所具有的能量一定高于 44 g CO2 所具有的能量 B.56 g CO 和 32 g O2 所具有的总能量高于 88 g CO2 所具有的总能量 C.32 g O2 所具有的总能量高于 44 g CO2 所具有的总能量 D.将一定质量的 C 燃烧,生成 CO2 与生成 CO 时放出的热量一样多 答案:B 解析:放热反应是反应物的总能量高于生成物的总能量。 8.对于放热反应 H2+Cl2 2HCl,下列说法中正确的是( )。 A.该反应涉及离子键和共价键的断裂与形成 B.该反应中,化学能只转变为热能 C.断开 1 mol H—H 和 1 mol Cl—Cl 所吸收的总能量小于形成 1 mol H—Cl 所放 出的能量 D.反应物所具有的总能量高于生成物所具有的总能量 答案:D 解析:A 项,H2 与 Cl2 含有的化学键为共价键,该反应只涉及共价键的断裂与形成, 错误;B 项,该反应的化学能可以转化为热能,也可以转化为光能、电能等其他形 式的能量,错误;C 项,该反应为放热反应,所以断开 1 mol H—H 和 1 mol Cl—Cl 所 吸收的总能量小于形成 2 mol H—Cl 所放出的能量,错误;D 项,因为反应为放热反 应,所以反应物所具有的总能量高于生成物所具有的总能量,正确。 9.科学家已获得了极具理论研究意义的 N4 分子,其结构为正四面体(如图所示),与 白磷分子相似。已知断裂 1 mol N—N 吸收 193 kJ 热量,断裂 1 mol N≡N 吸收 941 kJ 热量,则( )。 A.N4 的熔点比 P4 高 B.1 mol N4 气体转化为 N2 时要吸收 724 kJ 能量 C.N4 是 N2 的同系物 D.1 mol N4 气体转化为 N2 时要放出 724 kJ 能量 答案:D 解析:N4 与白磷(P4)结构相似,由于 N4 相对分子质量小于 P4,故其分子间作用力弱 于 P4,其熔点低于 P4,A 项错误;N4 与 N2互为同素异形体,而不是同系物,C 项错误;

从结构图中可看出,1个N4分子中含有6个N一N,根据N4(g,一2N2(g),有 △H=6×193 kJ-mol-1-2×941 kJ-mol-1=-724 kJmol-1,故B项错误,D项正确。 10.下表中的数据是破坏1ol物质中的化学键所消耗的能量(k): 物质 Br2 HCI HBr HI H2 能量 243 193 151 432 366 298 436 k 根据上述数据回答下列问题。 (1)下列物质本身具有的能量最低的是 A.H2 B.Cl2 C.Br2 D.I2 (2)下列氢化物中,最稳定的是 A.HCI B.HBr C.HI (3)X2+H一2HX(X代表C1、Br、I)的反应是 (填吸热”或“放热”)反 应。 (4)相同条件下,X2(X代表C1、Br、I)分别与氢气反应,若消耗等物质的量的氢气 时,放出或吸收热量最多的是 (⑤)若无上表中的数据,你能正确回答出问题(4)吗?. 你的根据 是 答案:(1)A (2)A (3)放热 (4)C2 (⑤)能Ch非金属性最强,与氢气反应最容易,生成物最稳定,放出的热量最多 解析:键能越大,分子越稳定,物质所具有的能量越低。 11.用50mL0.50molL1盐酸与50mL0.55molL1NaOH溶液在如图所示的装 置中进行中和反应。通过测定反应过程中所放出的热量可计算该中和反应的反 应热。 温度计 玻璃 搅拌器 内筒 杯盖 隔热层 外壳 回答下列问题
从结构图中可看出,1 个 N4 分子中含有 6 个 N—N,根据 N4(g) 2N2(g),有 ΔH=6×193 kJ·mol-1 -2×941 kJ·mol-1=-724 kJ·mol-1 ,故 B 项错误,D 项正确。 10.下表中的数据是破坏 1 mol 物质中的化学键所消耗的能量(kJ): 物质 Cl2 Br2 I2 HCl HBr HI H2 能量 kJ 243 193 151 432 366 298 436 根据上述数据回答下列问题。 (1)下列物质本身具有的能量最低的是 。 A.H2 B.Cl2 C.Br2 D.I2 (2)下列氢化物中,最稳定的是 。 A.HCl B.HBr C.HI (3)X2+H2 2HX(X 代表 Cl、Br、I)的反应是 (填“吸热”或“放热”)反 应。 (4)相同条件下,X2(X 代表 Cl、Br、I)分别与氢气反应,若消耗等物质的量的氢气 时,放出或吸收热量最多的是 。 (5)若无上表中的数据,你能正确回答出问题(4)吗? 。你的根据 是 。 答案:(1)A (2)A (3)放热 (4)Cl2 (5)能 Cl2 非金属性最强,与氢气反应最容易,生成物最稳定,放出的热量最多 解析:键能越大,分子越稳定,物质所具有的能量越低。 11.用 50 mL 0.50 mol·L -1 盐酸与 50 mL 0.55 mol·L -1 NaOH 溶液在如图所示的装 置中进行中和反应。通过测定反应过程中所放出的热量可计算该中和反应的反 应热。 回答下列问题

(1)装置中杯盖缺失,求得的反应热△H (填“偏大“偏小”或“无影 响”)。 (2)如果用60mL0.50molL1盐酸与50mL0.55molL1NaOH溶液进行反应,与 上述实验相比,所放出的热量(填“相等”或“不相等),所求反应热 (填“相等”或“不相等)。 (3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的反应热△H (填偏大偏小”或“无影响)。 答案:(1)偏大(2)不相等相等(3)偏大 解析:(I)杯盖缺失,热量损失,根据温度变化求得反应放出的热量偏少,△H偏大。 (2)酸与碱的用量不同,反应放出的热量不相等,但求得的反应热相等。(3)由于 NH3H2O电离时吸热,所以测得反应放出的热量偏少,△H偏大。 拓展提高 1H与O2发生反应的过程用模型表示如下(一”表示化学键) 。。 。 下列说法不正确的是( A过程I是吸热过程 B.过程一定是放热过程 C.该反应过程所有反应物分子化学键都断裂,且形成了生成物分子化学键 D.该反应的能量转化只能以热能的形式进行 答案D 解析:过程I分子中的化学键断裂,形成原子,属于吸热过程,A项正确;过程Ⅲ为化 学键形成的过程,属于放热过程,B项正确:过程I中所有的反应物分子化学键都 断裂,过程Ⅲ为生成物分子化学键形成的过程C项正确:该反应可通过燃料电池 实现化学能到电能的转化,D项错误。 2.己知强酸的稀溶液与强碱的稀溶液反应生成1molH2O时的反应热△H=-57.3 kJ-mol-I。下列说法中错误的是(). A.将含1 mol NaOH的稀溶液与50g98%的疏酸混合后放出的热量为57.3kJ B.将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量 小于57.3k C.用0.50molL1盐酸和氢氧化钠固体进行实验,测出生成1molH2O时的反应的 热值偏大 D.用稀硫酸和稀硝酸分别与Ba(OH)2稀溶液进行反应测定生成1molH2O时的 反应热,其数值不同
(1)装置中杯盖缺失,求得的反应热 ΔH (填“偏大”“偏小”或“无影 响”)。 (2)如果用 60 mL 0.50 mol·L -1 盐酸与 50 mL 0.55 mol·L -1 NaOH 溶液进行反应,与 上述实验相比,所放出的热量 (填“相等”或“不相等”),所求反应热 (填“相等”或“不相等”)。 (3)用相同浓度和体积的氨水代替 NaOH 溶液进行上述实验,测得的反应热 ΔH (填“偏大”“偏小”或“无影响”)。 答案:(1)偏大 (2)不相等 相等 (3)偏大 解析:(1)杯盖缺失,热量损失,根据温度变化求得反应放出的热量偏少,ΔH 偏大。 (2)酸与碱的用量不同,反应放出的热量不相等,但求得的反应热相等。(3)由于 NH3·H2O 电离时吸热,所以测得反应放出的热量偏少,ΔH 偏大。 拓展提高 1.H2 与 O2 发生反应的过程用模型表示如下(“—”表示化学键): 下列说法不正确的是 ( )。 A.过程Ⅰ是吸热过程 B.过程Ⅲ一定是放热过程 C.该反应过程所有反应物分子化学键都断裂,且形成了生成物分子化学键 D.该反应的能量转化只能以热能的形式进行 答案:D 解析:过程Ⅰ分子中的化学键断裂,形成原子,属于吸热过程,A 项正确;过程Ⅲ为化 学键形成的过程,属于放热过程,B 项正确;过程Ⅰ中所有的反应物分子化学键都 断裂,过程Ⅲ为生成物分子化学键形成的过程,C 项正确;该反应可通过燃料电池 实现化学能到电能的转化,D 项错误。 2.已知强酸的稀溶液与强碱的稀溶液反应生成 1 mol H2O 时的反应热 ΔH=-57.3 kJ·mol-1。下列说法中错误的是( )。 A.将含 1 mol NaOH 的稀溶液与 50 g 98%的硫酸混合后放出的热量为 57.3 kJ B.将含 1 mol NaOH 的稀溶液与含 1 mol CH3COOH 的稀溶液混合后放出的热量 小于 57.3 kJ C.用 0.50 mol·L -1 盐酸和氢氧化钠固体进行实验,测出生成 1 mol H2O 时的反应的 热值偏大 D.用稀硫酸和稀硝酸分别与 Ba(OH)2 稀溶液进行反应测定生成 1 mol H2O 时的 反应热,其数值不同

答案:A 解析:选项A中98%的硫酸属于浓硫酸,与水混合时放出热量,使放出的热量增 多,A项错误;选项B中CH3COOH是弱酸,电离时吸热,使反应中放出的热量减 少,B项正确:选项C中氢氧化钠固体溶于水放热,使放出的热量增多,C项正确:D 项中H2SO4与Ba(OH)2反应还生成BaSO4沉淀,放出的热量增多,D项正确。 3.下列关于化学反应的说法中正确的是( )。 A.有化学键断裂的过程一定发生了化学变化 B.化学反应中有物质变化也有能量变化 C.如图所示的反应为放热反应 焙H)1 生成物 反应物 D.需要加热才能发生的化学反应一定是吸热反应 答案B 解析:NCI溶于水时离子键断裂,但该过程只发生了物理变化,A错误;由题图可知 生成物的总能量大于反应物的总能量,故该反应为吸热反应,C项错误;有些放热 反应也需要加热,如Fe与S的反应,D项错误。 4.己知1molH2(g)中的化学键断裂时需要吸收436kJ的能量,1 mol NH3(g)中的 化学键形成时要释放1173k的能量。1molN2(g)与3molH(g)完全反应生成2 mol NH3(g)时,放出92.4kJ的热量。则1molN2(g)中的化学键断裂时需要吸收的 能量是()。 A.431.2kJ B.945.6kJ C.648.9kJ D.869.6kJ 答案B 高温、高压 解析:根据化学方程式N2+3H2催化剂2NH3,设1olN2(g)中的化学键断裂时需 要吸收的能量为x,有x+3×436kJ-2×1173kJ=-92.4kJ,x=945.6kJ。 5.己知:在25℃和101kPa下,反应H2(g十F2(g)一2HF(g)的△H=-270 kJ-mol-,下 列说法正确的是()。 A.在相同条件下,1molH2(g)与1molF2(g)的总焓大于2 mol HF(g)的总焓 B.1molH2(g)与1molF2(g)反应生成2 mol HF①,放出的热量小于270kJ C.该反应的逆反应是放热反应 D.该反应过程中焓的变化可用下图来表示
答案:A 解析:选项 A 中 98%的硫酸属于浓硫酸,与水混合时放出热量,使放出的热量增 多,A 项错误;选项 B 中 CH3COOH 是弱酸,电离时吸热,使反应中放出的热量减 少,B 项正确;选项 C 中氢氧化钠固体溶于水放热,使放出的热量增多,C 项正确;D 项中 H2SO4 与 Ba(OH)2反应还生成 BaSO4沉淀,放出的热量增多,D 项正确。 3.下列关于化学反应的说法中正确的是( )。 A.有化学键断裂的过程一定发生了化学变化 B.化学反应中有物质变化也有能量变化 C.如图所示的反应为放热反应 D.需要加热才能发生的化学反应一定是吸热反应 答案:B 解析:NaCl 溶于水时离子键断裂,但该过程只发生了物理变化,A 错误;由题图可知 生成物的总能量大于反应物的总能量,故该反应为吸热反应,C 项错误;有些放热 反应也需要加热,如 Fe 与 S 的反应,D 项错误。 4.已知 1 mol H2(g)中的化学键断裂时需要吸收 436 kJ 的能量,1 mol NH3(g)中的 化学键形成时要释放 1 173 kJ 的能量。1 mol N2(g)与 3 mol H2(g)完全反应生成 2 mol NH3(g)时,放出 92.4 kJ 的热量。则 1 mol N2(g)中的化学键断裂时需要吸收的 能量是( )。 A.431.2 kJ B.945.6 kJ C.648.9 kJ D.869.6 kJ 答案:B 解析:根据化学方程式 N2+3H2 2NH3,设 1 mol N2(g)中的化学键断裂时需 要吸收的能量为 x,有 x+3×436 kJ-2×1 173 kJ=-92.4 kJ,x=945.6 kJ。 5.已知:在 25 ℃和 101 kPa 下,反应 H2(g)+F2(g) 2HF(g)的 ΔH=-270 kJ·mol-1 ,下 列说法正确的是( )。 A.在相同条件下,1 mol H2(g)与 1 mol F2(g)的总焓大于 2 mol HF(g)的总焓 B.1 mol H2(g)与 1 mol F2(g)反应生成 2 mol HF(l),放出的热量小于 270 kJ C.该反应的逆反应是放热反应 D.该反应过程中焓的变化可用下图来表示
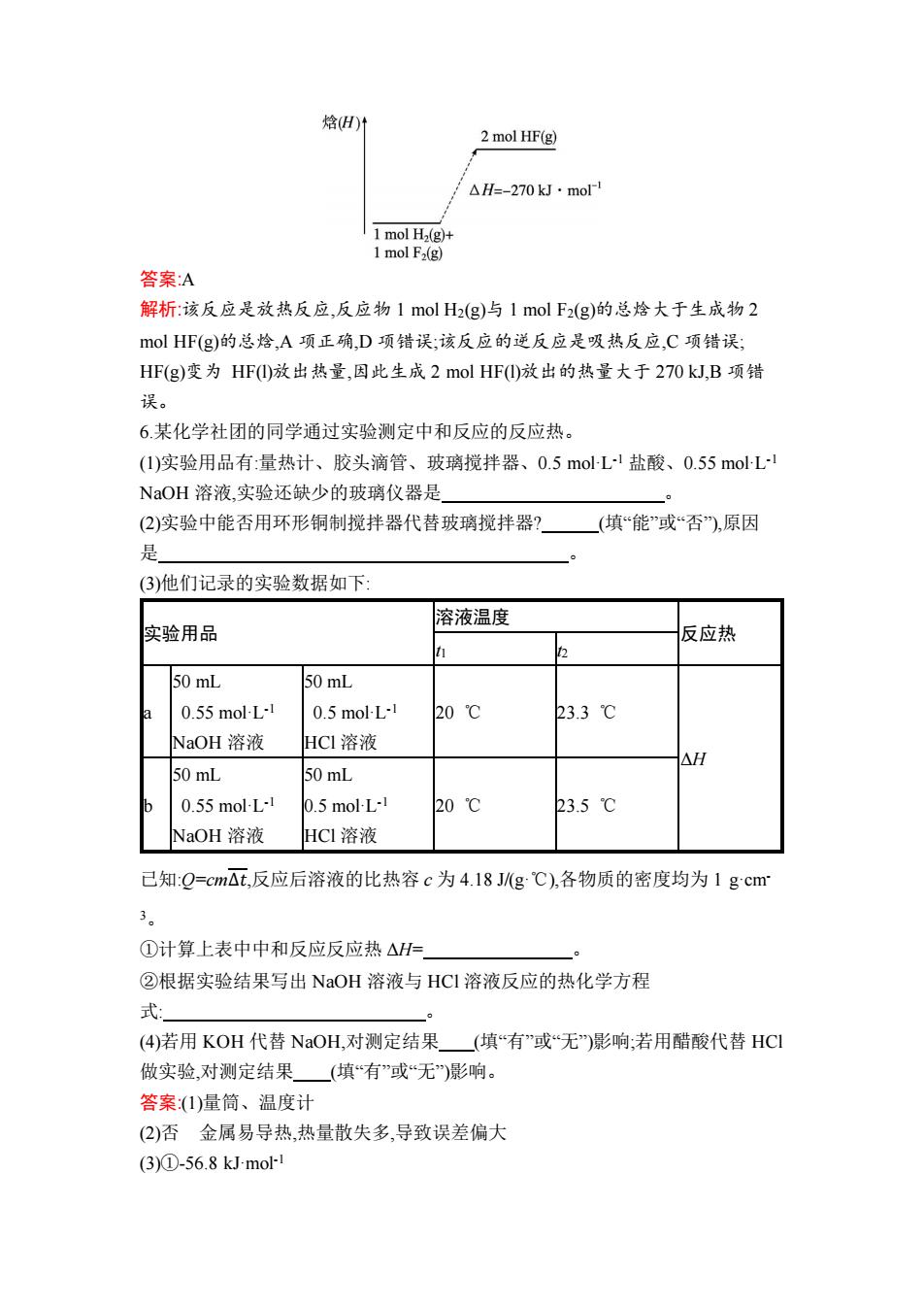
焓H)1 2 mol HF(g) △H=-270kJ·mol 1 mol H2(g)+ 1 mol F2(g) 答案:A 解析:该反应是放热反应,反应物1molH2(g)与1molF2(g)的总焓大于生成物2 olHF(g)的总焓,A项正确,D项错误;该反应的逆反应是吸热反应,C项错误; HF(g)变为HF)放出热量,因此生成2 mol HF①放出的热量大于270kJ,B项错 误。 6某化学社团的同学通过实验测定中和反应的反应热。 (1)实验用品有:量热计、胶头滴管、玻璃搅拌器、0.5molL盐酸、0.55moL1 NaOH溶液,实验还缺少的玻璃仪器是 ò (2)实验中能否用环形铜制搅拌器代替玻璃搅拌器? (填“能”或否),原因 是 (3)他们记录的实验数据如下: 溶液温度 实验用品 反应热 50 mL 50 mL 0.55 mol-L-1 0.5 mol-L-1 20℃ 23.3℃ NaOH溶液 HC1溶液 △H 50 mL 50 mL 0.55 mol-L-1 0.5 mol-L-1 20℃ 23.5℃ NaOH溶液 HCI溶液 已知:Q=cm△t,反应后溶液的比热容c为4.18Jg℃),各物质的密度均为1gcm 3。 ①计算上表中中和反应反应热△H= ②根据实验结果写出NaOH溶液与HCI溶液反应的热化学方程 式 (4)若用KOH代替NaOH,对测定结果 (填“有”或无)影响;若用醋酸代替HCI 做实验,对测定结果(填“有”或“无)影响。 答案(1)量筒、温度计 (2)否金属易导热,热量散失多,导致误差偏大 (3)①-56.8 kJmol-1
答案:A 解析:该反应是放热反应,反应物 1 mol H2(g)与 1 mol F2(g)的总焓大于生成物 2 mol HF(g)的总焓,A 项正确,D 项错误;该反应的逆反应是吸热反应,C 项错误; HF(g)变为 HF(l)放出热量,因此生成 2 mol HF(l)放出的热量大于 270 kJ,B 项错 误。 6.某化学社团的同学通过实验测定中和反应的反应热。 (1)实验用品有:量热计、胶头滴管、玻璃搅拌器、0.5 mol·L -1 盐酸、0.55 mol·L -1 NaOH 溶液,实验还缺少的玻璃仪器是 。 (2)实验中能否用环形铜制搅拌器代替玻璃搅拌器? (填“能”或“否”),原因 是 。 (3)他们记录的实验数据如下: 实验用品 溶液温度 反应热 t1 t2 a 50 mL 0.55 mol·L -1 NaOH 溶液 50 mL 0.5 mol·L -1 HCl 溶液 20 ℃ 23.3 ℃ ΔH b 50 mL 0.55 mol·L -1 NaOH 溶液 50 mL 0.5 mol·L -1 HCl 溶液 20 ℃ 23.5 ℃ 已知:Q=cmΔ𝑡,反应后溶液的比热容 c 为 4.18 J/(g·℃),各物质的密度均为 1 g·cm- 3。 ①计算上表中中和反应反应热 ΔH= 。 ②根据实验结果写出 NaOH 溶液与 HCl 溶液反应的热化学方程 式: 。 (4)若用 KOH 代替 NaOH,对测定结果 (填“有”或“无”)影响;若用醋酸代替 HCl 做实验,对测定结果 (填“有”或“无”)影响。 答案:(1)量筒、温度计 (2)否 金属易导热,热量散失多,导致误差偏大 (3)①-56.8 kJ·mol-1

②NaOH(aq)+HCI(aq)NaCl(aq)+H2O④△H=-56.&kJ.mol! (4)无有 解析(1)中和反应反应热测定的关键是减少实验过程中的热量损失,需要的仪器 除题目中的仪器外,还要用量筒量取液体体积,用温度计测量液体的温度。 (2)不可以,铜丝易导热,会增大热量散失。 (3)①由题意知:a中2-1=23.3℃-20℃=3.3℃。 b中2-1=23.5℃-20℃=3.5℃ 故△E=33℃+3.5℃=3.4℃。 2 由Q=cm△t4.18J/g℃)×100g×3.4℃≈1.42kJ, 则△=.。142-56.8 kJ-mo1。 0.025mol0.025mol ②NaOH(aq)+HCI((aq)NaCl(aq)+H2O④△H=-56.8 kJ.mol-1。 (4)KOH、NaOH都是强碱,对结果无影响。而用CH3COOH代替HCL,由于 CH3COOH为弱酸,电离需吸热,故对测定结果有影响。 挑战创新 (1)己知单质硫在通常条件下以Ss(斜方硫)的形式存在,而在蒸气状态时,含有 S2、S4、S6及Sg等多种同素异形体,其中S4、S6和S8具有相似的结构特点,其结 构如图所示: 若已知硫氧键的键能为d kJ-mol-l,氧氧键的键能为e kJ-molI,S(s+O2(g) SO2(g)的△H=-a kJ-mol-!,则S8分子中硫硫键的键能为 kJ-mol-1。 (2)下表是部分化学键的键能数据: 化学键 P-P 0=0 P-O 键能 198 360 498 (kJmoli) ①白磷(P4)、P4O6、P401o的分子结构如下图所示,已知P4(S+502(g,一P4O1o(S)的 △H=-2982kJmo1,则上表中x= 白磷 P406 P4010 ②0.5mol白磷P4)与O2完全反应生成固态P406,放出的热量为
②NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-56.8 kJ·mol-1 (4)无 有 解析:(1)中和反应反应热测定的关键是减少实验过程中的热量损失,需要的仪器 除题目中的仪器外,还要用量筒量取液体体积,用温度计测量液体的温度。 (2)不可以,铜丝易导热,会增大热量散失。 (3)①由题意知:a 中 t2-t1=23.3 ℃-20 ℃=3.3 ℃。 b 中 t2-t1=23.5 ℃-20 ℃=3.5 ℃ 故Δ𝑡 = 3.3 ℃+3.5 ℃ 2 =3.4 ℃。 由 Q=cmΔ𝑡=4.18 J/(g·℃)×100 g×3.4 ℃≈1.42 kJ, 则 ΔH=- 𝑄 0.025mol =- 1.42 kJ 0.025mol =-56.8 kJ·mol-1。 ②NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH=-56.8 kJ·mol-1。 (4)KOH、NaOH 都是强碱,对结果无影响。而用 CH3COOH 代替 HCl,由于 CH3COOH 为弱酸,电离需吸热,故对测定结果有影响。 挑战创新 (1)已知单质硫在通常条件下以 S8(斜方硫)的形式存在,而在蒸气状态时,含有 S2、S4、S6 及 S8等多种同素异形体,其中 S4、S6和 S8具有相似的结构特点,其结 构如图所示: 若已知硫氧键的键能为 d kJ·mol-1 ,氧氧键的键能为 e kJ·mol-1 ,S(s)+O2(g) SO2(g)的 ΔH=-a kJ·mol-1 ,则 S8 分子中硫硫键的键能为 kJ·mol-1。 (2)下表是部分化学键的键能数据: 化学键 P—P P—O O O P O 键能 (kJ·mol -1 ) 198 360 498 x ①白磷(P4)、P4O6、P4O10的分子结构如下图所示,已知 P4(s)+5O2(g) P4O10(s)的 ΔH=-2 982 kJ·mol-1 ,则上表中 x= 。 ②0.5 mol 白磷(P4)与 O2 完全反应生成固态 P4O6,放出的热量为 kJ

答案:(1)2d-a-e(2)①585②819 解析:(1)设硫硫键的键能为xkJo,则: -a kJ-mol-1=-x8xx kJ-mol-1+e kJ-mol-1-2d kJ-mol-1x=2d-a-e (2)①根据图示知,1molP4含有6molP-P,1molP4O10含12molP0和4molP 0,根据反应热等于反应物总键能与生成物总键能之差,断裂1ol共价键吸收 的能量与生成1mol该共价键放出的能量数值相等,则198 kJ-mol-1×6+498 kJ-mol1×5-360 kJ-mol1×12-4 kJmo=-2982kJmo'=585。②P4sr302g)点燃 P4O6(S),1molP406含有12molP0,反应热为△H=198 kJ-mol-1×6+498kJmo ×3-360kJmo1×12=1638kJmo1,则0.5mol白磷(P4)与02完全反应生成固态 P4O6放出的热量为1638kJmo1×0.5mol=819kJ
答案:(1)2d-a-e (2)①585 ②819 解析:(1)设硫硫键的键能为 x kJ·mol-1 ,则: -a kJ·mol-1= 1 8 ×8×x kJ·mol-1+e kJ·mol-1 -2d kJ·mol-1 ,x=2d-a-e。 (2)①根据图示知,1 mol P4 含有 6 mol P—P,1 mol P4O10 含 12 mol P—O 和 4 mol P O,根据反应热等于反应物总键能与生成物总键能之差,断裂 1 mol 共价键吸收 的能量与生成 1 mol 该共价键放出的能量数值相等,则 198 kJ·mol-1×6+498 kJ·mol-1×5-360 kJ·mol-1×12-4x kJ·mol-1=-2 982 kJ·mol-1 ,x=585。②P4(s)+3O2(g) P4O6(s),1 mol P4O6 含有 12 mol P—O,反应热为 ΔH=198 kJ·mol-1×6+498 kJ·mol-1 ×3-360 kJ·mol-1×12=-1 638 kJ·mol-1 ,则 0.5 mol 白磷(P4)与 O2 完全反应生成固态 P4O6 放出的热量为 1 638 kJ·mol-1×0.5 mol=819 kJ