
第2课时 影响盐类水解的主要因素盐 类水解的应用 课后·训练提升 基础巩固 1.氯化铵晶体溶于重水(①2O)中,溶液呈现酸性,下列叙述的原因中正确的是 ()。 A.NHt水解生成NH3H2O和HD2O B.NH4水解生成NH3DHO和HD2Ot C.NHt水解生成NH3D2O和HD2O D.NHt水解生成NH3DHO和D3O 答案D 解析NHt在重水中发生水解生成NH3DHO,同时D2O结合D+形成D3O。 2.在一定条件下,Na2S溶液中存在水解平衡:S2+H2C一HS+OH。下列说法正确 的是()。 A稀释溶液,水解平衡常数增大 B.升高温度,增大 c(S2-) C.加入NaOH固体,溶液pH减小 D.加入CuSO4固体,HS浓度增大 答案B 解析:某确定物质的水解平衡常数仅与温度有关,温度不变,则稀释时平衡常数不 变,A项错误;水解反应是吸热反应,升温促进水解,平衡正移,c(S2)减小,c(HS)增大 所以增大,B项正确:加入NaOH固体,溶液pH增大,C项错误;加入CuSO4固 c(S2-) 体,铜离子结合硫离子生成硫化铜沉淀,水解平衡逆向移动,HS浓度减小,D项错 误。 3.将下列固体物质溶于水,再将其溶液加热、蒸发结晶、再灼烧,得到化学组成与 原固体物质相同的是()。 ①胆矾②氯化铝③硫酸铝④碳酸氢钠 A.③ B.①④ C.①②③ D.①②③④ 答案:A
第 2 课时 影响盐类水解的主要因素 盐 类水解的应用 课后· 基础巩固 1.氯化铵晶体溶于重水(D2O)中,溶液呈现酸性,下列叙述的原因中正确的是 ( )。 A.NH4 +水解生成 NH3·H2O 和 HD2O+ B.NH4 +水解生成 NH3·DHO 和 HD2O+ C.NH4 +水解生成 NH3·D2O 和 HD2O+ D.NH4 +水解生成 NH3·DHO 和 D3O+ 答案:D 解析:NH4 +在重水中发生水解生成 NH3·DHO,同时 D2O 结合 D+形成 D3O+。 2.在一定条件下,Na2S 溶液中存在水解平衡:S2-+H2O HS-+OH-。下列说法正确 的是( )。 A.稀释溶液,水解平衡常数增大 B.升高温度, 𝑐(HS - ) 𝑐(S 2- ) 增大 C.加入 NaOH 固体,溶液 pH 减小 D.加入 CuSO4 固体,HS-浓度增大 答案:B 解析:某确定物质的水解平衡常数仅与温度有关,温度不变,则稀释时平衡常数不 变,A 项错误;水解反应是吸热反应,升温促进水解,平衡正移,c(S2- )减小,c(HS- )增大, 所以𝑐(HS - ) 𝑐(S 2- )增大,B 项正确;加入 NaOH 固体,溶液 pH 增大,C 项错误;加入 CuSO4 固 体,铜离子结合硫离子生成硫化铜沉淀,水解平衡逆向移动,HS-浓度减小,D 项错 误。 3.将下列固体物质溶于水,再将其溶液加热、蒸发结晶、再灼烧,得到化学组成与 原固体物质相同的是( )。 ①胆矾 ②氯化铝 ③硫酸铝 ④碳酸氢钠 A.③ B.①④ C.①②③ D.①②③④ 答案:A

解析:胆矾的组成为CuSO45H2O,溶于水得CuSO4溶液,因硫酸难挥发、蒸发结 晶、再灼烧得CuSO4;碳酸氢钠灼烧得碳酸钠:AIC3发生水解反应:AIC13+3H2O 一A(OH3+3HCL加热时HCI不断挥发,平衡右移,不断生成AI(OH)3,灼烧得 A2O3:Al2(SO4)3溶液中A13+发生水解,因硫酸难挥发,最终仍得Al2(SO4)3。 4常温下,物质的量浓度相同的下列溶液中,按pH由小到大的顺序排列的是 ()。 A.Na2CO3、NaHCO3、NaCl、NH4Cl B.Na2CO3、NaHCO3、NH4Cl、NaCl C.NH42SO4、NH4Cl、NaNO3、Na2S D.NH4Cl、NH4)2SO4、Na2S、NaNO3 答案C 解析Na2S、Na2CO3和NaHCO3水解后溶液都显碱性,pH>7,但CO水解程度比 HCO3大,故pH:NaCO3>NaHCO3NH4CI和NH42SO4水解后溶液都显酸性,则 pHNH42SO4,NaCl和NaNO3均不水 解,故pH=7,C项正确。 5.在下列给定条件的溶液中,一定能大量共存的离子组是( A.无色溶液:Ca2+、Ht、C、HS03 B.能使pH试纸呈红色的溶液Na、NH对、、NO3 C.FeCl溶液:K+、Na、S0、CO3 D常温下0.1moL的溶液Na*、K+、Si0、N0 答案D 解析H+与HSO;发生反应而不能大量共存,A项错误;使pH试纸呈红色的溶液显 酸性,在酸性条件下,NO;有强氧化性(相当于HNO3,可将I氧化,而不能大量共 存,B项错误F3+与C0?发生相互促进的水解反应而不能大量共存,C项错 误;y=0.1molL,即c(OH=0.1molL,是碱性溶液,四种离子均可大量共存,D c(H+) 项正确。 6.下列溶液中粒子浓度关系一定正确的是()。 A.pH=7的NH3HO与NH4CI的混合溶液中:c(C>cNHt) B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH)尸c(H) C.0.1molL1的硫酸铵溶液中cNH)>c(SO)>cH) D.0.1molL1的硫化钠溶液中:c(OH=cH十cHS+cH2S) 答案C 解析:根据电荷守恒,pH=7时,cH+=c(OH),则cNH=c(C),A项错误B项,若酸 为强酸则正确,若酸为弱酸则溶液显酸性,cH)>c(OH),错误,盐的水解程度比较
解析:胆矾的组成为 CuSO4·5H2O,溶于水得 CuSO4溶液,因硫酸难挥发、蒸发结 晶、再灼烧得 CuSO4;碳酸氢钠灼烧得碳酸钠;AlCl3 发生水解反应:AlCl3+3H2O Al(OH)3+3HCl,加热时 HCl 不断挥发,平衡右移,不断生成 Al(OH)3,灼烧得 Al2O3;Al2(SO4)3溶液中 Al3+发生水解,因硫酸难挥发,最终仍得 Al2(SO4)3。 4.常温下,物质的量浓度相同的下列溶液中,按 pH 由小到大的顺序排列的是 ( )。 A.Na2CO3、NaHCO3、NaCl、NH4Cl B.Na2CO3、NaHCO3、NH4Cl、NaCl C.(NH4)2SO4、NH4Cl、NaNO3、Na2S D.NH4Cl、(NH4)2SO4、Na2S、NaNO3 答案:C 解析:Na2S、Na2CO3 和 NaHCO3水解后溶液都显碱性,pH>7,但 CO3 2-水解程度比 HCO3 - 大,故 pH:Na2CO3>NaHCO3;NH4Cl 和(NH4)2SO4水解后溶液都显酸性,则 pH(NH4)2SO4,NaCl 和 NaNO3均不水 解,故 pH=7,C 项正确。 5.在下列给定条件的溶液中,一定能大量共存的离子组是( )。 A.无色溶液:Ca2+、H+、Cl-、HSO3 - B.能使 pH 试纸呈红色的溶液:Na+、NH4 +、I -、NO3 - C.FeCl3 溶液:K+、Na+、SO4 2-、CO3 2- D.常温下, 𝐾W 𝑐(H+) =0.1 mol·L -1 的溶液:Na+、K+、SiO3 2-、NO3 - 答案:D 解析:H+与 HSO3 - 发生反应而不能大量共存,A 项错误;使 pH 试纸呈红色的溶液显 酸性,在酸性条件下,NO3 - 有强氧化性(相当于 HNO3),可将 I -氧化,而不能大量共 存,B 项错误;Fe3+与 CO3 2-发生相互促进的水解反应而不能大量共存,C 项错 误; 𝐾W 𝑐(H+) =0.1 mol·L -1 ,即 c(OH- )=0.1 mol·L -1 ,是碱性溶液,四种离子均可大量共存,D 项正确。 6.下列溶液中粒子浓度关系一定正确的是( )。 A.pH=7 的 NH3·H2O 与 NH4Cl 的混合溶液中:c(Cl- )>c(NH4 + ) B.pH=2 的一元酸和 pH=12 的一元强碱等体积混合:c(OH- )=c(H+ ) C.0.1 mol·L -1 的硫酸铵溶液中:c(NH4 +)>c(SO4 2- )>c(H+ ) D.0.1 mol·L -1 的硫化钠溶液中:c(OH- )=c(H+ )+c(HS- )+c(H2S) 答案:C 解析:根据电荷守恒,pH=7 时,c(H+ )=c(OH- ),则 c(NH4 +)=c(Cl- ),A 项错误;B 项,若酸 为强酸则正确,若酸为弱酸则溶液显酸性,c(H+ )>c(OH- ),错误;盐的水解程度比较

小,故cNH>c(SO子)>c(H),C项正确:根据质子守恒 得,c(OH)=c(H)十cHS+2cH2S),D项错误。 7.已知25℃时HCN的电离常数K=6.2×1010。在物质的量浓度均为0.1molL 的HCN和NaCN的混合溶液中,经测定溶液呈碱性。则下列关系式正确的是 () A.c(CN-)>c(Na) B.c(CN-)>c(HCN) C.c(HCN)+c(CN-)=0.2 mol-L-1 D.c(CN-)+c(OH-)=0.1 mol-L-I 答案C 解析HCN的电离常数为6.2×1010,说明HCN为弱酸。溶液呈碱性,说明CN的水 解程度大于HCN的电离程度,因此cNa>c(CN),c(CN)c(HCN),A、B两项错 误;根据物料守恒,cHCN)十c(CN=0.2olLl,C项正确:根据溶液呈电中性,可知 cNac(Ht)=cCN十c(OH),因此有c(CN)tc(OH)>0.1 mol-L-I,D项错误。 8.某酸性溶液中只有Na+、CH3COO、H、OH四种离子。则下列描述正确的是 () A.该溶液由pH=3的CH3COOH溶液与pH=I1的NaOH溶液等体积混合而成 B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 C.加入适量NaOH,溶液中离子浓度为c(CH3COO)>cNa>c(OHPc(H) D.加入适量氨水,c(CH3COO)一定大于cNa)、cNH)之和 答案:A 解析:由于CH3COOH为弱酸,存在于溶液中的CH3COOH随着反应的进行继续 电离出Ht,导致溶液呈酸性,且溶液中只有Na+、CH3COO~、Ht、OH四种离子,A 项正确;等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合后,两者 恰好完全反应,由于生成的CH3 COONa水解,溶液呈碱性,B项错 误;c(CH3COO)>cNa)>c(OH>c(H)违背了电荷守恒,C项错误,加入适量氦水,溶 液可能呈中性,当溶液呈中性时,c(CH3COO尸cNa十cNH),D项错误。 9.将标准状况下的2.24LCO2通入150mL1molL1NaOH溶液中,下列说法正确 的是() A.cHC03)略大于c(C0) B.c(HC03)等于c(C0) C.cNa)等于c(C03)与c(HC03)之和 D.c(HC03)略小于c(C0) 答案:A
小,故 c(NH4 +)>c(SO4 2- )>c(H+ ),C 项正确;根据质子守恒 得,c(OH- )=c(H+ )+c(HS- )+2c(H2S),D 项错误。 7.已知 25 ℃时 HCN 的电离常数 K=6.2×10-10。在物质的量浓度均为 0.1 mol·L -1 的 HCN 和 NaCN 的混合溶液中,经测定溶液呈碱性。则下列关系式正确的是 ( )。 A.c(CN- )>c(Na+ ) B.c(CN- )>c(HCN) C.c(HCN)+c(CN- )=0.2 mol·L -1 D.c(CN- )+c(OH- )=0.1 mol·L -1 答案:C 解析:HCN 的电离常数为 6.2×10-10 ,说明 HCN 为弱酸。溶液呈碱性,说明 CN-的水 解程度大于 HCN 的电离程度,因此 c(Na+ )>c(CN- ),c(CN- )0.1 mol·L -1 ,D 项错误。 8.某酸性溶液中只有 Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是 ( )。 A.该溶液由 pH=3 的 CH3COOH 溶液与 pH=11 的 NaOH 溶液等体积混合而成 B.该溶液由等物质的量浓度、等体积的 NaOH 溶液和 CH3COOH 溶液混合而成 C.加入适量 NaOH,溶液中离子浓度为 c(CH3COO- )>c(Na+ )>c(OH- )>c(H+ ) D.加入适量氨水,c(CH3COO- )一定大于 c(Na+ )、c(NH4 +)之和 答案:A 解析:由于 CH3COOH 为弱酸,存在于溶液中的 CH3COOH 随着反应的进行继续 电离出 H+ ,导致溶液呈酸性,且溶液中只有 Na+、CH3COO-、H+、OH-四种离子,A 项正确;等物质的量浓度、等体积的 NaOH 溶液和 CH3COOH 溶液混合后,两者 恰好完全反应,由于生成的 CH3COONa 水解,溶液呈碱性,B 项错 误;c(CH3COO- )>c(Na+ )>c(OH- )>c(H+ )违背了电荷守恒,C 项错误;加入适量氨水,溶 液可能呈中性,当溶液呈中性时,c(CH3COO- )=c(Na+ )+c(NH4 +),D 项错误。 9.将标准状况下的 2.24 L CO2 通入 150 mL 1 mol·L -1 NaOH 溶液中,下列说法正确 的是( )。 A.c(HCO3 - )略大于 c(CO3 2- ) B.c(HCO3 - )等于 c(CO3 2- ) C.c(Na+ )等于 c(CO3 2- )与 c(HCO3 - )之和 D.c(HCO3 - )略小于 c(CO3 2- ) 答案:A

解析:0.1 mol CO2与0.15 mol NaOH反应生成Na2CO3和NaHCO3各0.05mol,由 于C0?水解能力比HC0;强,且C0好水解生成HC0;,因此溶液中cHC0;)略大于 c(C0好)。由物料守恒知2cNa=3[c(C0子)十c(HC0;)十cH2CO3)】。 10.(1)AgNO3的水溶液呈 (填“酸“中”或“碱)性,原因是 (用离子方程式表示):实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓 的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制)其 水解。 (2)明矾可用于净水,原因是 (用离子方程式表示):把AIC3溶液蒸干、灼烧,最后得到的主要固体产物 是 (3)纯碱可用作洗涤剂洗涤餐具,原因是 (用 离子方程式表示)。 答案:(1)酸Ag*+H2C一AgOH+Ht抑制 (2)A13+3H2O一AI(OH)3(胶体)+3H+A2O3 (3)C02+H20一HC05+OH 解析(1)AgNO3溶液中存在:Ag+H2C一AgOH+Ht,所以溶液呈酸性,为抑制 AgNO3水解,通常在酸性条件下配制AgNO3溶液。 (2)利用AI3++3H2O一A1(OH)3(胶体+3H+,A1(OH)3胶体能凝聚水中的悬浮杂质 从而达到净水目的:AICl3溶液中存在A1C3+3H2C一A1(OH)3+3HCL,加热时HCI 挥发,蒸千时得到A1(OH)3固体,再灼烧得到AhO3。 (3)C0?水解产生OH,溶液中c(OH)增大,去污能力增强。 11.常温下,取0.1 mol-L-!HA溶液与0.1molL1NaOH溶液等体积混合(混合后溶 液体积的变化不计),测得混合溶液的pH=8。试回答以下问题。 (I)混合溶液的pH=8的原因是 (用离 子方程式表示)。 (2)混合溶液中由水电离出的c(OH) (填“>(3)> 解析(I)0.1molL1HA溶液与01 mol-L-!NaOH溶液等体积混合,恰好完全反应, 由混合溶液的pH=8可知,A发生了水解。(2)盐类水解促进水的电离,而碱抑制水 的电离,故混合溶液中由水电离出的c(OH)大于NaOH溶液中由水电离出的 c(OH)。(3NH4A溶液为中性,则HA与NH3H2O的电离程度相同:HA溶液加入 N2CO3溶液中有气体放出,可知酸性HA>H2CO3,即电离程度HA>H2CO3,则电离
解析:0.1 mol CO2 与 0.15 mol NaOH 反应生成 Na2CO3和 NaHCO3各 0.05 mol,由 于 CO3 2-水解能力比 HCO3 - 强,且 CO3 2-水解生成 HCO3 - ,因此溶液中 c(HCO3 - )略大于 c(CO3 2- )。由物料守恒知 2c(Na+ )=3[c(CO3 2- )+c(HCO3 - )+c(H2CO3)]。 10.(1)AgNO3 的水溶液呈 (填“酸”“中”或“碱”)性,原因是 (用离子方程式表示);实验室在配制 AgNO3 溶液时,常将 AgNO3 固体先溶于较浓 的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其 水解。 (2)明矾可用于净水,原因是 (用离子方程式表示);把 AlCl3 溶液蒸干、灼烧,最后得到的主要固体产物 是 。 (3)纯碱可用作洗涤剂洗涤餐具,原因是 (用 离子方程式表示)。 答案:(1)酸 Ag++H2O AgOH+H+ 抑制 (2)Al3++3H2O Al(OH)3(胶体)+3H+ Al2O3 (3)CO3 2-+H2O HCO3 - +OH- 解析:(1)AgNO3 溶液中存在:Ag++H2O AgOH+H+ ,所以溶液呈酸性;为抑制 AgNO3 水解,通常在酸性条件下配制 AgNO3溶液。 (2)利用 Al3++3H2O Al(OH)3(胶体)+3H+ ,Al(OH)3 胶体能凝聚水中的悬浮杂质 从而达到净水目的;AlCl3 溶液中存在 AlCl3+3H2O Al(OH)3+3HCl,加热时 HCl 挥发,蒸干时得到 Al(OH)3 固体,再灼烧得到 Al2O3。 (3)CO3 2-水解产生 OH- ,溶液中 c(OH- )增大,去污能力增强。 11.常温下,取 0.1 mol·L -1 HA 溶液与 0.1 mol·L -1 NaOH 溶液等体积混合(混合后溶 液体积的变化不计),测得混合溶液的 pH=8。试回答以下问题。 (1)混合溶液的 pH=8 的原因是 (用离 子方程式表示)。 (2)混合溶液中由水电离出的 c(OH- ) (填“>”“ (3)> 解析:(1)0.1 mol·L -1 HA 溶液与 0.1 mol·L -1 NaOH 溶液等体积混合,恰好完全反应, 由混合溶液的 pH=8 可知,A-发生了水解。(2)盐类水解促进水的电离,而碱抑制水 的电离,故混合溶液中由水电离出的 c(OH- )大于 NaOH 溶液中由水电离出的 c(OH- )。(3)NH4A 溶液为中性,则 HA 与 NH3·H2O 的电离程度相同;HA 溶液加入 Na2CO3 溶液中有气体放出,可知酸性 HA>H2CO3,即电离程度 HA>H2CO3,则电离

程度NH3H2O>H2CO3,NH的水解程度小于CO?的水解程度,NH4)2CO3溶液显 碱性。 拓展提高 1.下列关于盐类水解的说法错误的是()。 A.在纯水中加入能水解的盐一定促进水的电离 B.常温下,等浓度的NaHCO3和NaCO3溶液,NaHCO3溶液的pH大 C.在NH4CI溶液中加入稀硝酸能抑制NH水解 D.加热CH3 COONa溶液,溶液中CH,Coo的值将减小 c(Na+) 答案B 解析:盐类水解促进水的电离,A项正确:常温下,同等浓度的两种溶液中CO?水解 程度大于HCO;,所以N2CO3溶液的pH大,B项错误NHt水解使溶液显酸性,加 入硝酸抑制NH生水解,C项正确:加热CH3 COONa溶液,CHCOO水解程度增 大,c(CHCO0)减小,cNa)不变,则CHc02变小,D项正确。 c(Na+) 2.相同物质的量浓度的NaCN和NaCIO相比,NaCN溶液的pH较大,则下列关于 同温、同体积、同浓度的HCN和HCIO溶液的说法中正确的是( A.酸性强弱:HCN>HCIO B.pH:HCIO>HCN C.与NaOH恰好完全反应时,消耗NaOH的物质的量HClO>HCN D.离子浓度:c(CNc(CIO) 答案D 解析:强碱弱酸盐的水溶液呈碱性,相应酸的酸性越弱,其强碱盐溶液的碱性越 强。NaCN溶液的pH比NaCIo大,说明HCN的酸性比HCIO弱。 3.室温下向10mL0.1molL1NaOH溶液中加入0.1molL1的一元酸HA,溶液 pH的变化曲线如图所示。下列说法正确的是( pH 10 20 VHA溶液)/ml A.M点所示溶液中cNa)>c(APc(H)Pc(OH) B.M、N两点所示溶液中水的电离程度相同 C.pH=7时,cNa)=c(A)+c(HA) D.N点所示溶液中c(A>CHA) 答案D
程度 NH3·H2O>H2CO3,NH4 +的水解程度小于 CO3 2-的水解程度,(NH4)2CO3溶液显 碱性。 拓展提高 1.下列关于盐类水解的说法错误的是( )。 A.在纯水中加入能水解的盐一定促进水的电离 B.常温下,等浓度的 NaHCO3 和 Na2CO3溶液,NaHCO3溶液的 pH 大 C.在 NH4Cl 溶液中加入稀硝酸能抑制 NH4 +水解 D.加热 CH3COONa 溶液,溶液中𝑐(CH3𝐶𝑂O - ) 𝑐(Na +) 的值将减小 答案:B 解析:盐类水解促进水的电离,A 项正确;常温下,同等浓度的两种溶液中 CO3 2-水解 程度大于 HCO3 - ,所以 Na2CO3 溶液的 pH 大,B 项错误;NH4 +水解使溶液显酸性,加 入硝酸抑制 NH4 +水解,C 项正确;加热 CH3COONa 溶液,CH3COO-水解程度增 大,c(CH3COO- )减小,c(Na+ )不变,则 𝑐(CH3𝐶𝑂O - ) 𝑐(Na +) 变小,D 项正确。 2.相同物质的量浓度的 NaCN 和 NaClO 相比,NaCN 溶液的 pH 较大,则下列关于 同温、同体积、同浓度的 HCN 和 HClO 溶液的说法中正确的是( )。 A.酸性强弱:HCN>HClO B.pH:HClO>HCN C.与 NaOH 恰好完全反应时,消耗 NaOH 的物质的量:HClO>HCN D.离子浓度:c(CN- )c(A- )>c(H+ )>c(OH- ) B.M、N 两点所示溶液中水的电离程度相同 C.pH=7 时,c(Na+ )=c(A- )+c(HA) D.N 点所示溶液中 c(A- )>c(HA) 答案:D

解析:A项,M点所示溶液中NaOH和HA恰好反应生成NaA,溶液的pH=8.7,呈碱 性,则HA为弱酸,A水解,则溶液中的粒子浓度cNa)>(A>c(OH)>cH)。B 项,N点时为NaA和HA的溶液,M点NaA发生水解反应,促进了水的电离,N,点 HA抑制了水的电离,所以M点所示溶液中水的电离程度大于N点。C项,pH=7 时,根据电荷守恒:cNa十c(H)=c(A十c(OH),c(Ht)=c(OH),所以c(Na=c(A)。D 项,N点酸过量,溶液呈酸性,HA的电离程度大于NaA的水解程度,故 c(AC(HA). 4.向浓度为0.1molL1NH4CI溶液中加入少量NH4CI固体,下列各量减小的是 () ①c(H+) ②cNH) ③CNH c(NH) ⑤NHt的水解程度 c(CF) c(NH3H20)-c(H+) ⑥cH+ ⑦cNH c(NH) c(NH3-H20) A.③⑤ B.⑤⑥ c.③⑥ D.①②⑦ 答案B 解析:①NH4CI溶液中存在水解平衡NHt+H2C一NH3H2O+H,加入少量NH4C】 固体,cNH)增大,平衡正向移动,则溶液中c(H)增大,错误;②根据勒夏特列原理 可知,平衡正向移动,但cNH)仍比原平衡大,错误;③cNH)增大,平衡正向移动 但NH时的水解程度减小,故增大,错误:④NH的水解平衡常数为 c(CF) 剥w叫,H0=六由于温度不变K不变,故 Kh-C(NH,HOcH迪,则cNH c(NH) c(NH) (NH3H2O)c(H+) 不变,错误:⑤加入少量NH4CI固体,水解平衡正向移动,但NHt的水解程度减小 正确;⑥结合水解常数Kn可知,=K aN时=wH,HO加入少量NH4CI固体,Ka不 变,cNH3H0)增大,故H减小,正确:⑦结合水解常数Kh可知,cH)= c(NH) c(NH3-H20) Kh 加入少量NH4C1固体,水解平衡正向移动,c但增大,但K不变,故增大, c(NHH2 O) 错误。 5.常温下,己知0.1 mol-LI的一元酸HA溶液,其溶液的pH>1;0.1 mol-L-I的一元 碱MOH溶液,OD)1x1012,将此两种溶液等体积混合,混合溶液中离子浓度关系 c(H+) 不正确的是( )。 A.c(OH)=cHA+cH) B.cM>c(A)Pc(OH>cH) C.cA>c(M)>cH)>cOH-)
解析:A 项,M 点所示溶液中 NaOH 和 HA 恰好反应生成 NaA,溶液的 pH=8.7,呈碱 性,则 HA 为弱酸,A-水解,则溶液中的粒子浓度 c(Na+ )>c(A- )>c(OH- )>c(H+ )。B 项,N 点时为 NaA 和 HA 的溶液,M 点 NaA 发生水解反应,促进了水的电离,N 点 HA 抑制了水的电离,所以 M 点所示溶液中水的电离程度大于 N 点。C 项,pH=7 时,根据电荷守恒:c(Na+ )+c(H+ )=c(A- )+c(OH- ),c(H+ )=c(OH- ),所以 c(Na+ )=c(A- )。D 项,N 点酸过量,溶液呈酸性,HA 的电离程度大于 NaA 的水解程度,故 c(A- )>c(HA)。 4.向浓度为 0.1 mol·L -1 NH4Cl 溶液中加入少量 NH4Cl 固体,下列各量减小的是 ( )。 ①c(H+ ) ②c(NH4 +) ③ 𝑐(NH4 +) 𝑐(Cl - ) ④ 𝑐(NH4 +) 𝑐(NH3 ·H2𝑂)·𝑐(H+) ⑤NH4 +的水解程度 ⑥ 𝑐(H +) 𝑐(NH4 +) ⑦ 𝑐(NH4 +) 𝑐(NH3 ·H2𝑂) A.③⑤ B.⑤⑥ C.③⑥ D.①②⑦ 答案:B 解析:①NH4Cl 溶液中存在水解平衡:NH4 ++H2O NH3·H2O+H+ ,加入少量 NH4Cl 固体,c(NH4 +)增大,平衡正向移动,则溶液中 c(H+ )增大,错误;②根据勒夏特列原理 可知,平衡正向移动,但 c(NH4 +)仍比原平衡大,错误;③c(NH4 +)增大,平衡正向移动, 但 NH4 +的水解程度减小,故 𝑐(NH4 +) 𝑐(Cl - ) 增大,错误;④NH4 +的水解平衡常数为 Kh= 𝑐(NH3 ·H2𝑂)·𝑐(H +) 𝑐(NH4 +) ,则 𝑐(NH4 +) 𝑐(NH3 ·H2𝑂)·𝑐(H+) = 1 𝐾h ,由于温度不变,Kh 不变,故 𝑐(NH4 +) 𝑐(NH3 ·H2𝑂)·𝑐(H+) 不变,错误;⑤加入少量 NH4Cl 固体,水解平衡正向移动,但 NH4 +的水解程度减小, 正确;⑥结合水解常数 Kh 可知, 𝑐(H +) 𝑐(NH4 +) = 𝐾h 𝑐(NH3 ·H2𝑂) ,加入少量 NH4Cl 固体,Kh 不 变,c(NH3·H2O)增大,故 𝑐(H +) 𝑐(NH4 +)减小,正确;⑦结合水解常数 Kh 可知, 𝑐(NH4 +) 𝑐(NH3 ·H2𝑂) = 𝑐(H +) 𝐾h , 加入少量 NH4Cl 固体,水解平衡正向移动,c(H+ )增大,但 Kh 不变,故 𝑐(NH4 +) 𝑐(NH3 ·H2𝑂)增大, 错误。 5.常温下,已知 0.1 mol·L -1 的一元酸 HA 溶液,其溶液的 pH>1;0.1 mol·L -1 的一元 碱 MOH 溶液, 𝑐(OH - ) 𝑐(H+) =1×1012 ,将此两种溶液等体积混合,混合溶液中离子浓度关系 不正确的是( )。 A.c(OH- )=c(HA)+c(H+ ) B.c(M+ )>c(A- )>c(OH- )>c(H+ ) C.c(A- )>c(M+ )>c(H+ )>c(OH- )

D.c(M)+c(H+)=c(A-)+c(OH) 答案C 解析:根据题干条件推知HA为弱酸,MOH为强碱,两者恰好完全反应生成盐 MA,A~发生水解反应A+H2C一HA+OH,B项正确,C项错误;根据质子守恒,A项 正确:根据电荷守恒,D项正确。 6 NaHSO4与NaHCO3是两种重要的酸式盐。 (I)NaHSO4固体溶于水显酸性,而NaHCO3固体溶于水显碱性,请用离子方程式并 配以必要的文字来说明NaHCO3固体溶于水显碱性的原 因 (2)常温下把1mL0.2 mol L-!的NaHSO4溶液加水稀释成2L溶液,此时溶液中由 水电离产生的c(H)为. (3)NaHSO4和NaHCO3两溶液混合反应的离子方程式为 (4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出反应的离子方程 式 ;在以上溶液中,继续滴 加Ba(OH)2溶液,此时反应的离子方程式为 (⑤)若将等体积、等物质的量浓度的NaHCO,溶液和Ba(OH)2溶液混合,反应的离 子方程式为 答案:(1)NaHCO3一Nat+HC05,HC05+H2C一HCO3+OH,HC05一C0好+Ht,且 HC0;水解程度大于电离程度,故溶液呈碱性 (2)1×10-10molL1 (3)H+HC03H2O+C02↑ (4)2H++S02+Ba2++20H-BaS04J+2H2O S02-+Ba2+-BaSO4J (5)HCO+Ba2++OH-BaCO3J+H2O 解析(1)NaHCO3是酸式盐,分析其溶液酸碱性就是分析HC0;水解能力与HCO; 电离能力的相对大小,溶液呈碱性,说明HC0;水解能力大于其电离能力。 (2cNaS04)02mol×10L-10×10-4molL,则cH*1.0×10-4molL-l,溶液中 2L 由水电离的c4,o(H)-cne,o(OH)-dOH。器10x10~0moL. (3)NaHSO4一Na+H+S0?,所以NaHSO4溶液相当于一元强酸溶液,与NaHCO3 溶液混合,HC0;+H+一H2O+CO2↑。 (4)2 NaHSO.4+Ba(OH)上一2HO+BaSO4+Na2SO4,OH、H+恰好完全反应,溶液呈 中性,此时溶液中还有Na2SO4。继续滴加Ba(OH)2溶液,发生反应 NaSO4+Ba(OH)上BaSO4+2NaOH,又生成沉淀,溶液显碱性。 (5)NaHCO3+Ba(OH)上一BaCO3J+NaOH+HO,改写成离子方程 式:HC05+Ba2+OH一BaCO3J+HO
D.c(M+ )+c(H+ )=c(A- )+c(OH- ) 答案:C 解析:根据题干条件推知 HA 为弱酸,MOH 为强碱,两者恰好完全反应生成盐 MA,A-发生水解反应 A-+H2O HA+OH- ,B 项正确,C 项错误;根据质子守恒,A 项 正确;根据电荷守恒,D 项正确。 6.NaHSO4 与 NaHCO3是两种重要的酸式盐。 (1)NaHSO4 固体溶于水显酸性,而 NaHCO3固体溶于水显碱性,请用离子方程式并 配以必要的文字来说明 NaHCO3 固体溶于水显碱性的原 因: 。 (2)常温下把 1 mL 0.2 mol·L -1 的 NaHSO4 溶液加水稀释成 2 L 溶液,此时溶液中由 水电离产生的 c(H+ )为 。 (3)NaHSO4 和 NaHCO3两溶液混合反应的离子方程式为 。 (4)向 NaHSO4 溶液中逐滴加入 Ba(OH)2 溶液至中性,请写出反应的离子方程 式: ;在以上溶液中,继续滴 加 Ba(OH)2 溶液,此时反应的离子方程式为 。 (5)若将等体积、等物质的量浓度的 NaHCO3 溶液和 Ba(OH)2 溶液混合,反应的离 子方程式为 。 答案:(1)NaHCO3 Na++HCO3 - ,HCO3 - +H2O H2CO3+OH- ,HCO3 - CO3 2-+H+ ,且 HCO3 - 水解程度大于电离程度,故溶液呈碱性 (2)1×10-10 mol·L -1 (3)H++HCO3 - H2O+CO2↑ (4)2H++SO4 2-+Ba2++2OH- BaSO4↓+2H2O SO4 2-+Ba2+ BaSO4↓ (5)HCO3 - +Ba2++OH- BaCO3↓+H2O 解析:(1)NaHCO3 是酸式盐,分析其溶液酸碱性就是分析 HCO3 - 水解能力与 HCO3 - 电离能力的相对大小,溶液呈碱性,说明 HCO3 - 水解能力大于其电离能力。 (2)c(NaHSO4)=0.2mol·L -1×10 -3 L 2 L =1.0×10-4 mol·L -1 ,则 c(H+ )=1.0×10-4 mol·L -1 ,溶液中 由水电离的𝑐H2 O(H+ )=𝑐H2O (OH- )=c(OH- )= 𝐾W 𝑐(H+) =1.0×10-10 mol·L -1。 (3)NaHSO4 Na++H++SO4 2- ,所以 NaHSO4溶液相当于一元强酸溶液,与 NaHCO3 溶液混合,HCO3 - +H+ H2O+CO2↑。 (4)2NaHSO4+Ba(OH)2 2H2O+BaSO4↓+Na2SO4,OH-、H+恰好完全反应,溶液呈 中性,此时溶液中还有 Na2SO4。继续滴加 Ba(OH)2溶液,发生反应 Na2SO4+Ba(OH)2 BaSO4↓+2NaOH,又生成沉淀,溶液显碱性。 (5)NaHCO3+Ba(OH)2 BaCO3↓+NaOH+H2O,改写成离子方程 式:HCO3 - +Ba2++OH- BaCO3↓+H2O
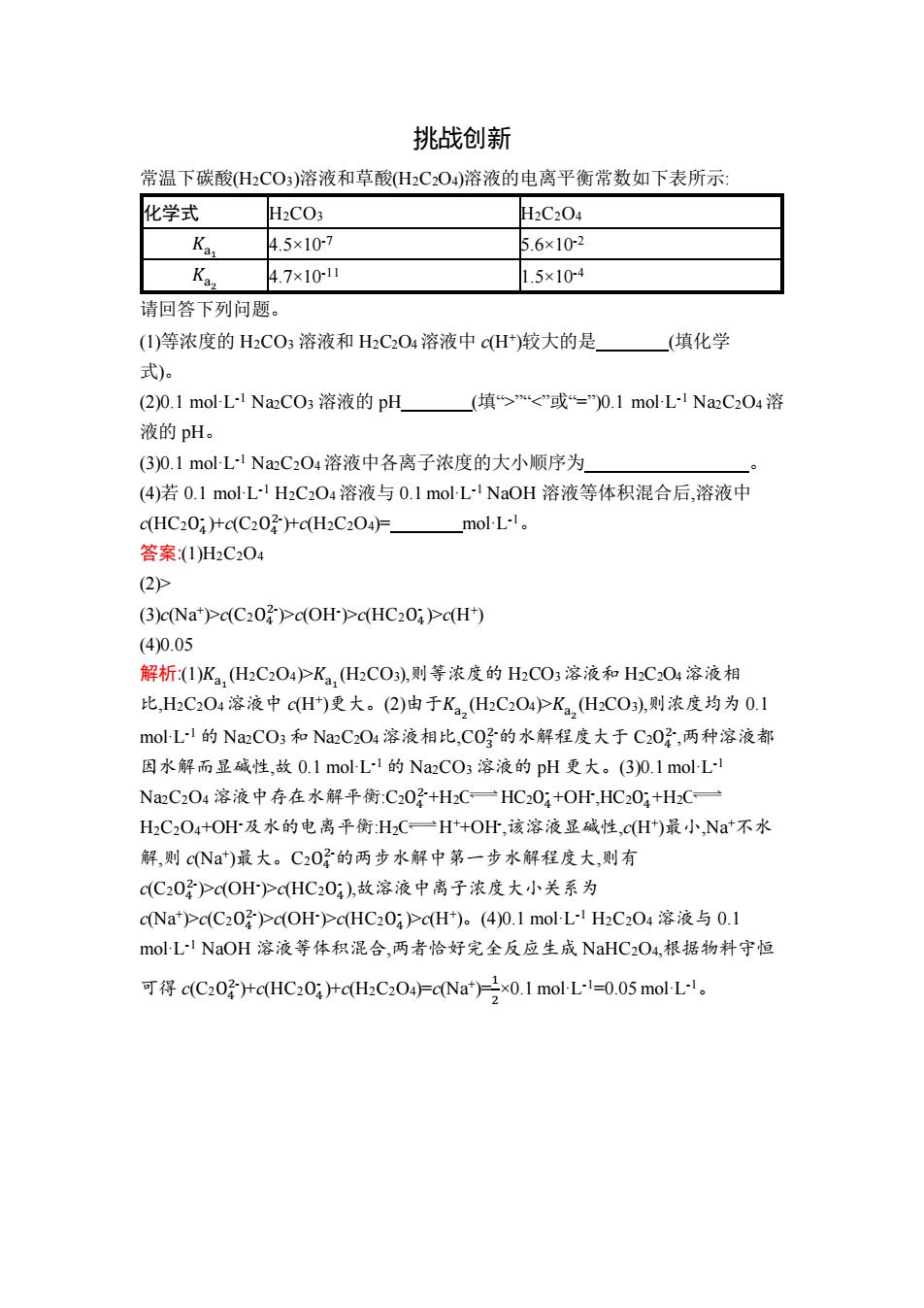
挑战创新 常温下碳酸(H2CO3)溶液和草酸H2C2O4)溶液的电离平衡常数如下表所示 化学式 H2CO3 H2C204 Ka 4.5×107 5.6×102 K 4.7×1011 1.5×104 请回答下列问题。 (1)等浓度的H2CO3溶液和H2C2O4溶液中cH+)较大的是 (填化学 式)。 (2)0.1 mol-L-I Na2CO3溶液的pH (填> (3)c(Na')c(C202>c(OH)c(HC202)>c(H+) (4)0.05 解析(1)K2,(C2O4>K2,(HCO),则等浓度的HCO3溶液和HC204溶液相 比,HC204溶液中cH)更大。(2)由于K2,HC2O4)PK2,HC0,则浓度均为0.1 mol-L!的Na2CO3和Na2C2O4溶液相比,C0?的水解程度大于C20?,两种溶液都 因水解而显碱性,故0.1 mol-L-I的Na2CO3溶液的pH更大。(3)0.1molL N2C2O4溶液中存在水解平衡:C202+H2C一HC20:+OH,HC20:+H2C一 H2C2O4+OH及水的电离平衡H2C一H+OH,该溶液显碱性,c(H)最小,Na*不水 解,则cNa)最大。C20子的两步水解中第一步水解程度大,则有 C(C20好Pc(OHPc(HC20),故溶液中离子浓度大小关系为 cNa)>c(C20-)>c(OH>cHC20:>cH)。(4)0.1molL1HC2O4溶液与0.1 mol-L-!NaOH溶液等体积混合,两者恰好完全反应生成NaHC2O4,根据物料守恒 可得c(C20HcHC20a+c(HC204cNa*2×0.1molL-l=0.05molL-l
挑战创新 常温下碳酸(H2CO3)溶液和草酸(H2C2O4)溶液的电离平衡常数如下表所示: 化学式 H2CO3 H2C2O4 𝐾a1 4.5×10-7 5.6×10-2 𝐾a2 4.7×10-11 1.5×10-4 请回答下列问题。 (1)等浓度的 H2CO3 溶液和 H2C2O4溶液中 c(H+ )较大的是 (填化学 式)。 (2)0.1 mol·L -1 Na2CO3 溶液的 pH (填“>”“ (3)c(Na+ )>c(C2O4 2- )>c(OH- )>c(HC2O4 - )>c(H+ ) (4)0.05 解析:(1)𝐾a1 (H2C2O4)>𝐾a1 (H2CO3),则等浓度的 H2CO3溶液和 H2C2O4溶液相 比,H2C2O4溶液中 c(H+ )更大。(2)由于𝐾a2 (H2C2O4)>𝐾a2 (H2CO3),则浓度均为 0.1 mol·L -1 的 Na2CO3 和 Na2C2O4溶液相比,CO3 2-的水解程度大于 C2O4 2- ,两种溶液都 因水解而显碱性,故 0.1 mol·L -1 的 Na2CO3 溶液的 pH 更大。(3)0.1 mol·L -1 Na2C2O4 溶液中存在水解平衡:C2O4 2-+H2O HC2O4 - +OH- ,HC2O4 - +H2O H2C2O4+OH-及水的电离平衡:H2O H++OH- ,该溶液显碱性,c(H+ )最小,Na+不水 解,则 c(Na+ )最大。C2O4 2-的两步水解中第一步水解程度大,则有 c(C2O4 2- )>c(OH- )>c(HC2O4 - ),故溶液中离子浓度大小关系为 c(Na+ )>c(C2O4 2- )>c(OH- )>c(HC2O4 - )>c(H+ )。(4)0.1 mol·L -1 H2C2O4 溶液与 0.1 mol·L -1 NaOH 溶液等体积混合,两者恰好完全反应生成 NaHC2O4,根据物料守恒 可得 c(C2O4 2- )+c(HC2O4 - )+c(H2C2O4)=c(Na+ )=1 2 ×0.1 mol·L -1=0.05 mol·L -1