
第二章过关检测 (时间:90分钟满分:100分) 一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题 意) 1.下列有关有效碰撞理论和活化能的认识,正确的是()。 A.增大压强(对于有气体参与的反应),活化分子总数增大,故反应速率增大 B.温度升高,分子运动加快,反应所需活化能减小,故反应速率增大 C选用适当的催化剂,分子运动加快,有效碰撞次数增加,故反应速率增大 DH+和OH的反应活化能接近于O,反应几乎在瞬间完成 答案D 解析:增大压强,体积减小,活化分子总数不变,但单位体积内的活化分子数增多,反 应速率增大,A项不正确。温度升高,更多分子吸收能量成为活化分子,反应速率 增大,但反应所需的活化能不变,B项不正确。使用催化剂,可降低反应所需的活 化能,使更多分子成为活化分子,反应速率增大,C项不正确。 2.运用相关化学知识进行判断,下列结论错误的是( A.某吸热反应能自发进行,因此该反应是熵增反应 B.在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 C.可燃冰是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 D.增大反应物浓度可增大反应速率,因此用浓硫酸与铁反应能加快生成H2的速 率 答案D 解析:反应能自发进行,则△H-T△S0,则△S>0,故该反应 一定是熵增反应,A项正确:催化剂不能使平衡发生移动,B项正确;海底为低温高 压环境,所以可燃冰可存在于海底,C项正确:常温下,铁在浓硫酸中可发生钝化,不 产生氢气,D项错误。 3.科学家最近设计出生产氢气的人造树叶,原理为2H0(g人造树叶 太阳能 2H2(g十O2(g)。有关该反应的说法正确的是()。 A.△H0:水蒸气生成氢气和氧气,气体的 物质的量增加,熵值增大,故△S>0
第二章过关检测 (时间:90 分钟 满分:100 分) 一、选择题(本题共 15 小题,每小题 3 分,共 45 分。每小题只有一个选项符合题 意) 1.下列有关有效碰撞理论和活化能的认识,正确的是( )。 A.增大压强(对于有气体参与的反应),活化分子总数增大,故反应速率增大 B.温度升高,分子运动加快,反应所需活化能减小,故反应速率增大 C.选用适当的催化剂,分子运动加快,有效碰撞次数增加,故反应速率增大 D.H+和 OH-的反应活化能接近于 0,反应几乎在瞬间完成 答案:D 解析:增大压强,体积减小,活化分子总数不变,但单位体积内的活化分子数增多,反 应速率增大,A 项不正确。温度升高,更多分子吸收能量成为活化分子,反应速率 增大,但反应所需的活化能不变,B 项不正确。使用催化剂,可降低反应所需的活 化能,使更多分子成为活化分子,反应速率增大,C 项不正确。 2.运用相关化学知识进行判断,下列结论错误的是( )。 A.某吸热反应能自发进行,因此该反应是熵增反应 B.在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 C.可燃冰是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 D.增大反应物浓度可增大反应速率,因此用浓硫酸与铁反应能加快生成 H2 的速 率 答案:D 解析:反应能自发进行,则 ΔH-TΔS0,则 ΔS>0,故该反应 一定是熵增反应,A 项正确;催化剂不能使平衡发生移动,B 项正确;海底为低温高 压环境,所以可燃冰可存在于海底,C 项正确;常温下,铁在浓硫酸中可发生钝化,不 产生氢气,D 项错误。 3.科学家最近设计出生产氢气的人造树叶,原理为 2H2O(g) 2H2(g)+O2(g)。有关该反应的说法正确的是( )。 A.ΔH0;水蒸气生成氢气和氧气,气体的 物质的量增加,熵值增大,故 ΔS>0

4.可逆反应aX(?)+2Y(g)一2Z(g)在一定条件下达到平衡后,1和2时各改变某一 种外界条件,化学反应速率与时间的关系如图所示。则下列说法中正确的是 ()。 A.若X是固体,则1时一定是增大了容器的压强 B.若X是气体,则2时不可能是减小容器压强 C若X是固体,则1时可能是增大了X的质量 D.若2时采用了降温措施,则该反应的正反应方向△>0 答案B 解析:A项,若X为固体,增大压强,平衡不移动,若使用催化剂,平衡也不移动,错 误;B项,若X为气体,h时正、逆反应速率都减小,不可能是减小容器压强,因为减 小压强,平衡逆向移动,而图像中平衡正向移动,正确:C项,若X为固体,山时若增大 了X的量,平衡不移动,反应速率不变,错误D项,2时若采用降温,正、逆反应速率 都减小,平衡正向移动,说明正反应为放热反应,△H<0,错误。 5.在一定温度下,向密闭容器中充入一定物质的量的NO2和SO2,发生反 应NO2+SO2一NO+SO3,达到平衡时,下列叙述正确的是() A.SO2、NO2、NO、SO3的物质的量一定相等 B.NO2和SO2的物质的量一定相等 C.平衡体系中反应物的总物质的量一定等于生成物的总物质的量 D.NO和SO3的物质的量一定相等 答案D 解析:容器中开始充入的是NO2和SO2,又因为生成物NO和SO3的化学计量数之 比为1:1,故只有NO和SO3的物质的量一定相等,A项错误,D项正确;因为不知 道两种气体的充入量,平衡时NO2和SO2的物质的量不一定相等,B项错误;该反 应是反应前后气体分子数不变的可逆反应,反应过程中气体总物质的量保持不变, 但平衡体系中反应物的总物质的量不一定等于生成物的总物质的量,C项错误。 6.己知反应CO(g+HO(g)一CO2(g十H2(g)△H<0。在一定温度和压强下的密 闭容器中,反应达到平衡。下列叙述正确的是()。 A.升高温度,K减小 B.减小压强,n(CO2)增加 C.更换高效催化剂,(CO)增大 D.充入一定量的氮气,nH2)变大 答案:A
4.可逆反应 aX(?)+2Y(g) 2Z(g)在一定条件下达到平衡后,t1 和 t2 时各改变某一 种外界条件,化学反应速率与时间的关系如图所示。则下列说法中正确的是 ( )。 A.若 X 是固体,则 t1 时一定是增大了容器的压强 B.若 X 是气体,则 t2 时不可能是减小容器压强 C.若 X 是固体,则 t1 时可能是增大了 X 的质量 D.若 t2 时采用了降温措施,则该反应的正反应方向 ΔH>0 答案:B 解析:A 项,若 X 为固体,增大压强,平衡不移动,若使用催化剂,平衡也不移动,错 误;B 项,若 X 为气体,t2 时正、逆反应速率都减小,不可能是减小容器压强,因为减 小压强,平衡逆向移动,而图像中平衡正向移动,正确;C 项,若 X 为固体,t1 时若增大 了 X 的量,平衡不移动,反应速率不变,错误;D 项,t2 时若采用降温,正、逆反应速率 都减小,平衡正向移动,说明正反应为放热反应,ΔH<0,错误。 5.在一定温度下,向密闭容器中充入一定物质的量的 NO2 和 SO2,发生反 应:NO2+SO2 NO+SO3,达到平衡时,下列叙述正确的是( )。 A.SO2、NO2、NO、SO3的物质的量一定相等 B.NO2 和 SO2的物质的量一定相等 C.平衡体系中反应物的总物质的量一定等于生成物的总物质的量 D.NO 和 SO3 的物质的量一定相等 答案:D 解析:容器中开始充入的是 NO2 和 SO2,又因为生成物 NO 和 SO3的化学计量数之 比为 1∶1,故只有 NO 和 SO3 的物质的量一定相等,A 项错误,D 项正确;因为不知 道两种气体的充入量,平衡时 NO2 和 SO2 的物质的量不一定相等,B 项错误;该反 应是反应前后气体分子数不变的可逆反应,反应过程中气体总物质的量保持不变, 但平衡体系中反应物的总物质的量不一定等于生成物的总物质的量,C 项错误。 6.已知反应 CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。在一定温度和压强下的密 闭容器中,反应达到平衡。下列叙述正确的是( )。 A.升高温度,K 减小 B.减小压强,n(CO2)增加 C.更换高效催化剂,α(CO)增大 D.充入一定量的氮气,n(H2)变大 答案:A

解析:正反应是放热反应,升高温度平衡向逆反应方向移动,即升高温度,K值减 小,A项正确;此反应为反应前后体积不变的反应,因此减小压强,平衡不移动,即 (CO2)不变,B项错误;催化剂对化学平衡移动无影响,因此C0的转化率不变,C 项错误N2为惰性气体,不参与反应,对平衡无影响,(H2)不变,D项错误。 7.某温度下,密闭容器中发生反应aX(g)一bY(g十cZ(g),达到平衡后,保持温度不 变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均 是原来的1.8倍。则下列叙述正确的是()。 A.a>b+c B.压缩容器的容积时,v正增大,y逆减小 C达到新平衡时,物质X的转化率减小 D达到新平衡时,混合物中Z的质量分数增大 答案:C 解析:恒温下,容器容积缩小为原来的一半,若平衡不移动,则物质Y和Z的浓度将 增加至原来的2倍,而实际上达到新平衡时Y和Z的浓度为原来的1.8倍,说明平 衡逆向移动,则a<b+C,A项错误;当压缩容器的容积时(即增大压强),正反应速率、 逆反应速率都增大,B项错误;平衡逆向移动,达到新平衡时,反应物X的转化率减 小,生成物Z的质量分数减小,C项正确,D项错误。 8.在容积不变的密闭容器中存在如下反应:2S02(g+O2(g)一2SO3(g)△H<0。其 他条件一定,只改变某一条件时,下列分析不正确的是( 十反应速率 ↑反应速率 ! v'正=V逆 正 入正 时间 0 1时间 图I 图Ⅱ ↑S02转化率 甲 乙 时间 图Ⅲ A.图I表示的是1时刻增大压强对反应速率的影响 B.图Ⅱ表示的是1时刻加入催化剂对反应速率的影响 C.图Ⅲ表示的是温度对化学平衡的影响,且甲的温度小于乙的温度 D.图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂 答案D
解析:正反应是放热反应,升高温度平衡向逆反应方向移动,即升高温度,K 值减 小,A 项正确;此反应为反应前后体积不变的反应,因此减小压强,平衡不移动,即 n(CO2)不变,B 项错误;催化剂对化学平衡移动无影响,因此 CO 的转化率不变,C 项错误;N2 为惰性气体,不参与反应,对平衡无影响,n(H2)不变,D 项错误。 7.某温度下,密闭容器中发生反应 aX(g) bY(g)+cZ(g),达到平衡后,保持温度不 变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质 Y 和 Z 的浓度均 是原来的 1.8 倍。则下列叙述正确的是( )。 A.a>b+c B.压缩容器的容积时,v 正增大,v 逆减小 C.达到新平衡时,物质 X 的转化率减小 D.达到新平衡时,混合物中 Z 的质量分数增大 答案:C 解析:恒温下,容器容积缩小为原来的一半,若平衡不移动,则物质 Y 和 Z 的浓度将 增加至原来的 2 倍,而实际上达到新平衡时 Y 和 Z 的浓度为原来的 1.8 倍,说明平 衡逆向移动,则 a<b+c,A 项错误;当压缩容器的容积时(即增大压强),正反应速率、 逆反应速率都增大,B 项错误;平衡逆向移动,达到新平衡时,反应物 X 的转化率减 小,生成物 Z 的质量分数减小,C 项正确,D 项错误。 8.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。其 他条件一定,只改变某一条件时,下列分析不正确的是( )。 A.图Ⅰ表示的是 t1 时刻增大压强对反应速率的影响 B.图Ⅱ表示的是 t1 时刻加入催化剂对反应速率的影响 C.图Ⅲ表示的是温度对化学平衡的影响,且甲的温度小于乙的温度 D.图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂 答案:D

解析:该反应为气体体积减小的反应,增大压强,正、逆反应速率均增大,且正反应 速率大于逆反应速率,平衡正向移动,则图I中山时刻可以表示增大压强对反应速 率的影响,A项正确:催化剂对平衡移动无影响,同等程度增大正、逆反应速率,则 图Ⅱ中1时刻可以表示加入催化剂对反应速率的影响,B项正确:图Ⅱ中乙先达到 平衡,则乙的温度高,且温度高时SO2的转化率小,说明升高温度平衡逆向移动,而 题述反应的正反应为放热反应,与图像一致,C项正确:催化剂对平衡移动无影响, 而题图Ⅲ中甲、乙两种条件下SO2的转化率不同,则不能表示催化剂对化学平衡 的影响,D项错误。 9.在1.5L的密闭容器中通入2molN2和3molH2的混合气体,在一定温度下发 生反应。达到平衡时,容器内压强为反应开始时的0.8,则该反应的化学平衡常数 为)。 A.0.34 B.0.64 C.0.44 D.0.54 答案:C 解析:温度和体积相同,则压强之比等于气体的物质的量之比。设达到平衡时N2 转化的物质的量为xmol,则 N2+ 3H2=2NH3 起始量mol 2 3 0 转化量mol X 3x 2x 平衡量mol 2-x 3-3x 2x = 5 解得x=0.5 则K=c2N)=冬0.44。 c(N2)c3(H2)9 10.一定量的CO2与足量的碳在容积可变的恒压密闭容器中反应:C(s+CO2(g,一 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示。 ↑体积分数/% 100.0 93.0 96.0 80.0 CO 60.0 40.0 40.0 20.0 10.7 0. 0 4.0 445 550650T 800 925温度/°C 已知:气体分压(p分尸气体总压(p)×体积分数。 下列说法正确的是( A.550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
解析:该反应为气体体积减小的反应,增大压强,正、逆反应速率均增大,且正反应 速率大于逆反应速率,平衡正向移动,则图Ⅰ中 t1 时刻可以表示增大压强对反应速 率的影响,A 项正确;催化剂对平衡移动无影响,同等程度增大正、逆反应速率,则 图Ⅱ中 t1 时刻可以表示加入催化剂对反应速率的影响,B 项正确;图Ⅲ中乙先达到 平衡,则乙的温度高,且温度高时 SO2 的转化率小,说明升高温度平衡逆向移动,而 题述反应的正反应为放热反应,与图像一致,C 项正确;催化剂对平衡移动无影响, 而题图Ⅲ中甲、乙两种条件下 SO2 的转化率不同,则不能表示催化剂对化学平衡 的影响,D 项错误。 9.在 1.5 L 的密闭容器中通入 2 mol N2 和 3 mol H2 的混合气体,在一定温度下发 生反应。达到平衡时,容器内压强为反应开始时的 0.8,则该反应的化学平衡常数 为( )。 A.0.34 B.0.64 C.0.44 D.0.54 答案:C 解析:温度和体积相同,则压强之比等于气体的物质的量之比。设达到平衡时 N2 转化的物质的量为 x mol,则 N2 + 3H2 2NH3 起始量/mol 2 3 0 转化量/mol x 3x 2x 平衡量/mol 2-x 3-3x 2x 5-2𝑥 5 = 0.8 1 解得 x=0.5 则 K= 𝑐 2 (NH3 ) 𝑐(N2 )·𝑐 3(H2 ) = 4 9 ≈0.44。 10.一定量的 CO2 与足量的碳在容积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g),平衡时,体系中气体体积分数与温度的关系如下图所示。 已知:气体分压(p 分)=气体总压(p 总)×体积分数。 下列说法正确的是( )。 A.550 ℃时,若充入惰性气体,v 正、v 逆均减小,平衡不移动

B.650℃时,反应达平衡后C02的转化率为25.0% C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总 答案B 解析:550℃时,若充入惰性气体,由于是在恒压容器中反应,因此相当于扩大了容 积,y、V逆均减小,平衡正向移动,A项错误。根据图示可知,在650℃时,C0的体 积分数为40.0%,根据化学方程式:C(s+CO2(g)一2CO(g)。设开始加入1mol CO2,反应了xmoL则有 C(s)+ C02(g)=2C0(g) 始态mol: 1 0 变化mol: x 2x 平衡mol: 1-x 2x 因此有2×100%=40.0%,解得=0.250,即C02的转化率为25.0%,故B项正确。 1+x 由图可知T℃达到平衡时CO和CO2的体积分数相等,则T℃时充入等体积的 C02和C0时平衡不移动,C项错误。925℃时,C0的体积分数为96.0%,故 Kp=ccQ、 (96.0%P总)2 c(CO2) 4.00%p总 =23.04p总,D项错误。 11.以二氧化碳和氢气为原料制取乙醇的反应为2C02(g十6H(g)一 CH3CHOH(g十3H2O(g)△H<0。某压强下的密闭容器中,按CO2和H2的物质的 量比为1∶:3投料,不同温度下平衡体系中各物质的物质的量分数6%)随温度变 化如图所示。下列说法正确的是( 温度rC A.M点的平衡常数小于N点 B.N点,v(CO2=逆(H2O) C.M点,H2和H2O物质的量相等 D.其他条件恒定,充入更多H2,CO2)不变 答案:C 解析:从图像可知,温度越高氢气的含量越高,说明升高温度平衡向逆反应方向移 动,温度升高平衡常数减小,M点平衡常数大于N点,A项错误;W点只能说明该温 度下,CO2和H2O的浓度相等,不能说明v(CO2)戶v远(H2O),B项错误;从图像可
B.650 ℃时,反应达平衡后 CO2 的转化率为 25.0% C.T ℃时,若充入等体积的 CO2 和 CO,平衡向逆反应方向移动 D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数 Kp=24.0p 总 答案:B 解析:550 ℃时,若充入惰性气体,由于是在恒压容器中反应,因此相当于扩大了容 积,v 正、v 逆均减小,平衡正向移动,A 项错误。根据图示可知,在 650 ℃时,CO 的体 积分数为 40.0%,根据化学方程式:C(s)+CO2(g) 2CO(g)。设开始加入 1 mol CO2,反应了 x mol,则有: C(s)+ CO2(g) 2CO(g) 始态/mol: 1 0 变化/mol: x 2x 平衡/mol: 1-x 2x 因此有: 2𝑥 1+𝑥 ×100%=40.0%,解得 x=0.250,即 CO2 的转化率为 25.0%,故 B 项正确。 由图可知 T ℃达到平衡时 CO 和 CO2 的体积分数相等,则 T ℃时充入等体积的 CO2 和 CO 时平衡不移动,C 项错误。925 ℃时,CO 的体积分数为 96.0%,故 Kp= 𝑐 2 (CO) 𝑐(CO2 ) = (96.0% 𝑝总 ) 2 4.00% 𝑝总 =23.04p 总,D 项错误。 11.以二氧化碳和氢气为原料制取乙醇的反应为 2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH<0。某压强下的密闭容器中,按 CO2 和 H2 的物质的 量比为 1∶3 投料,不同温度下平衡体系中各物质的物质的量分数(y%)随温度变 化如图所示。下列说法正确的是( )。 A.M 点的平衡常数小于 N 点 B.N 点,v 正(CO2)=v 逆(H2O) C.M 点,H2 和 H2O 物质的量相等 D.其他条件恒定,充入更多 H2,v(CO2)不变 答案:C 解析:从图像可知,温度越高氢气的含量越高,说明升高温度平衡向逆反应方向移 动,温度升高平衡常数减小,M 点平衡常数大于 N 点,A 项错误;N 点只能说明该温 度下,CO2 和 H2O 的浓度相等,不能说明 v 正(CO2)=v 逆(H2O),B 项错误;从图像可
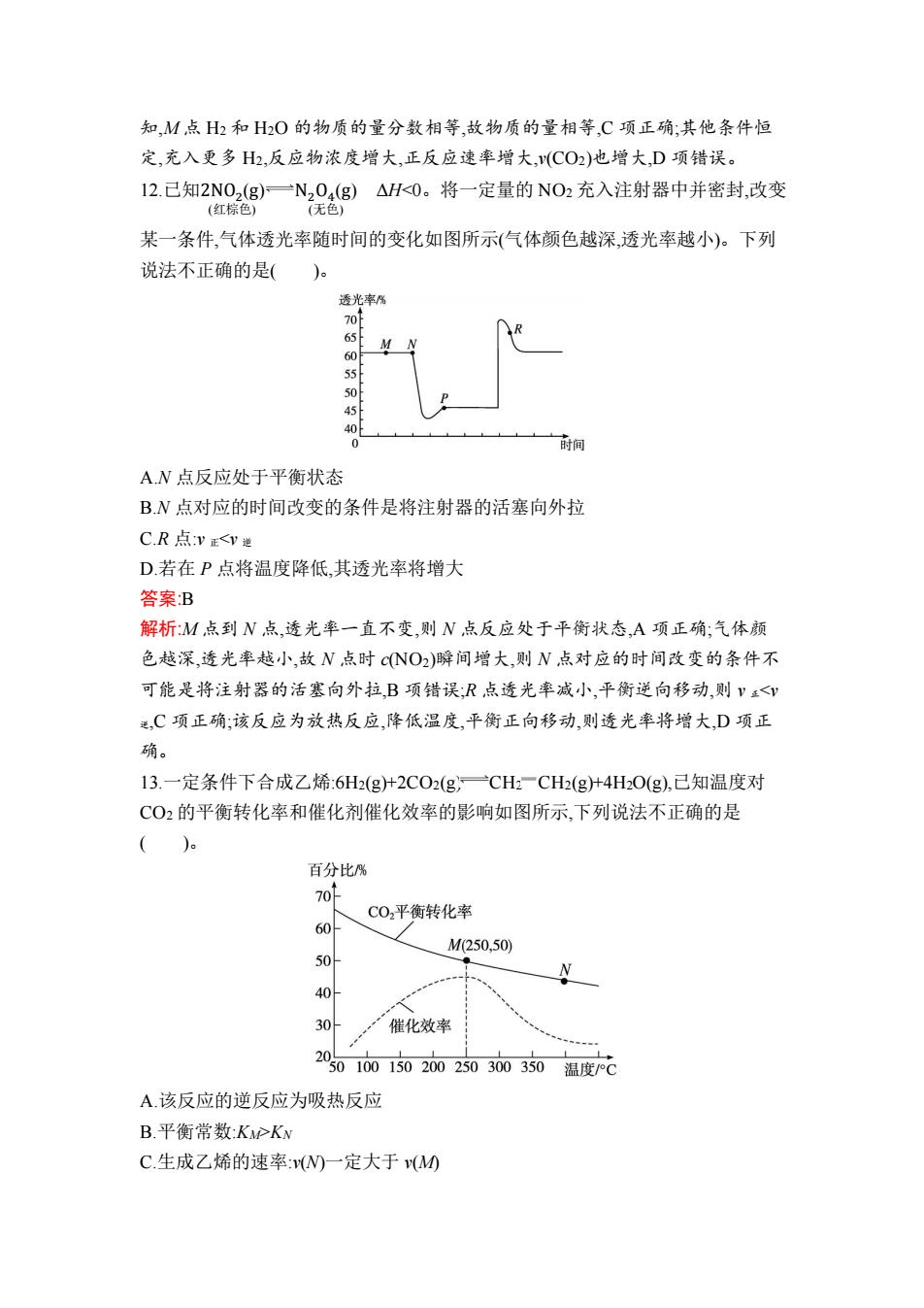
知,M点H2和H2O的物质的量分数相等,故物质的量相等,C项正确:其他条件恒 定,充入更多H2,反应物浓度增大,正反应速率增大,v(CO2)也增大,D项错误。 12.已知2N02(g)一N204(g)△H<0。将一定量的NO2充入注射器中并密封,改变 (红棕色) (无色) 某一条件,气体透光率随时间的变化如图所示(气体颜色越深,透光率越小)。下列 说法不正确的是()。 透光率% 65 60 55 45 40F 0 时间 AN点反应处于平衡状态 B.N点对应的时间改变的条件是将注射器的活塞向外拉 CR点:V正<y逆 D.若在P点将温度降低,其透光率将增大 答案B 解析:M点到N点,透光率一直不变,则N点反应处于平衡状态,A项正确;气体颜 色越深,透光率越小,故N点时CNO2)瞬间增大,则N点对应的时间改变的条件不 可能是将注射器的活塞向外拉,B项错误,R点透光率减小,平衡逆向移动,则ⅴ<v 送,C项正确;该反应为放热反应,降低温度,平衡正向移动,则透光率将增大,D项正 确。 13.一定条件下合成乙烯:6H2(g十2CO2(g)一CH,一CH2(g+4HO(g),已知温度对 CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是 () 百分比% 701 C02平衡转化率 60 M250,50) 50L 40 30 催化效率 2050100150200250300350温度P℃ A.该反应的逆反应为吸热反应 B.平衡常数:KPKN C.生成乙烯的速率:vN一定大于v(M0
知,M 点 H2 和 H2O 的物质的量分数相等,故物质的量相等,C 项正确;其他条件恒 定,充入更多 H2,反应物浓度增大,正反应速率增大,v(CO2)也增大,D 项错误。 12.已知2NO2 (g) (红棕色) N2O4 (g) (无色) ΔHKN C.生成乙烯的速率:v(N)一定大于 v(M)

D.当温度高于250℃,升高温度,催化剂的催化效率降低 答案C 解析:升高温度,CO2的平衡转化率降低,则升温平衡逆向移动,则逆反应为吸热反 应,A项正确;M,点化学平衡常数大于N点,B项正确:化学反应速率随温度的升高 而增大,但温度高于250℃后,催化剂的催化效率随温度的升高而降低,所以(W) 有可能小于v(M),C项错误;根据图像,当温度高于250℃,升高温度催化剂的催化 效率降低,D项正确。 14.在①、②、③容积不等的恒容密闭容器中,均充入0.1molC0和0.2molH2,在 催化剂的作用下发生反应:CO(g十2H(g)一CH3OH(g)。测得三个容器中平衡混 合物中CH3OH的体积分数随温度的变化如图所示。 (CH,OH)/ 100 80 60 0 ① ② 20 ③ 200300 400500600 温度/C 下列说法正确的是( )。 A.该反应的正反应为吸热反应 B.三个容器的容积:①>②>③ C.在P点,C0的转化率为75% D.在P点,向容器②中再充入CO、H2及CHOH各0.025mol,此时v(COy迪 (CO) 答案:C 解析:由题图可知,容积一定时,温度升高,CH3OH的体积分数减小,说明升高温度, 平衡逆向移动,故该反应的△H<0,正反应为放热反应,A项错误。三个容器中起始 加入CO和H2的量分别相等,温度一定时,容器的容积越小,体系的压强越大,反应 向正反应方向进行的程度越大,反应物的转化率越大,CH3OH的体积分数越大,故 容器的容积:①<②<③,B项错误。P点CH3OH的体积分数为50%,根据同温同压 下,气体的体积之比等于其物质的量之比,设达到平衡后转化的CO的物质的量为 xmol,则有 CO(g)+ 2H2(g)CH3OH(g) 起始量mol 0.1 0.2 0 转化量mol 2x 平衡量mol 0.1-x 0.2-2x
D.当温度高于 250 ℃,升高温度,催化剂的催化效率降低 答案:C 解析:升高温度,CO2 的平衡转化率降低,则升温平衡逆向移动,则逆反应为吸热反 应,A 项正确;M 点化学平衡常数大于 N 点,B 项正确;化学反应速率随温度的升高 而增大,但温度高于 250 ℃后,催化剂的催化效率随温度的升高而降低,所以 v(N) 有可能小于 v(M),C 项错误;根据图像,当温度高于 250 ℃,升高温度催化剂的催化 效率降低,D 项正确。 14.在①、②、③容积不等的恒容密闭容器中,均充入 0.1 mol CO 和 0.2 mol H2,在 催化剂的作用下发生反应:CO(g)+2H2(g) CH3OH(g)。测得三个容器中平衡混 合物中 CH3OH 的体积分数随温度的变化如图所示。 下列说法正确的是( )。 A.该反应的正反应为吸热反应 B.三个容器的容积:①>②>③ C.在 P 点,CO 的转化率为 75% D.在 P 点,向容器②中再充入 CO、H2 及 CH3OH 各 0.025 mol,此时 v 正(CO)<v 逆 (CO) 答案:C 解析:由题图可知,容积一定时,温度升高,CH3OH 的体积分数减小,说明升高温度, 平衡逆向移动,故该反应的 ΔH<0,正反应为放热反应,A 项错误。三个容器中起始 加入 CO 和 H2 的量分别相等,温度一定时,容器的容积越小,体系的压强越大,反应 向正反应方向进行的程度越大,反应物的转化率越大,CH3OH 的体积分数越大,故 容器的容积:①<②<③,B 项错误。P 点 CH3OH 的体积分数为 50%,根据同温同压 下,气体的体积之比等于其物质的量之比,设达到平衡后转化的 CO 的物质的量为 x mol,则有 CO(g)+ 2H2(g) CH3OH(g) 起始量/mol 0.1 0.2 0 转化量/mol x 2x x 平衡量/mol 0.1-x 0.2-2x x

则CH,0H的体积分数为01x+2.2x+xI006-=50%,解得x0.075,故P点C0的转 化率为075m0x100%=75%.C项正确。在P,点,向容器②中再充入C0、H2及 0.1mol CH30H各0.025mol,此时,容器②中n(C0)=0.05mol、nH2)=0.075mol、 0.075 n(CH3OH)=O.1mol,设容器②的容积为VL,则达到平衡时K= =12002, 'x) 充入气体后Q= z≈355.62v是 9x(5 (CO),D项错误。 15.为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两同学分别设计了如 图1、图2所示的实验。下列叙述中不正确的是( ①5滴0.1mol·L1 ②5滴0.1mol·L FeCla(aq) CuSOa(aq) 2mL5% H2O2(aq) 图1 H 图2 A.图1实验可通过定性观察产生气泡的快慢来比较反应速率的大小 B.若图1所示实验中反应速率为①>②,则一定说明F3+对H2O2分解催化效果比 Cu2+好 C.用图2装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时 间 D.为检查图2装置的气密性,可关闭分液漏斗的活塞,将注射器活塞拉出一定距离 到某处,一段时间后松开活塞,观察活塞是否回到原位 答案B
则 CH3OH 的体积分数为 𝑥 0.1-𝑥+0.2-2𝑥+𝑥 ×100%=50%,解得 x=0.075,故 P 点 CO 的转 化率为0.075mol 0.1mol ×100%=75%,C 项正确。在 P 点,向容器②中再充入 CO、H2 及 CH3OH 各 0.025 mol,此时,容器②中 n(CO)=0.05 mol、n(H2)=0.075 mol、 n(CH3OH)=0.1 mol,设容器②的容积为 V L,则达到平衡时 K= 0.075 𝑉 0.025 𝑉 ×( 0.05 𝑉 ) 2=1 200V 2 , 充入气体后 Q= 0.1 𝑉 0.05 𝑉 ×( 0.075 𝑉 ) 2≈355.6V 2v 逆 (CO),D 项错误。 15.为比较 Fe3+和 Cu2+对 H2O2分解反应的催化效果,甲、乙两同学分别设计了如 图 1、图 2 所示的实验。下列叙述中不正确的是( )。 图 1 图 2 A.图 1 实验可通过定性观察产生气泡的快慢来比较反应速率的大小 B.若图 1 所示实验中反应速率为①>②,则一定说明 Fe3+对 H2O2 分解催化效果比 Cu2+好 C.用图 2 装置比较反应速率,可测定在相同状况下反应产生的气体体积及反应时 间 D.为检查图 2 装置的气密性,可关闭分液漏斗的活塞,将注射器活塞拉出一定距离 到某处,一段时间后松开活塞,观察活塞是否回到原位 答案:B

解析B项,若比较F3+和Cu+对H2O2分解的催化作用,应选用阴离子相同的盐溶 液,如Fe2(SO4)3溶液和CuSO4溶液。如果选用FeC3溶液和CuSO4溶液,加入 FCl3溶液产生气泡快,可能是C的催化作用。D项,检查图2装置的气密性,最后 活塞回到原位置,说明装置气密性良好,若仍留在某处,说明装置漏气。 二、非选择题(本题共5小题,共55分) 16.(7分)试回答下列与环境有关的问题。 c(Co)/(mol·L') 2.0 0.4 0.1 1719 图1 (1)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g+2CO(g) 催化剂 加热2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的CO和NO,在不 同温度(T)下发生上述反应时,c(CO)随时间()的变化曲线如图1所示 ①该反应的正反应为 (填“放热”或吸热”)反应。 ②温度为T2时,反应达到平衡时NO的转化率为 ③温度为T1时,该反应的平衡常数K= (2)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催 化还原法(SCR)脱硝技术。若用NH3作还原剂,则主要反应可表示为 4NH3(g+4NO(g+O2(g,一4N2(g+6H2O(g)△H<0,其中体系温度对SNCR技术 脱硝效率的影响如图2所示: 脱硝效率 080090010001100温度/℃ 图2 ①SNCR技术脱硝的最佳温度为 ,SNCR与SCR技术相比,SCR技术的 反应温度不能太高,其原因是 ②由题给信息分析,当体系温度过高时,SNCR技术脱硝效率降低,其可能的原因 是 答案:(1)①放热②95%③80 (2)①925℃(920-930℃均正确)温度太高,降低催化剂活性 ②温度过高时,SNCR脱硝技术的主要反应的平衡逆向移动(其他合理答案也可)
解析:B 项,若比较 Fe3+和 Cu2+对 H2O2分解的催化作用,应选用阴离子相同的盐溶 液,如 Fe2(SO4)3 溶液和 CuSO4溶液。如果选用 FeCl3溶液和 CuSO4溶液,加入 FeCl3 溶液产生气泡快,可能是 Cl-的催化作用。D 项,检查图 2 装置的气密性,最后 活塞回到原位置,说明装置气密性良好,若仍留在某处,说明装置漏气。 二、非选择题(本题共 5 小题,共 55 分) 16.(7 分)试回答下列与环境有关的问题。 图 1 (1)在汽车排气系统中安装三元催化转化器,可发生下列反应:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在某恒容密闭容器中通入等物质的量的 CO 和 NO,在不 同温度(T)下发生上述反应时,c(CO)随时间(t)的变化曲线如图 1 所示: ①该反应的正反应为 (填“放热”或“吸热”)反应。 ②温度为 T2 时,反应达到平衡时 NO 的转化率为 。 ③温度为 T1 时,该反应的平衡常数 K= 。 (2)目前烟气脱硝采用的技术有选择性非催化还原法(SNCR)脱硝技术和选择性催 化还原法(SCR)脱硝技术。若用 NH3 作还原剂,则主要反应可表示为 4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g) ΔH<0,其中体系温度对 SNCR 技术 脱硝效率的影响如图 2 所示: 图 2 ①SNCR 技术脱硝的最佳温度为 ,SNCR 与 SCR 技术相比,SCR 技术的 反应温度不能太高,其原因是 。 ②由题给信息分析,当体系温度过高时,SNCR 技术脱硝效率降低,其可能的原因 是 。 答案:(1)①放热 ②95% ③80 (2)①925 ℃(920~930 ℃均正确) 温度太高,降低催化剂活性 ②温度过高时,SNCR 脱硝技术的主要反应的平衡逆向移动(其他合理答案也可)

解析:(1)①根据“先拐先平温度高”可知T>T2,反应达到平衡时,T1条件下C0的浓 度大,即升高温度,平衡逆向移动,故正反应为放热反应。②由化学方程式可知,NO 和CO对应的化学计量数相同,起始时加入的物质的量也相同,故两者的转化率相 同,即转化率为2-0上x100%=95%。③列“三段式”计算: 2 2NO(g)+ 2C0(g)彼化 加热 -2CO2(g)+N2(g) 始态 0 (molL-) 2.0 2.0 0 反应 1.6 1.6 1.6 0.8 (molL-1) 平衡 0.4 0.4 1.6 0.8 (molL-1) 该反应的平衡常数K-C0,)-80。(2①由图像可知,925℃左右SNCR技术 c2(N0)c2(C0) 脱硝效率最高;SCR技术中使用催化剂,若温度太高,会降低催化剂活性。②SNCR 脱硝技术的主要反应是放热反应,故温度过高时,该反应的平衡逆向移动,导致脱 硝效率降低。 17.(10分)一定温度下,向一容积为5L的恒容密闭容器中充入0.4molS02和0.2 mol02,发生反应:2S02(g+02(g,一2S03(g)△H=-196 kJ-mol-!。当反应达到平 衡时,容器内压强变为起始时的品。请回答下列问题。 ()判断该反应达到平衡状态的标志是 A.SO2、O2、S03三者的浓度之比为2:1:2 B.容器内气体的压强不变 C.容器内混合气体的密度保持不变 D.SO3的物质的量不再变化 E.SO2的生成速率和SO3的生成速率相等 (2)①S02的转化率为 ②达到平衡时反应放出的热量为 ③此温度下该反应的平衡常数K= (3)如图表示平衡时SO2的体积分数随压强和温度变化的曲线。 ↑S0的体积分数 0 ①温度关系:T1 (填><”或=”,下同)T2;
解析:(1)①根据“先拐先平温度高”可知 T1>T2,反应达到平衡时,T1 条件下 CO 的浓 度大,即升高温度,平衡逆向移动,故正反应为放热反应。②由化学方程式可知,NO 和 CO 对应的化学计量数相同,起始时加入的物质的量也相同,故两者的转化率相 同,即转化率为2-0.1 2 ×100%=95%。③列“三段式”计算: 2NO(g)+ 2CO(g) 2CO2(g)+N2(g) 始态 (mol·L -1) 2.0 2.0 0 0 反应 (mol·L -1) 1.6 1.6 1.6 0.8 平衡 (mol·L -1) 0.4 0.4 1.6 0.8 该反应的平衡常数 K= 𝑐 2 (CO2 )·𝑐(N2 ) 𝑐 2(NO)·𝑐 2 (CO) =80。(2)①由图像可知,925 ℃左右 SNCR 技术 脱硝效率最高;SCR 技术中使用催化剂,若温度太高,会降低催化剂活性。②SNCR 脱硝技术的主要反应是放热反应,故温度过高时,该反应的平衡逆向移动,导致脱 硝效率降低。 17.(10 分)一定温度下,向一容积为 5 L 的恒容密闭容器中充入 0.4 mol SO2 和 0.2 mol O2,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH=-196 kJ·mol-1。当反应达到平 衡时,容器内压强变为起始时的 7 10。请回答下列问题。 (1)判断该反应达到平衡状态的标志是 。 A.SO2、O2、SO3三者的浓度之比为 2∶1∶2 B.容器内气体的压强不变 C.容器内混合气体的密度保持不变 D.SO3 的物质的量不再变化 E.SO2 的生成速率和 SO3 的生成速率相等 (2)①SO2 的转化率为 ; ②达到平衡时反应放出的热量为 ; ③此温度下该反应的平衡常数 K= 。 (3)如图表示平衡时 SO2 的体积分数随压强和温度变化的曲线。 ①温度关系:T1 (填“>”“<”或“=”,下同)T2;