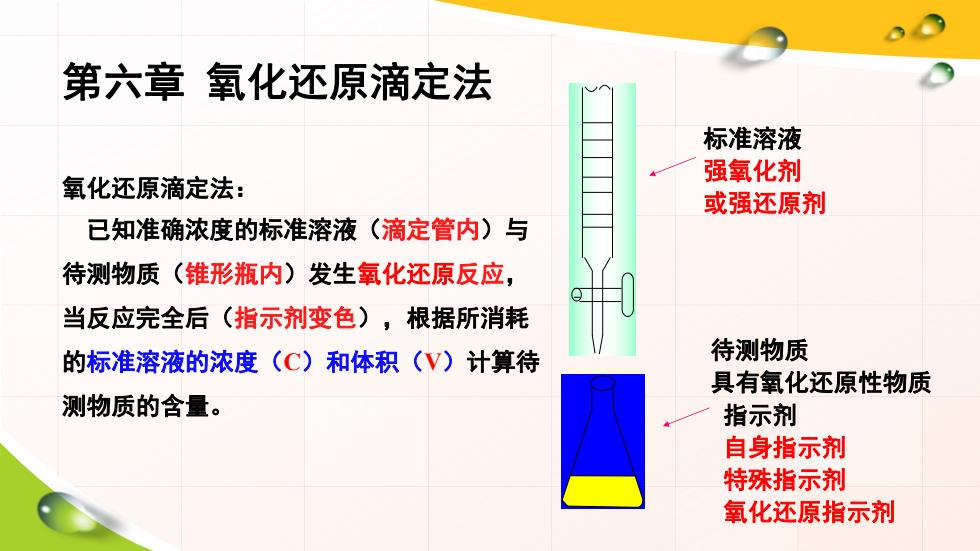
第六章氧化还原滴定法 标准溶液 强氧化剂 氧化还原滴定法: 或强还原剂 已知准确浓度的标准溶液(滴定管内)与 待测物质(锥形瓶内)发生氧化还原反应, 当反应完全后(指示剂变色),根据所消耗 的标准溶液的浓度(C)和体积(V)计算待 待测物质 具有氧化还原性物质 测物质的含量。 指示剂 自身指示剂 特殊指示剂 氧化还原指示剂
第六章 氧化还原滴定法 氧化还原滴定法: 已知准确浓度的标准溶液(滴定管内)与 待测物质(锥形瓶内)发生氧化还原反应, 当反应完全后(指示剂变色),根据所消耗 的标准溶液的浓度(C)和体积(V)计算待 测物质的含量。 标准溶液 强氧化剂 或强还原剂 待测物质 具有氧化还原性物质 指示剂 自身指示剂 特殊指示剂 氧化还原指示剂

長为理2大举 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOGY 第一节 氧化还原平衡 是不是所有氧化性和还原性物 翻转课堂问题一: 质都能够发生氧化还原反应? 半反应;电对;电极电 位;能斯特方程
翻转课堂问题一: 是不是所有氧化性和还原性物 质都能够发生氧化还原反应? 第一节 氧化还原平衡 半反应;电对;电极电 位;能斯特方程

能斯特公式 Mn++ne→M p=p0+ RT In dM" R:8.314J.K-1.mol1 nF P=p0+ 0.059 T:热力学温度 n lg a M+ F:96487C.mol Ox+ne-→Red p=p0+ 0.059 ao n aR 半反应:氧化反应;还原反应形式 电对:MtM;Ox/Red 电极电位:pMM,POx/Red 能斯特方程: 0 集功理3大年 CHANGSHA UNIVERSTY OF SCENCE TECHNOLOGY
能斯特公式 1 0 lg 0.059 Re lg 0.059 ln R x M M n a a n O ne d n nF RT M ne M n n R:8.314J.K-1 .mol -1 T:热力学温度 F:96487C.mol 半反应:氧化反应;还原反应形式 电对:M+/M;Ox/Red 电极电位:M + /M;Ox/Red 能斯特方程:

能斯特和哈伯截然不同的人生: 科研工作者 1920年 诺贝尔化学奖 需要树立正 确的人生观 能斯特 能斯特提出举办索尔维会议 和价值观, 1918年 否则可能成 诺贝尔化学奖 为迫害人类 的武器。 哈伯 哈伯指导德军士兵使用毒气弹
能斯特 能斯特提出举办索尔维会议 哈伯 哈伯指导德军士兵使用毒气弹 1918年 诺贝尔化学奖 1920年 诺贝尔化学奖 能斯特和哈伯截然不同的人生: 科研工作者 需要树立正 确的人生观 和价值观, 否则可能成 为迫害人类 的武器

最为理3大举 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOGY 翻转课堂问题二: 为什么要引入条件电极电位? 它和标准电极电位有什么不同?
翻转课堂问题二: 为什么要引入条件电极电位? 它和标准电极电位有什么不同?

条件电极电位 Fe3t+e台Fe2 条件电位的大小反映了在外界因素影响下, 90.059 氧化还原电对的实际氧化还原能力,反应了离 φ=φ°+ a2+ 子强度与各种副反应的结果。 p=00.0598 C边 查表:先查条件电极电位,437页 查不到,再查标准电极电位;434页 最为理夕大举 CHANGSHA UNIVERSITY OF CENCE TECHNOLOG
条件电极电位 lg 1 0.059 2 3 Fe Fe 3 Û 2 Fe e Fe a a 2 3 ' 0.059lg Fe Fe C C 条件电位的大小反映了在外界因素影响下, 氧化 还原电对的实际氧化还原能力,反应了离 子强度与各种副反应的结果。 查表:先查条件电极电位,437页 查不到,再查标准电极电位;434页

泉为理卫大学 CHANGSHA UNIVERSITY OF SCIENCE TECHNOLOGY 翻转课堂问题三: 氧化还原反应进行的完全 程度和什么有关? 平衡常数K;条件平衡常数K, 配位滴定法:K稳:K稳 酸碱滴定法:Ka;Kb;Kw
翻转课堂问题三: 氧化还原反应进行的完全 程度和什么有关? 平衡常数K;条件平衡常数K’ 配位滴定法:K稳;K稳 ’ 酸碱滴定法:Ka;Kb;Kw

第二节 氧化还原反应进行的程度 条件平衡常数K? 6 K?= aOx,+bRed,aRed+bOx2 b =( COx CRedz Ox+nje=Red Ox2 n2 e=Red2 0.059, 01=p1+ n 02=pg+0.059 n2 设n为两电对电子转移数 n n1= n2= n1、n2的最小公倍数,得到: a b 得失电子数应相等! 最为理3大举 CHANGSHA UNIVERSITY OF CENCE TECHNOLOG
条件平衡常数K’ aOx1 +bRed2 = aRed1 + bOx2 b d a Ox b Ox a d c c c c 1 2 1 2 Re Re b d a Ox Ox d c c c c ( ) ( ) 2 2 1 1 Re Re K’ = = Ox1 + n1e = Red1 1 0' 1 1 1 1 Re lg 0.059 d Ox c c n = + Ox2 + n2 e = Red2 2 0' 2 2 2 2 Re lg 0.059 d Ox c c n = + 设n为两电对电子转移数 n1、n2的最小公倍数,得到: a n n1 b n n2 得失电子数应相等! 第二节 氧化还原反应进行的程度

反应平衡(化学计量点)时: aOx +bRed,aRed+bOx2 p1=P2 。,0.g二三0。 n n2 整理,得: 1gK'=2”-28n 或 (2-09)n 0.059 lgK= 0.059 沙理3大舞
反应平衡(化学计量点)时: 1 = 2 0' 1 1 1 1 Re lg 0.059 d Ox c c n + = 2 2 2 Re lg 0.059 d Ox c c n 0' 2 + 整理,得: 0.059 ( ) 0' 2 0' 1 n lgK’ = 0.059 ( ) 0 2 0 1 n 或 lgK= aOx1 +bRed2 = aRed1 + bOx2

氧化还原反应进行的程度可以用平衡常数K来衡量。 其与有关电对的标准电极电位有关。 1、公式 logK'=np°-p) 0.059V 某一氧化还原反应,为定值,两电对的条件电位之差 愈大,K愈大,反应进行的越完全。 2、滴定分析的判据:对于n1=n2=1的反应,则 为什么? logK>6 沙理2大舜 CHANGSHA UNIVERSTY OF SCIENCE TECHNOLOG
氧化还原反应进行的程度可以用平衡常数K来衡量。 其与有关电对的标准电极电位有关。 1、公式 某一氧化还原反应,n为定值,两电对的条件电位之差 愈大,K 愈大,反应进行的越完全。 2、滴定分析的判据:对于n1 =n2=1的反应,则 logK≥6 V n K 0.059 ( ) log ' ' 2 ' 1 为什么?