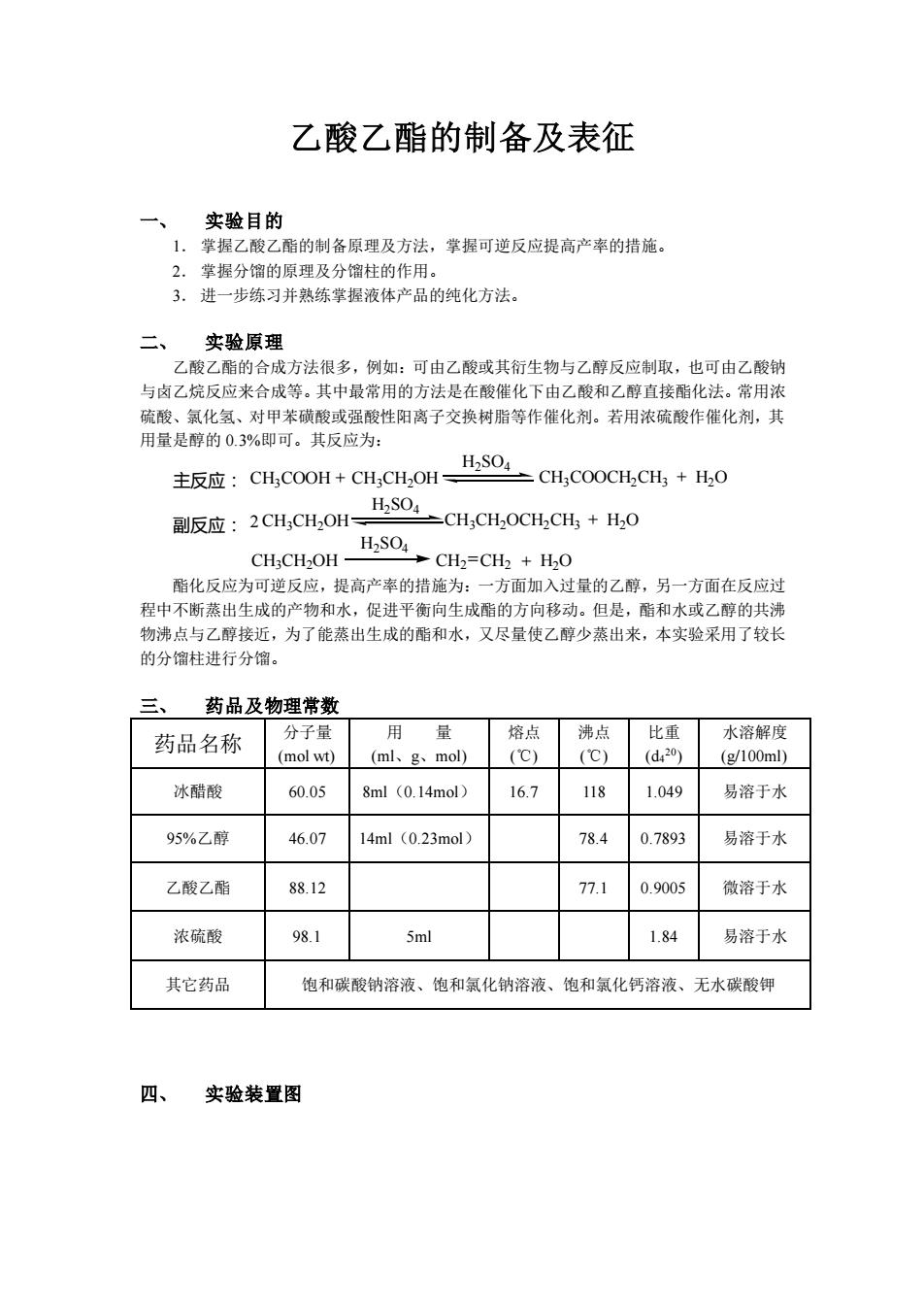
乙酸乙酯的制备及表征 一、 实验目的 1.掌握乙酸乙酯的制备原理及方法,掌握可逆反应提高产率的措施。 2.掌提分馏的原理及分馏柱的作用。 3.进一步练习并熟练掌握液体产品的纯化方法 二、 实验原理 乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物与乙醇反应制取,也可由乙酸钠 与卤乙烷反应来合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用浓 主扳应:CHc0oH+CH,CH,OHHs0CH,COOCH.CH,+H,0 版应:2aHCL0Hs0CHGH000H+H0 CHCH2OH- 酯化反应为可逆反应,提高产率的措施为:一方面加入过量的乙醇,另一方面在反应过 程中不断蒸出生成的产物和水,促进平衡向生成酯的方向移动。但是,酯和水或乙醇的共沸 物沸点与乙醇接近,为了能蒸出生成的酯和水,又尽量使乙醇少蒸出来,本实验采用了较长 的分偏柱进行分馏。 三、 药品及物理常数 药品名称 分于量 用量 熔点沸点比重 水溶解度 (mol wt) (ml、g、mol) (C) (℃) (d20)(g100ml) 冰醋酸 60.05 8ml (0.14mol) 167 118 1.049 易溶于水 95%乙醇 46.07 14ml(0.23mol) 78.4 0.7893 易溶于水 乙酸乙酯 88.12 77.1 0.9005 微溶于水 浓硫酸 98.1 5ml 1.84 易溶于水 其它药品 饱和碳酸钠溶液、饱和氯化钠溶液、饱和氯化钙溶液、无水碳酸钾 四、 实验装置图
乙酸乙酯的制备及表征 一、 实验目的 1. 掌握乙酸乙酯的制备原理及方法,掌握可逆反应提高产率的措施。 2. 掌握分馏的原理及分馏柱的作用。 3. 进一步练习并熟练掌握液体产品的纯化方法。 二、 实验原理 乙酸乙酯的合成方法很多,例如:可由乙酸或其衍生物与乙醇反应制取,也可由乙酸钠 与卤乙烷反应来合成等。其中最常用的方法是在酸催化下由乙酸和乙醇直接酯化法。常用浓 硫酸、氯化氢、对甲苯磺酸或强酸性阳离子交换树脂等作催化剂。若用浓硫酸作催化剂,其 用量是醇的 0.3%即可。其反应为: CH3COOH + CH3CH2OH H2SO4 CH3COOCH2CH3 + H2O 2CH3CH2OH H2SO4 CH3CH2OCH2CH3 + H2O CH3CH2OH H2SO4 CH2 CH2 + H2O 主反应: 副反应: 酯化反应为可逆反应,提高产率的措施为:一方面加入过量的乙醇,另一方面在反应过 程中不断蒸出生成的产物和水,促进平衡向生成酯的方向移动。但是,酯和水或乙醇的共沸 物沸点与乙醇接近,为了能蒸出生成的酯和水,又尽量使乙醇少蒸出来,本实验采用了较长 的分馏柱进行分馏。 三、 药品及物理常数 药品名称 分子量 (mol wt) 用 量 (ml、g、mol) 熔点 (℃) 沸点 (℃) 比重 (d4 20) 水溶解度 (g/100ml) 冰醋酸 60.05 8ml(0.14mol) 16.7 118 1.049 易溶于水 95%乙醇 46.07 14ml(0.23mol) 78.4 0.7893 易溶于水 乙酸乙酯 88.12 77.1 0.9005 微溶于水 浓硫酸 98.1 5ml 1.84 易溶于水 其它药品 饱和碳酸钠溶液、饱和氯化钠溶液、饱和氯化钙溶液、无水碳酸钾 四、 实验装置图

6直形冷凝管 蒸馏装置 五、实验流程图 约6ml饱和碳酸钠 國一翻一网一圈一墨 0-125 一图一超一” 六、实验步骤 在1O0ml三颈瓶中,加入4ml乙醇,摇动下慢慢加入5ml浓硫酸,使其混合均匀,并 加入几粒沸石。三颈瓶一侧口插入温度计,另一侧口插入滴液漏斗,漏斗末端应浸入液面以 下,中间口安一长的刺形分馏柱(整个装置如上图)。 仪器装好后,在滴液漏斗内加入10ml乙醇和8ml冰醋酸,混合均匀,先向瓶内滴入约 2ml的混合液,然后,将三颈瓶在石棉网上小火加热到110一120℃左右,这时蒸馏管口应有 液体流出,再自滴液漏斗慢慢滴入其余的混合液,控制滴加速度和馏出速度大致相等,并维 持反应温度在110-125℃之间,滴加完毕后,继续加热10分钟,直至温度升高到130℃不 再有馏出液为止 馏出液中含有乙酸乙酯及少量乙醇、乙醚、水和酷酸等,在摇动下,慢慢向粗产品中加 入饱和的碳酸钠溶液(约6m)至无二氧化碳气体放出,酯层用PH试纸检验呈中性。移入 分液漏斗中,充分振摇(注意及时放气:)后静置,分去下层水相。酯层用10ml饱和食盐 水洗涤后,再每次用10ml饱和氯化钙溶液洗涤两次,弃去下层水相,酯层自漏斗上口倒入
直形冷凝管 接引管 锥形瓶 温度计 刺 形 分 馏 柱 温 度 计 滴 液 漏 斗 三口瓶 蒸 馏 瓶 蒸 馏 头 温 度 计 直形冷凝管 接引管 接收瓶 蒸馏装置 五、 实验流程图 ℃ 4ml乙醇 5ml浓硫酸 2粒沸石 三口瓶 中混合 均匀 边滴加 边蒸出 粗产品 分离 10ml饱 和食盐 水洗涤 10ml饱 和氯化 钙洗涤 干燥仪 器蒸馏 10ml乙醇 8ml醋酸 分液漏 斗中混 合均匀 粗产品 110-125 中和至 中性 约6ml饱和碳酸钠 2次 无水 碳酸钾 干燥 收集73-80 的馏分, 称重,计算产率。 ℃ 六、 实验步骤 在 100ml 三颈瓶中,加入 4ml 乙醇,摇动下慢慢加入 5ml 浓硫酸,使其混合均匀,并 加入几粒沸石。三颈瓶一侧口插入温度计,另一侧口插入滴液漏斗,漏斗末端应浸入液面以 下,中间口安一长的刺形分馏柱(整个装置如上图)。 仪器装好后,在滴液漏斗内加入 10ml 乙醇和 8ml 冰醋酸,混合均匀,先向瓶内滴入约 2ml 的混合液,然后,将三颈瓶在石棉网上小火加热到 110-120℃左右,这时蒸馏管口应有 液体流出,再自滴液漏斗慢慢滴入其余的混合液,控制滴加速度和馏出速度大致相等,并维 持反应温度在 110-125℃之间,滴加完毕后,继续加热 10 分钟,直至温度升高到 130℃不 再有馏出液为止。 馏出液中含有乙酸乙酯及少量乙醇、乙醚、水和醋酸等,在摇动下,慢慢向粗产品中加 入饱和的碳酸钠溶液(约 6ml)至无二氧化碳气体放出,酯层用 PH 试纸检验呈中性。移入 分液漏斗中,充分振摇(注意及时放气!)后静置,分去下层水相。酯层用 10ml 饱和食盐 水洗涤后,再每次用 10ml 饱和氯化钙溶液洗涤两次,弃去下层水相,酯层自漏斗上口倒入

干燥的锥形瓶中,用无水碳酸钾干燥。 将干燥好的粗乙酸乙酯小心倾入60ml的梨形蒸馏瓶中(不要让干燥剂进入瓶中),加 入沸石后在水浴上进行蒸馏 ,收集73-80℃的馏分。产品5-8g。 七、 操作要点及说 1、本实验一方面加入过量乙醇,另一方面在反应过程中不断蒸出产物,促进平衡向生 成酯的方向移动。乙酸乙酯和水、乙醇形成二元或三元共沸混合物,共沸点都比原料的沸点 低,故可在反应过程中不断将其蒸出。这些共沸物的组成和沸点如下: 比物组成 (1)乙酸乙酯91.9%,水8.1% (2)乙酸乙酯69.0%,乙醇31.0% 71.8℃ (3)乙酸乙酯82.6%,乙醇8.4%,水9.0%70.2℃ 最低共沸物是三元共沸物,其共沸点为70.2℃,二元共沸物的共沸点为70,4℃和71.8℃,三 者很接近。蒸出米的可能是二元组成和三元组成的混合物。加过量48%的乙醇,一方面使 乙酸转化率提 方面可使 物乙酸乙酯大部分蒸 或全部 出反应体系,进一步促进 乙酸的转化,即在保证产物以共沸物蒸出时,反应瓶中,仍然是乙醇过量。 2、本实验的关键问题是控制酯化反应的温度和滴加速度。控制反应温度在120℃左右。 温度过低,酯化反应不完全:温度过高(>140℃),易发生醇脱水和氧化等副反应: ,CH.OCH.CH,+HO CHCH2OH O CH,CHO HSOCH.COOH 故要严格控制反应温度。 要正确控制滴加速度,滴加速度过快,会使大量乙醇来不及发生反应而被蒸出,同时也 造成反应混合物温度下降,导致反应速度减慢,从而影响产率:滴加速度过慢,又会浪费时 间,影响实验进程。 3、用饱和氯化溶液洗涤之前,要用饱和氯化钠溶液洗涤, 不可用水代替饱和氯化钠 液。粗制乙酸乙酯用饱和碳酸钠溶液洗涤之后,酯层中残留少量碳酸钠,若立即用饱和氯化 钙溶液洗涤会生成不溶性碳酸钙,往往呈絮状物存在于溶液中,使分液漏斗堵塞,所以在用 饱和氯化钙溶液洗涤之前,必须用饱和氯化钠溶液洗涤,以便除去残留的碳酸钠。乙酸乙酯 在水中的溶解度较大,15℃时100g水中能溶解85,若用水洗涤,必然会有 一定量的酯落 解在水中而适成损失。此外,乙酸 的相对密度 0.9005)与水接近 在水洗后很难立即 分层。因此,用水洗涤是不可取的。饱和氯化钠溶液既具有不的性质,义具有盐的性质, 方面它能溶解碳酸钠,从而将其双酯中除去:另一方面它对有机物起盐析作用,使乙酸乙酯 在水中的溶解度大降低。除此之外,饱和氯化钠溶液的相对密度较大,在洗涤之后,静置便 可分离。因此,用饱和氯化钠溶液洗涤既可减少酯的损失,又可缩短洗涤时间。 4。注音事而 (1) 加料滴管和温度计必须插入反应混合液中,加料滴管的下端离瓶底约5mm为宜。 (2)加浓硫酸时,必须慢慢加入并充分振荡烧瓶,使其与乙醇均匀混合,以免在加热时 因局部酸过浓引起有机物碳化等副反应。 (3)反应瓶里的反应温度可用滴加速度米控制。温度接近125℃,适当滴加快点:温度 落到接近110℃,可滴加慢点:落到110℃停止滴加:待温度升到110℃以上时,再 (4)本实验酯的干燥用无水碳酸钾,通常只少干燥半个小时以上,最好放置过夜。但在 本实验中,为了节省时间,可放置10分钟左右。由于干燥不完全,可能前馏分多些。 八、 教学方法
干燥的锥形瓶中,用无水碳酸钾干燥。 将干燥好的粗乙酸乙酯小心倾入 60ml 的梨形蒸馏瓶中(不要让干燥剂进入瓶中),加 入沸石后在水浴上进行蒸馏,收集 73-80℃的馏分。产品 5-8g。 七、 操作要点及说明 1、本实验一方面加入过量乙醇,另一方面在反应过程中不断蒸出产物,促进平衡向生 成酯的方向移动。乙酸乙酯和水、乙醇形成二元或三元共沸混合物,共沸点都比原料的沸点 低,故可在反应过程中不断将其蒸出。这些共沸物的组成和沸点如下: 共沸物组成 共沸点 (1)乙酸乙酯 91.9%,水 8.1% 70.4℃ (2)乙酸乙酯 69.0%,乙醇 31.0% 71.8℃ (3)乙酸乙酯 82.6%,乙醇 8.4%,水 9.0% 70.2℃ 最低共沸物是三元共沸物,其共沸点为 70.2℃,二元共沸物的共沸点为 70.4℃和 71.8℃,三 者很接近。蒸出来的可能是二元组成和三元组成的混合物。加过量 48%的乙醇,一方面使 乙酸转化率提高,另一方面可使产物乙酸乙酯大部分蒸出或全部蒸出反应体系,进一步促进 乙酸的转化,即在保证产物以共沸物蒸出时,反应瓶中,仍然是乙醇过量。 2、本实验的关键问题是控制酯化反应的温度和滴加速度。控制反应温度在 120℃左右。 温度过低,酯化反应不完全;温度过高(>140℃),易发生醇脱水和氧化等副反应: 2 CH3CH2OH H2SO4 CH3CH2OCH2CH3 + H2O CH3CH2OH H2SO4 CH3CHO H2SO4 CH3COOH 故要严格控制反应温度。 要正确控制滴加速度,滴加速度过快,会使大量乙醇来不及发生反应而被蒸出,同时也 造成反应混合物温度下降,导致反应速度减慢,从而影响产率;滴加速度过慢,又会浪费时 间,影响实验进程。 3、用饱和氯化溶液洗涤之前,要用饱和氯化钠溶液洗涤,不可用水代替饱和氯化钠溶 液。粗制乙酸乙酯用饱和碳酸钠溶液洗涤之后,酯层中残留少量碳酸钠,若立即用饱和氯化 钙溶液洗涤会生成不溶性碳酸钙,往往呈絮状物存在于溶液中,使分液漏斗堵塞,所以在用 饱和氯化钙溶液洗涤之前,必须用饱和氯化钠溶液洗涤,以便除去残留的碳酸钠。乙酸乙酯 在水中的溶解度较大,15℃时 100g 水中能溶解 8.5g,若用水洗涤,必然会有一定量的酯溶 解在水中而造成损失。此外,乙酸乙酯的相对密度(0.9005)与水接近,在水洗后很难立即 分层。因此,用水洗涤是不可取的。饱和氯化钠溶液既具有不的性质,又具有盐的性质,一 方面它能溶解碳酸钠,从而将其双酯中除去;另一方面它对有机物起盐析作用,使乙酸乙酯 在水中的溶解度大降低。除此之外,饱和氯化钠溶液的相对密度较大,在洗涤之后,静置便 可分离。因此,用饱和氯化钠溶液洗涤既可减少酯的损失,又可缩短洗涤时间。 4、注意事项 (1) 加料滴管和温度计必须插入反应混合液中,加料滴管的下端离瓶底约 5mm 为宜。 (2) 加浓硫酸时,必须慢慢加入并充分振荡烧瓶,使其与乙醇均匀混合,以免在加热时 因局部酸过浓引起有机物碳化等副反应。 (3) 反应瓶里的反应温度可用滴加速度来控制。温度接近 125℃,适当滴加快点;温度 落到接近 110℃,可滴加慢点;落到 110℃停止滴加;待温度升到 110℃以上时,再 滴加。 (4) 本实验酯的干燥用无水碳酸钾,通常只少干燥半个小时以上,最好放置过夜。但在 本实验中,为了节省时间,可放置 10 分钟左右。由于干燥不完全,可能前馏分多些。 八、 教学方法

1、合成乙酸乙酯的反应是典型的可逆平衡反应,本实验应重点分析、总结提高可逆平衡反 (1)为什么使用过量的乙醇? (2)蒸出的粗乙酸乙酯中主要含有哪些杂质?如何逐一除去? (3)能否用浓的氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸馏液?为什么? (4)用饱和氯化钙溶液洗涤的目的是什么?为什么先用饱和氯化钠溶液洗涤?是否可用 水代替?
1、合成乙酸乙酯的反应是典型的可逆平衡反应,本实验应重点分析、总结提高可逆平衡反 应产率的实验方法。 2、组织讨论以下问题: (1) 为什么使用过量的乙醇? (2) 蒸出的粗乙酸乙酯中主要含有哪些杂质?如何逐一除去? (3) 能否用浓的氢氧化钠溶液代替饱和碳酸钠溶液来洗涤蒸馏液?为什么? (4) 用饱和氯化钙溶液洗涤的目的是什么?为什么先用饱和氯化钠溶液洗涤?是否可用 水代替?