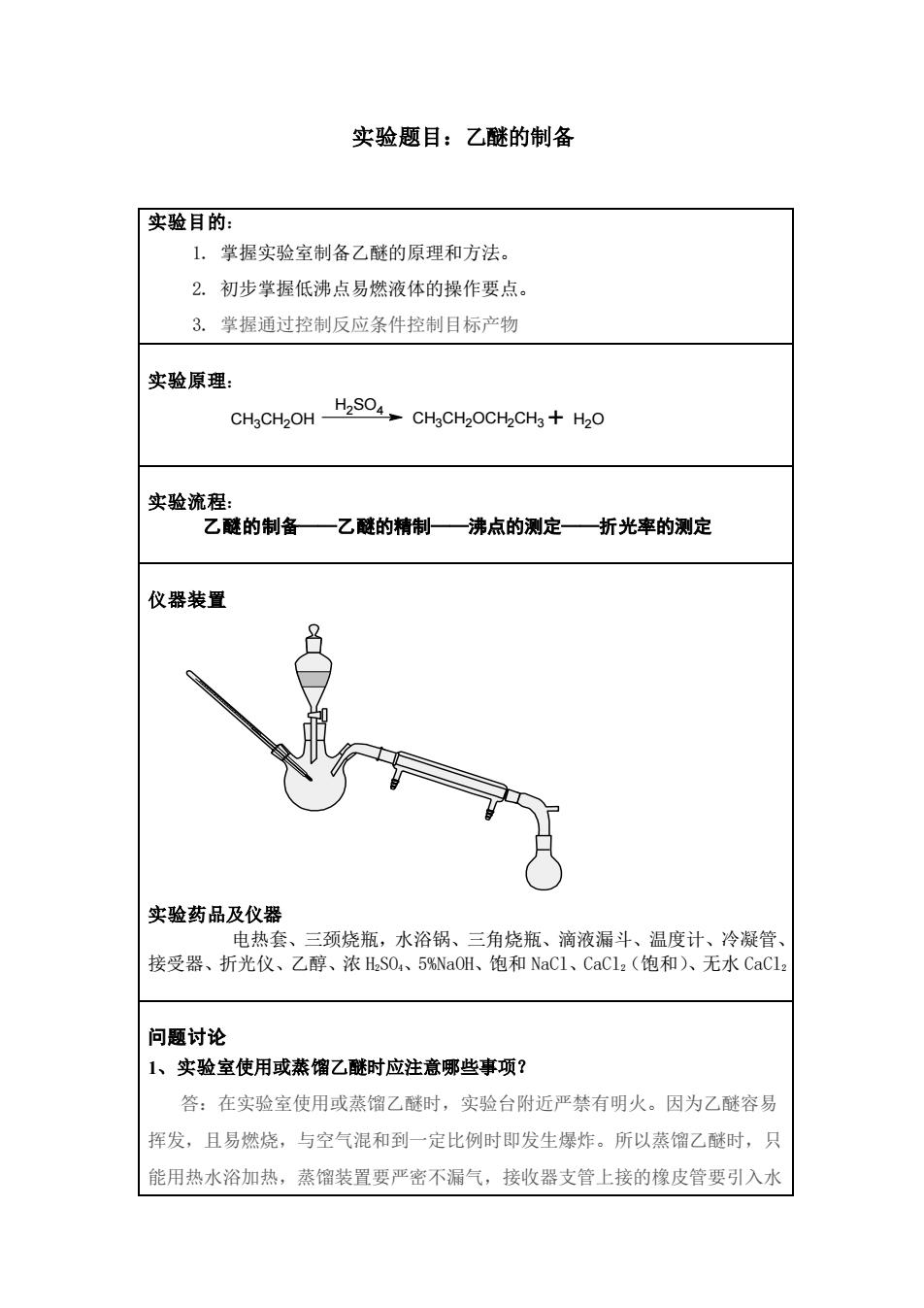
实验题目:乙醚的制备 实验目的: 1.学握实验室制备乙醚的原理和方法。 2.初步掌握低沸点易燃液体的操作要点。 3.掌握通过控制反应条件控制目标产物 实验原理: 实验流程: 乙醚的制备——乙醚的精制—沸点的测定—折光率的测定 仪器装置 实验药品及仪器 电热套 、三颈烧瓶,水浴锅、三角烧瓶、滴液漏斗、温度计、冷凝管 接受器、折光仪、乙醇、浓HSO、5%NaOH、饱和NaC1、CaCl:(饱和)、无水CaCl 问题讨论 1、实验室使用或蒸馏乙醚时应注意哪些事项? 答:在实验室使用或蒸馏乙醚时,实验台附近严禁有明火。因为乙醚容易 挥发,且易燃烧,与空气混和到一定比例时即发生爆炸。所以蒸馏乙醚时,只 能用热水浴加热,蒸馏装置要严密不漏气,接收器支管上接的橡皮管要引入水
实验题目:乙醚的制备 实验目的: 1. 掌握实验室制备乙醚的原理和方法。 2. 初步掌握低沸点易燃液体的操作要点。 3. 掌握通过控制反应条件控制目标产物 实验原理: CH3CH2OH H2SO4 CH3CH2OCH2CH3+ H2O 实验流程: 乙醚的制备——乙醚的精制——沸点的测定——折光率的测定 仪器装置 实验药品及仪器 电热套、三颈烧瓶,水浴锅、三角烧瓶、滴液漏斗、温度计、冷凝管、 接受器、折光仪、乙醇、浓 H2SO4、5%NaOH、饱和 NaCl、CaCl2(饱和)、无水 CaCl2 问题讨论 1、实验室使用或蒸馏乙醚时应注意哪些事项? 答:在实验室使用或蒸馏乙醚时,实验台附近严禁有明火。因为乙醚容易 挥发,且易燃烧,与空气混和到一定比例时即发生爆炸。所以蒸馏乙醚时,只 能用热水浴加热,蒸馏装置要严密不漏气,接收器支管上接的橡皮管要引入水

槽或室外,且接收器外要用冰水冷却。 另外,蒸馏保存时间较久的乙醚时,应事先检验是否含过氧化合物。因为 乙醚在保存期间与空气接触和受光照射的影响可能产生二乙基过氧化物 (C2H5OOC2H5),过氧化物受热容易发生爆炸。 检验方法:取少量乙醚,加等体积的2%K1溶液,再加几滴稀盐酸振摇, 振摇后的溶液若能使淀粉显蓝色,则表明有过氧化合物存在。 除去过氧化合物的方法:在分液漏斗中加入乙醚含过氧化物),加入相当乙 醚体积1/5的新配制的硫酸亚铁溶液(55ml水中加3ml浓硫酸,再加30g硫酸亚 铁),剧烈振动后分去水层即可。 2、在制备乙醚时,滴液漏斗的下端若不浸入反应液液面以下会有什么影响? 答:滴液漏斗的下端应浸入反应液液面以下,若在液面上面,则滴入的乙 醇易受热被蒸出,无法参与反应,造成产率低、杂质多。如果滴液漏斗下端较 短而不能浸入反应液液面以下,应在其下端用一小段橡皮管接一段玻璃上去。 但要注意,橡皮管不要接触到反应液,以免反应液中的浓硫酸腐蚀橡皮管。 3、制备乙醚时,为何要控制滴加乙醇的速度?怎样的滴加速度才比较合适? 答:制乙醚时,反应液加热到130-140C时,产生乙醚。此时再滴加乙醇 乙醇将继续与硫酸氢乙酯作用生成乙醚。若此时滴加乙醇的速度过快,不仅会 降低反应液的温度,而且,滴加的部分乙醇因来不及作用就会被蒸出。若滴加 乙醇的速度过慢,则反应时间会太长,瓶内的乙醇易被热的浓硫酸氧化或碳化 因此,滴加乙醇的速度应控制到能保持与馏出乙醚的速度相等为宜(1滴秒)。 4、在粗制乙醚中有哪些杂质?它们是怎样形成的?实验中采用了哪些措施将它 们各自除去的? 实验中用NaOH溶液除去酸性物质:酷酸和亚硫酸:用饱和氯化钙除去乙 醇:用无水氯化钙干燥除去所剩的少量水和乙醇。 5、在用NaOH溶液洗涤乙醚粗产物之后,用饱和氯化钙水溶液洗涤之前,为 何要用饱和氯化钠水溶液洗涤产品? 答:因为在用NOH水溶液洗涤粗产物之后,必然有少量碱残留在产品乙 醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗
槽或室外,且接收器外要用冰水冷却。 另外,蒸馏保存时间较久的乙醚时,应事先检验是否含过氧化合物。因为 乙醚在保存期间与空气接触和受光照射的影响可能产生二乙基过氧化物 (C2H5OOC2H5),过氧化物受热容易发生爆炸。 检验方法:取少量乙醚,加等体积的2% KI 溶液,再加几滴稀盐酸振摇, 振摇后的溶液若能使淀粉显蓝色,则表明有过氧化合物存在。 除去过氧化合物的方法:在分液漏斗中加入乙醚(含过氧化物),加入相当乙 醚体积1/5的新配制的硫酸亚铁溶液(55 ml 水中加3 ml 浓硫酸,再加30g 硫酸亚 铁),剧烈振动后分去水层即可。 2、在制备乙醚时,滴液漏斗的下端若不浸入反应液液面以下会有什么影响? 答:滴液漏斗的下端应浸入反应液液面以下,若在液面上面,则滴入的乙 醇易受热被蒸出,无法参与反应,造成产率低、杂质多。如果滴液漏斗下端较 短而不能浸入反应液液面以下,应在其下端用一小段橡皮管接一段玻璃上去。 但要注意,橡皮管不要接触到反应液,以免反应液中的浓硫酸腐蚀橡皮管。 3、 制备乙醚时,为何要控制滴加乙醇的速度?怎样的滴加速度才比较合适? 答:制乙醚时,反应液加热到130-140 oC 时,产生乙醚。此时再滴加乙醇, 乙醇将继续与硫酸氢乙酯作用生成乙醚。若此时滴加乙醇的速度过快,不仅会 降低反应液的温度,而且,滴加的部分乙醇因来不及作用就会被蒸出。若滴加 乙醇的速度过慢,则反应时间会太长,瓶内的乙醇易被热的浓硫酸氧化或碳化。 因此,滴加乙醇的速度应控制到能保持与馏出乙醚的速度相等为宜(1滴/秒)。 4、在粗制乙醚中有哪些杂质?它们是怎样形成的?实验中采用了哪些措施将它 们各自除去的? 实验中用 NaOH 溶液除去酸性物质:醋酸和亚硫酸;用饱和氯化钙除去乙 醇;用无水氯化钙干燥除去所剩的少量水和乙醇。 5、 在用 NaOH 溶液洗涤乙醚粗产物之后,用饱和氯化钙水溶液洗涤之前,为 何要用饱和氯化钠水溶液洗涤产品? 答:因为在用 NaOH 水溶液洗涤粗产物之后,必然有少量碱残留在产品乙 醚里,若此时直接用饱和氯化钙水溶液洗,则将有氢氧化钙沉淀产生,影响洗

涤和分离。因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤。 这样,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度。 6、用乙醇和浓疏酸制乙醚时,反应温度过高或过低对反应有何影响?怎样控制 好反应温度? 答:若反应温度过高(大于140C)时,则分子内脱水成乙烯的副反应加快, 从而减少了乙醚的得率。同时浓硫酸氧化乙醇的副反应也加剧,对乙醚的生成 不利。温度过低,乙醚难以形成,而部分乙醇因受热而被蒸出,也将减少乙醚 的产量。同时,乙醚中的乙醇量过多,给后处理将带来麻烦。 正确的控制温度方法是:迅速使反应液温度上升至140℃,控制滴加乙 醇的速度与乙醚蒸馏出的速度大致相等,以维持反应温度在140℃左右。 7、在制备乙醚和蒸馏乙醚时,温度计被装的位置是否相同?为什么? 答:不同。在制备乙醚时,温度计的水银球必须插入反应液的液面以下。 因为此时温度计的作用是测量反应温度:而蒸馏时,温度计的位置是在液面上 即水银球的上部与蒸馏烧瓶的支管下沿平齐,因为此时温度计的作用是测量乙 醚蒸气的温度。 8、若精制后的乙醚沸程仍较长,估计可能是什么杂质未除尽?如何将其完全除 去? 答:若精制后的乙醚沸程仍较长,则说明此乙醚中还含有较少量的 乙醇和水未除干净。它们能与乙醚形成共沸物。为了得到绝对乙醇,可将 此乙醚先用无水氯化钙干燥处理,然后,用金属钠干燥
涤和分离。因此用氢氧化钠水溶液洗涤产品之后应用饱和氯化钠水溶液洗涤。 这样,既可以洗去残留在乙醚中的碱,又可以减少乙醚在水中的溶解度。 6、用乙醇和浓硫酸制乙醚时,反应温度过高或过低对反应有何影响?怎样控制 好反应温度? 答:若反应温度过高(大于140oC)时,则分子内脱水成乙烯的副反应加快, 从而减少了乙醚的得率。同时浓硫酸氧化乙醇的副反应也加剧,对乙醚的生成 不利。温度过低,乙醚难以形成,而部分乙醇因受热而被蒸出,也将减少乙醚 的产量。同时,乙醚中的乙醇量过多,给后处理将带来麻烦。 正确的控制温度方法是:迅速使反应液温度上升至140 0C,控制滴加乙 醇的速度与乙醚蒸馏出的速度大致相等,以维持反应温度在1400C 左右。 7、在制备乙醚和蒸馏乙醚时,温度计被装的位置是否相同?为什么? 答:不同。在制备乙醚时,温度计的水银球必须插入反应液的液面以下。 因为此时温度计的作用是测量反应温度;而蒸馏时,温度计的位置是在液面上 即水银球的上部与蒸馏烧瓶的支管下沿平齐,因为此时温度计的作用是测量乙 醚蒸气的温度。 8、若精制后的乙醚沸程仍较长,估计可能是什么杂质未除尽?如何将其完全除 去? 答:若精制后的乙醚沸程仍较长,则说明此乙醚中还含有较少量的 乙醇和水未除干净。它们能与乙醚形成共沸物。为了得到绝对乙醇,可将 此乙醚先用无水氯化钙干燥处理,然后,用金属钠干燥