
丙酮和水混合液的分馏 一、实验目的 1.了解分馏的原理和意义,蒸馏与分馏的区别,分馏的种类及特点: 2。了解分馏柱的种类和选用方法: 3.掌握实验室里常用分榴的操作方法。 二、基本原理 1.分馏的概念 沸点不同但可互溶的液体混合物,通过在分馏柱中多次的汽化一冷凝,从而使低沸点物 质与高沸点物质得到分离,这个过程称为分馏。简单地说,分馏就是多次的蒸馏。 注:当两种或者三种液体混合物以一定比例混合,可组成具有固定沸点的混合物,将 这种混合物加热至沸脚时,在气液平衡体系中,气相组成和液相组成一样,故不能使用分 馏法将其分高出来,只能得到按一定比例组成的混合物,这种混合物称为共沸混合物。共 沸混合物有固定的组成和沸点,不能通过分馏的方法分离。 2.分馏的原理 混合物中各组分具有不同的蒸气压,加热沸腾产生的蒸气中,低沸点组分的含量较高。 将此蒸气冷凝,则得到低沸点组分含量较多的液体,这就是一次蒸馏。如将得到的液体继续 蒸馏,再度产生的蒸气中所含低沸点的组分含量又将增加。如此多次蒸馏,最终就将沸点不 同的两组分分离。但应用这样反复多次的简单蒸馏,不仅操作繁琐,又浪费时间、能源。因 此,通常采用分馏来进行分离。与简单蒸馏的不同之处是在装置上多一个分馏柱。 当混合物蒸气进入分馏柱中时,因为高沸点组分易被冷凝,所以冷凝液中就含有较多的 高沸点组分,故上升的蒸气中低沸点组分就会进一步相对地增多,通过多次的冷凝,在分馏 柱顶部出来的蒸气就越接近于纯低沸点组分。此外,含较多高沸点组分的冷凝液在分馏柱中 并不是全部直接回流到烧瓶底部,在回流途中,遇到上升的蒸气时,二者之间进行热交换 使冷凝液中低沸点组分再次受热汽化,高沸点仍呈液态回流,越是在分馏柱底部,冷凝液中 高沸点组分的含量就越多,直至回流到烧瓶中。所以,在分馏柱中,混合物通过多次气一液 平衡的热交换产生多次的汽化一冷凝一回流一汽化的过程,最终使沸点相近的两组分得到较 好的分离。 简言之,分馏柱的作用就是使高沸点组分回流,低沸点组分得到蒸馏的仪器装置。分馏 的用途就是分离沸点相近的多组分液体混合物。影响分离效率的因素除混合物的本性外,主 要就在于分馏柱设备装置的精密性以及操作的科学性(回流比)。根据设备条件的不同,分 馏可分为简单分馏和精馏。现在用最精密的分馏设备已能将沸点相差1~2℃的混合物分开。 了解分馏原理最好是应用恒压下的沸点-组成曲线图(称为相图,表示这两组分体系中相
丙酮和水混合液的分馏 一、实验目的 1.了解分馏的原理和意义,蒸馏与分馏的区别,分馏的种类及特点; 2. 了解分馏柱的种类和选用方法; 3.掌握实验室里常用分馏的操作方法。 二、基本原理 1.分馏的概念 沸点不同但可互溶的液体混合物,通过在分馏柱中多次的汽化-冷凝,从而使低沸点物 质与高沸点物质得到分离,这个过程称为分馏。简单地说,分馏就是多次的蒸馏。 注:当两种或者三种液体混合物以一定比例混合,可组成具有固定沸点的混合物,将 这种混合物加热至沸腾时,在气液平衡体系中,气相组成和液相组成一样,故不能使用分 馏法将其分离出来,只能得到按一定比例组成的混合物,这种混合物称为共沸混合物。共 沸混合物有固定的组成和沸点,不能通过分馏的方法分离。 2.分馏的原理 混合物中各组分具有不同的蒸气压,加热沸腾产生的蒸气中,低沸点组分的含量较高。 将此蒸气冷凝,则得到低沸点组分含量较多的液体,这就是一次蒸馏。如将得到的液体继续 蒸馏,再度产生的蒸气中所含低沸点的组分含量又将增加。如此多次蒸馏,最终就将沸点不 同的两组分分离。但应用这样反复多次的简单蒸馏,不仅操作繁琐,又浪费时间、能源。因 此,通常采用分馏来进行分离。与简单蒸馏的不同之处是在装置上多一个分馏柱。 当混合物蒸气进入分馏柱中时,因为高沸点组分易被冷凝,所以冷凝液中就含有较多的 高沸点组分,故上升的蒸气中低沸点组分就会进一步相对地增多,通过多次的冷凝,在分馏 柱顶部出来的蒸气就越接近于纯低沸点组分。此外,含较多高沸点组分的冷凝液在分馏柱中 并不是全部直接回流到烧瓶底部,在回流途中,遇到上升的蒸气时,二者之间进行热交换, 使冷凝液中低沸点组分再次受热汽化,高沸点仍呈液态回流,越是在分馏柱底部,冷凝液中 高沸点组分的含量就越多,直至回流到烧瓶中。所以,在分馏柱中,混合物通过多次气-液 平衡的热交换产生多次的汽化-冷凝-回流-汽化的过程,最终使沸点相近的两组分得到较 好的分离。 简言之,分馏柱的作用就是使高沸点组分回流,低沸点组分得到蒸馏的仪器装置。分馏 的用途就是分离沸点相近的多组分液体混合物。影响分离效率的因素除混合物的本性外,主 要就在于分馏柱设备装置的精密性以及操作的科学性(回流比)。根据设备条件的不同,分 馏可分为简单分馏和精馏。现在用最精密的分馏设备已能将沸点相差 1~2 ℃的混合物分开。 了解分馏原理最好是应用恒压下的沸点-组成曲线图(称为相图,表示这两组分体系中相
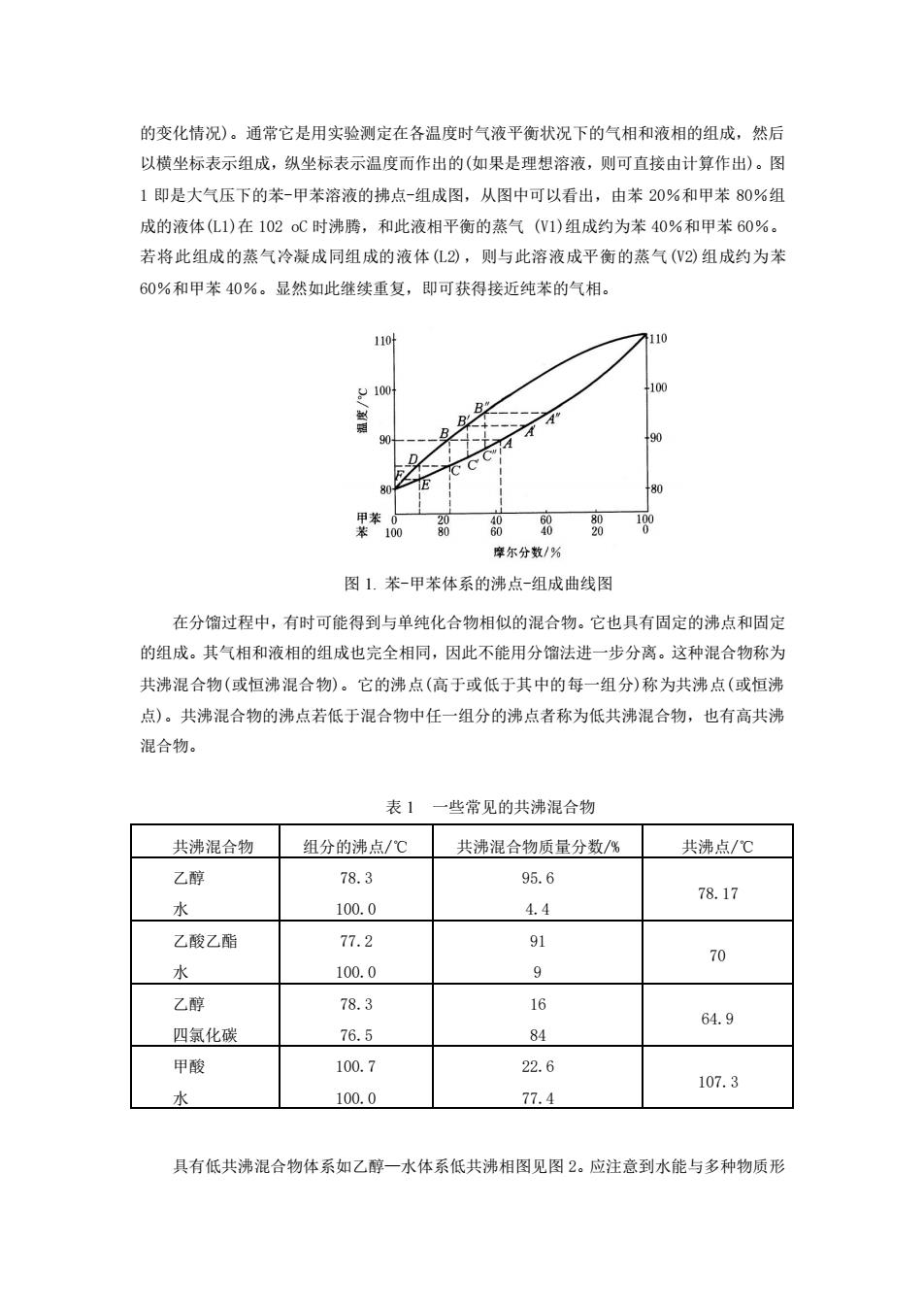
的变化情况)。通常它是用实验测定在各温度时气液平衡状况下的气相和液相的组成,然后 以横坐标表示组成,纵坐标表示温度而作出的(如果是理想溶液,则可直接由计算作出)。图 1即是大气压下的苯-甲苯溶液的拂点-组成图,从图中可以看出,由苯20%和甲苯80%组 成的液体(L1)在102oC时沸腾,和此液相平衡的蒸气(W1)组成约为苯40%和甲苯60%。 若将此组成的蒸气冷凝成同组成的液体①2),则与此溶液成平衡的蒸气(W2)组成约为苯 60%和甲苯40%。显然如此继续重复,即可获得接近纯苯的气相。 1104 100 100 摩尔分数/% 图1.苯-甲苯体系的沸点-组成曲线图 在分馏过程中,有时可能得到与单纯化合物相似的混合物。它也具有固定的沸点和固定 的组成。其气相和液相的组成也完全相同,因此不能用分馏法进一步分离。这种混合物称为 共沸混合物(或恒沸混合物)。它的沸点(高于或低于其中的每一组分)称为共沸点(或恒沸 点)。共沸混合物的沸点若低于混合物中任一组分的沸点者称为低共沸混合物,也有高共沸 混合物。 表1 一些常见的共沸混合物 共沸混合物细分的沸点/℃ 共沸混合物话量分数% 共沸点/℃ 乙醇 78.3 95.6 78.17 水 100.0 4.4 乙酸乙酯 77.2 9 水 100.0 9 名 乙醇 78.3 16 64.9 四氨化碳 76.5 84 甲酸 100.7 22.6 107.3 水 100.0 77.4 具有低共沸混合物体系如乙醇一水体系低共沸相图见图2。应注意到水能与多种物质形
的变化情况)。通常它是用实验测定在各温度时气液平衡状况下的气相和液相的组成,然后 以横坐标表示组成,纵坐标表示温度而作出的(如果是理想溶液,则可直接由计算作出)。图 1 即是大气压下的苯-甲苯溶液的拂点-组成图,从图中可以看出,由苯 20%和甲苯 80%组 成的液体(L1)在 102 oC 时沸腾,和此液相平衡的蒸气 (V1)组成约为苯 40%和甲苯 60%。 若将此组成的蒸气冷凝成同组成的液体(L2),则与此溶液成平衡的蒸气(V2)组成约为苯 60%和甲苯 40%。显然如此继续重复,即可获得接近纯苯的气相。 图 1. 苯-甲苯体系的沸点-组成曲线图 在分馏过程中,有时可能得到与单纯化合物相似的混合物。它也具有固定的沸点和固定 的组成。其气相和液相的组成也完全相同,因此不能用分馏法进一步分离。这种混合物称为 共沸混合物(或恒沸混合物)。它的沸点(高于或低于其中的每一组分)称为共沸点(或恒沸 点)。共沸混合物的沸点若低于混合物中任一组分的沸点者称为低共沸混合物,也有高共沸 混合物。 表 1 一些常见的共沸混合物 共沸混合物 组分的沸点/℃ 共沸混合物质量分数/% 共沸点/℃ 乙醇 水 78.3 100.0 95.6 4.4 78.17 乙酸乙酯 水 77.2 100.0 91 9 70 乙醇 四氯化碳 78.3 76.5 16 84 64.9 甲酸 水 100.7 100.0 22.6 77.4 107.3 具有低共沸混合物体系如乙醇—水体系低共沸相图见图 2。应注意到水能与多种物质形
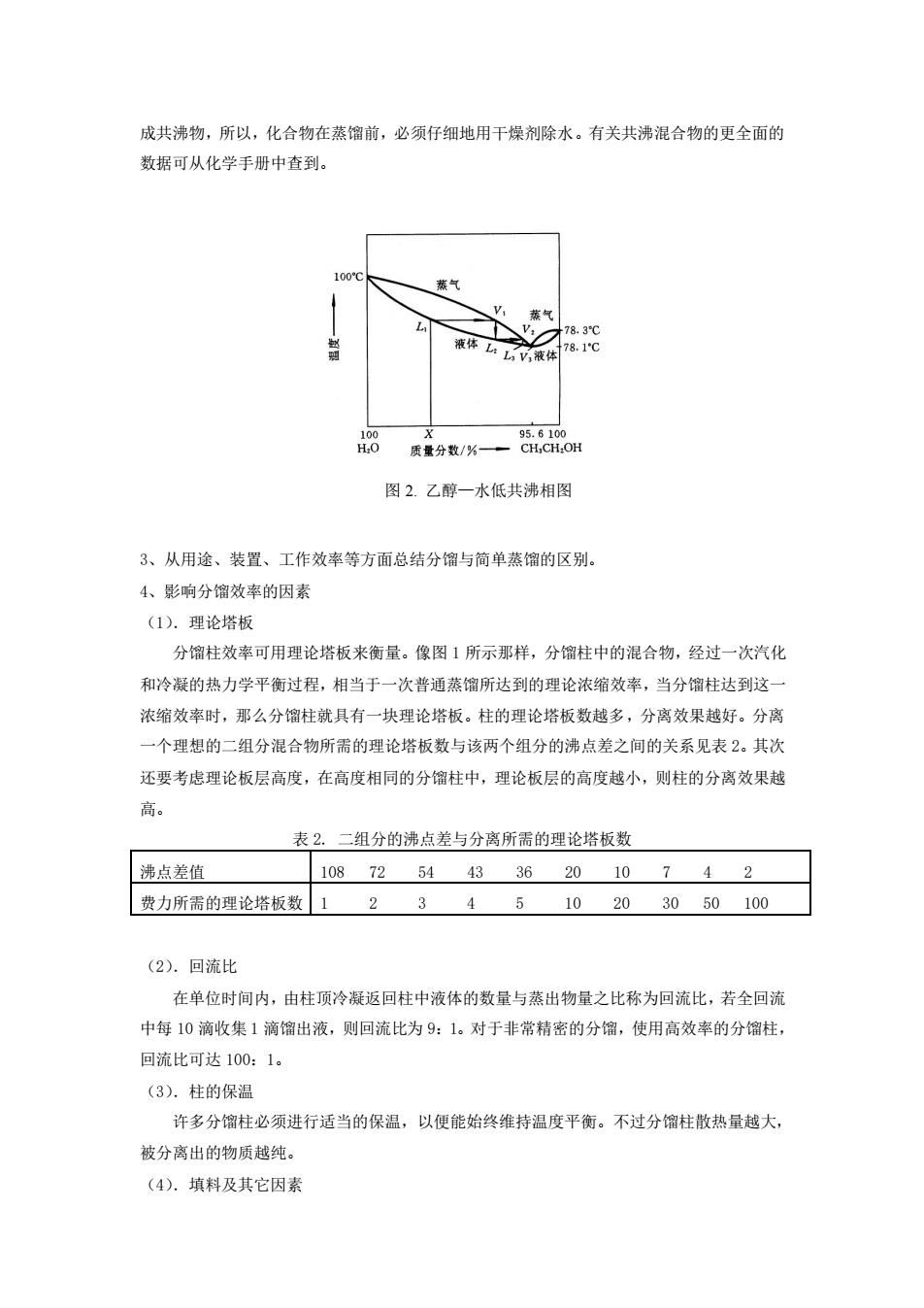
成共沸物,所以,化合物在蒸馏前,必须仔细地用干燥剂除水。有关共沸混合物的更全面的 数据可从化学手册中查到。 蒸气 图2.乙醇一水低共沸相图 3、从用途、装置、工作效率等方面总结分馏与简单蒸馏的区别。 4、影响分馏效奉的因素 (1).理论塔板 分馏柱效率可用理论塔板来衡量。像图1所示那样,分馏柱中的混合物,经过一次汽化 和冷凝的热力学平衡过程,相当于一次普通蒸馏所达到的理论浓缩效率,当分馏柱达到这 浓缩效率时,那么分馏柱就具有一块理论塔板。柱的理论塔板数越多,分离效果越好。分离 一个理想的二组分混合物所需的理论塔板数与该两个组分的沸点差之间的关系见表2。其次 还要考虑理论板层高度,在高度相同的分馏柱中,理论板层的高度越小,则柱的分离效果越 高。 表2.二组分的沸点差与分离所需的理论塔板数 沸点差值 108725443362010742 费力所需的理论塔板数1234510203050100 (2).回流比 在单位时间内,由柱顶冷凝返回柱中液体的数量与蒸出物量之比称为回流比,若全回流 中每10滴收集1滴馏出液,则回流比为9:1。对于非常精密的分馏,使用高效率的分馏柱 回流比可达100:1。 (3).柱的保温 许多分馏柱必须进行适当的保温,以便能始终维持温度平衡。不过分馏柱散热量越大, 被分离出的物质越纯。 (4).填料及其它因素
成共沸物,所以,化合物在蒸馏前,必须仔细地用干燥剂除水。有关共沸混合物的更全面的 数据可从化学手册中查到。 图 2. 乙醇—水低共沸相图 3、从用途、装置、工作效率等方面总结分馏与简单蒸馏的区别。 4、影响分馏效率的因素 (1).理论塔板 分馏柱效率可用理论塔板来衡量。像图 1 所示那样,分馏柱中的混合物,经过一次汽化 和冷凝的热力学平衡过程,相当于一次普通蒸馏所达到的理论浓缩效率,当分馏柱达到这一 浓缩效率时,那么分馏柱就具有一块理论塔板。柱的理论塔板数越多,分离效果越好。分离 一个理想的二组分混合物所需的理论塔板数与该两个组分的沸点差之间的关系见表 2。其次 还要考虑理论板层高度,在高度相同的分馏柱中,理论板层的高度越小,则柱的分离效果越 高。 表 2. 二组分的沸点差与分离所需的理论塔板数 沸点差值 108 72 54 43 36 20 10 7 4 2 费力所需的理论塔板数 1 2 3 4 5 10 20 30 50 100 (2).回流比 在单位时间内,由柱顶冷凝返回柱中液体的数量与蒸出物量之比称为回流比,若全回流 中每 10 滴收集 1 滴馏出液,则回流比为 9:1。对于非常精密的分馏,使用高效率的分馏柱, 回流比可达 100:1。 (3).柱的保温 许多分馏柱必须进行适当的保温,以便能始终维持温度平衡。不过分馏柱散热量越大, 被分离出的物质越纯。 (4).填料及其它因素

为了提高分馏柱的分馏效率,在分馏柱内装入具有大表面积的填料,填料之间应保留 定的空隙,要遵守释放紧密且均匀的原则,这样可以增加回流液体和上升蒸气的接触机会。 填料有玻璃(玻璃珠、短段玻璃管)或金属(不锈钢棉、金属丝绕成固定形状)。玻璃的优 点是不会与有机化合物起反应,而金属则可与卤代烷之类的化合物起反应。在分馏柱底部往 往放一些玻璃丝以防止填料坠入蒸馏容器中。 5.分馏柱的种类 分馏柱的种类较多。普通有机化学实验中常用的有填充式分馏柱和刺形分馏柱[又称韦 氏(Wigr©ux)分馏柱](见图3)。填充式分馏柱是在柱内填上各种惰性材料,以增加表面积。 填料包括玻璃珠、玻璃管、陶瓷或螺旋形、马鞍形、冈状等各种形状的金属片或金属丝。它 效率较高,适合于分离一些沸点差距较小的化合物。韦氏分馏柱结构简单,且较填充式粘附 的液体少,缺点是较同样长度的填充柱分馏效率低,适合于分离少量且沸点差距较大的液体。 若欲分离沸点相距很近的液体化合物,则必须使用精密分馏装置。 在分馏过程中,无论用哪一种柱,都应防止回流液体在柱内聚集,否则会减少液体和上 升蒸气的接触,或者上升蒸气把液体冲人冷凝管中造成“液泛”,达不到分馏的目的。为了 避免这种情况,通常在分馏柱外包扎石棉绳、石棉布等绝缘物以保持柱内温度,提高分馏效 率。 图3.简单分馏柱 三、实验仪器与药品 主要仪器 升降台、电热套、圆底烧瓶、分馏柱、蒸馏头、温度计、温度计套管、直形冷凝 管、真空接引管、量简等 主要试剂用量 沸石(2一3粒) 丙酮与水按1:1的比例混合(30L) 四、实验装置
为了提高分馏柱的分馏效率,在分馏柱内装入具有大表面积的填料,填料之间应保留一 定的空隙,要遵守释放紧密且均匀的原则,这样可以增加回流液体和上升蒸气的接触机会。 填料有玻璃(玻璃珠、短段玻璃管)或金属(不锈钢棉、金属丝绕成固定形状)。玻璃的优 点是不会与有机化合物起反应,而金属则可与卤代烷之类的化合物起反应。在分馏柱底部往 往放一些玻璃丝以防止填料坠入蒸馏容器中。 5. 分馏柱的种类 分馏柱的种类较多。普通有机化学实验中常用的有填充式分馏柱和刺形分馏柱[又称韦 氏(Vigreux)分馏柱] (见图 3)。填充式分馏柱是在柱内填上各种惰性材料,以增加表面积。 填料包括玻璃珠、玻璃管、陶瓷或螺旋形、马鞍形、网状等各种形状的金属片或金属丝。它 效率较高,适合于分离一些沸点差距较小的化合物。韦氏分馏柱结构简单,且较填充式粘附 的液体少,缺点是较同样长度的填充柱分馏效率低,适合于分离少量且沸点差距较大的液体。 若欲分离沸点相距很近的液体化合物,则必须使用精密分馏装置。 在分馏过程中,无论用哪一种柱,都应防止回流液体在柱内聚集,否则会减少液体和上 升蒸气的接触,或者上升蒸气把液体冲人冷凝管中造成“液泛”,达不到分馏的目的。为了 避免这种情况,通常在分馏柱外包扎石棉绳、石棉布等绝缘物以保持柱内温度,提高分馏效 率。 图 3. 简单分馏柱 三、实验仪器与药品 主要仪器 升降台、 电热套、 圆底烧瓶、 分馏柱、 蒸馏头、 温度计、 温度计套管、直形冷凝 管、真空接引管、 量筒等 主要试剂用量 沸石(2~3 粒) 丙酮与水按 1:1 的比例混合(30 mL) 四、实验装置
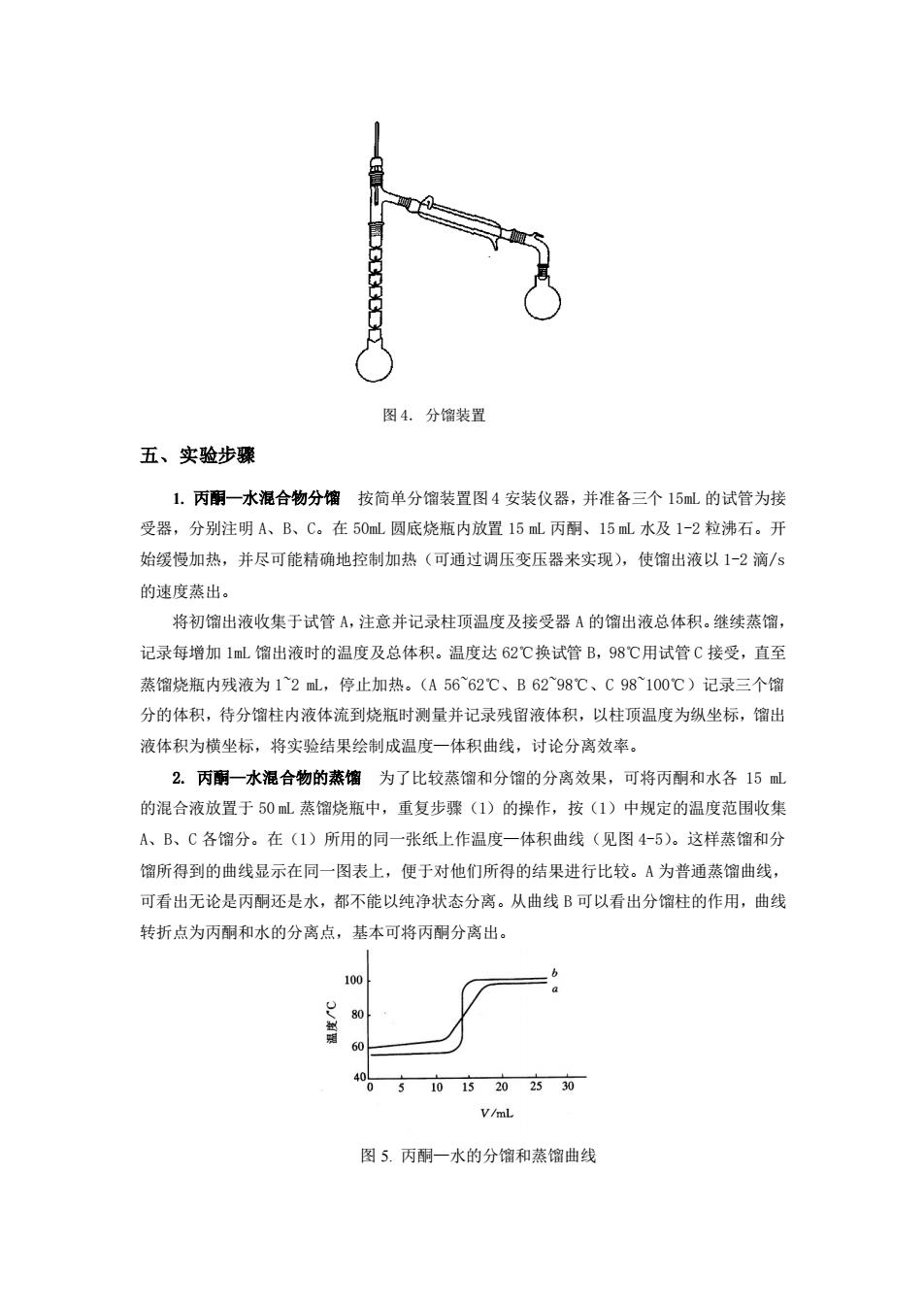
图4.分馏装置 五、实验步骤 1.丙酮一水混合物分馏按简单分馏装置图4安装仪器,并准备三个15L的试管为接 受器,分别注明A、B、C。在50m圆底烧瓶内放置15L丙酮、15L水及1-2粒沸石。开 始缓慢加热,并尽可能精确地控制加热(可通过调压变压器来实现),使馏出液以1一2滴/s 的速度蒸出。 将初馏出液收集于试管A,注意并记录柱顶温度及接受器A的馏出液总体积。继续蒸馏, 记录每增加1mL馏出液时的温度及总体积。温度达62℃换试管B,98℃用试管C接受,直至 蒸馏烧瓶内残液为12L,停止加热。(A5662℃、B6298C、C98100C)记录三个馏 分的体积,待分馏柱内液体流到烧瓶时测量并记录残留液体积,以柱项温度为纵坐标,馏出 液体积为横坐标,将实验结果绘制成温度一体积曲线,讨论分离效率。 2.丙酮一水混合物的蒸馏为了比较蒸馏和分馏的分离效果,可将丙酮和水各15L 的混合液放置于50L蒸馏烧瓶中,重复步骤(1)的操作,按(1)中规定的温度范围收集 A、B、C各馏分。在(1)所用的同一张纸上作温度一体积曲线(见图45)。这样蒸馏和分 馏所得到的曲线显示在同一图表上,便于对他们所得的结果进行比较。A为普通蒸馏曲线, 可看出无论是丙酮还是水,都不能以纯净状态分离。从曲线B可以看出分馏柱的作用,曲线 转折点为丙酮和水的分离点,基本可将丙酮分离出。 100 05101520250 V/mL. 图5.丙酮一水的分馏和蒸馏曲线
图 4. 分馏装置 五、实验步骤 1. 丙酮—水混合物分馏 按简单分馏装置图 4 安装仪器,并准备三个 15mL 的试管为接 受器,分别注明 A、B、C。在 50mL 圆底烧瓶内放置 15 mL 丙酮、15 mL 水及 1-2 粒沸石。开 始缓慢加热,并尽可能精确地控制加热(可通过调压变压器来实现),使馏出液以 1-2 滴/s 的速度蒸出。 将初馏出液收集于试管 A,注意并记录柱顶温度及接受器 A 的馏出液总体积。继续蒸馏, 记录每增加 1mL 馏出液时的温度及总体积。温度达 62℃换试管 B,98℃用试管 C 接受,直至 蒸馏烧瓶内残液为 1~2 mL,停止加热。(A 56~62℃、B 62~98℃、C 98~100℃)记录三个馏 分的体积,待分馏柱内液体流到烧瓶时测量并记录残留液体积,以柱顶温度为纵坐标,馏出 液体积为横坐标,将实验结果绘制成温度—体积曲线,讨论分离效率。 2. 丙酮—水混合物的蒸馏 为了比较蒸馏和分馏的分离效果,可将丙酮和水各 15 mL 的混合液放置于 50 mL 蒸馏烧瓶中,重复步骤(1)的操作,按(1)中规定的温度范围收集 A、B、C 各馏分。在(1)所用的同一张纸上作温度—体积曲线(见图 4-5)。这样蒸馏和分 馏所得到的曲线显示在同一图表上,便于对他们所得的结果进行比较。A 为普通蒸馏曲线, 可看出无论是丙酮还是水,都不能以纯净状态分离。从曲线 B 可以看出分馏柱的作用,曲线 转折点为丙酮和水的分离点,基本可将丙酮分离出。 图 5. 丙酮—水的分馏和蒸馏曲线

思考题 1、分馏和蒸馏在原理及装置上有哪些异同?如果是两种沸点很接近的液体组成的混合物能 否用分馏来提纯呢? 2、若加热太快,馏出液>1一2滴/s(每秒钟的滴数超过要求量),用分馏分离两种液体的 能力会显若下降,为什么? 3、用分馏柱提纯液体时候,为了取得较好的分离效果,为什么分馏柱必须保持有一定的回 流液? 4、在分离两种沸点相近的液体时,为什么装有填料的分馏柱比不装填料的效率高? 5、什么叫共沸物?为什么不能用分馏法分离共沸混合物? 6、在分馏时通常用水浴或油浴加热,它比直接火加热有什么优点?
思 考 题 1、分馏和蒸馏在原理及装置上有哪些异同?如果是两种沸点很接近的液体组成的混合物能 否用分馏来提纯呢? 2、若加热太快,馏出液>1-2 滴/s(每秒钟的滴数超过要求量),用分馏分离两种液体的 能力会显著下降,为什么? 3、用分馏柱提纯液体时候,为了取得较好的分离效果,为什么分馏柱必须保持有一定的回 流液? 4、在分离两种沸点相近的液体时,为什么装有填料的分馏柱比不装填料的效率高? 5、什么叫共沸物?为什么不能用分馏法分离共沸混合物? 6、在分馏时通常用水浴或油浴加热,它比直接火加热有什么优点?