
§1.9第一定律对化学反应的应用一一热化学 1.热化学概论 化学反应常常伴有热量变化,对这些热量进 行精密测定,并做详尽讨论,成为物理化学 的一个分支一一热化学 具有直观性和实用性 热力学第一定律在化学反应中的具体应用 化学反应中的热量变化一一热效应 对了解反映规律及化工生产和工艺操作都有 使用意义
1 §1.9 第一定律对化学反应的应用——热化学 1. 热化学概论 化学反应常常伴有热量变化,对这些热量进 行精密测定,并做详尽讨论,成为物理化学 的一个分支——热化学 具有直观性和实用性 热力学第一定律在化学反应中的具体应用 化学反应中的热量变化——热效应 对了解反映规律及化工生产和工艺操作都有 使用意义

例:3H2+N2→2NH3 300P°400℃Fe 放热反应 不及时取走放出的热量,必使体系温度上升 热化学的主要数据Cp和△H 理论意义:a)计算其它热力学函数 b)计算平衡常数 c)对第三定律的推出 起了重要作用 2
2 例:3H2 + N2 → 2NH3 300P°400℃ Fe 放热反应 不及时取走放出的热量,必使体系温度上升 热化学的主要数据 CP和ΔH 理论意义:a)计算其它热力学函数 b)计算平衡常数 c)对第三定律的推出 起了重要作用

2.化学反应的热效应 1)定义: 由于反应条件不同,种类繁多,有些反 应难控制,每个化学反应的热效应都不同 例:合成氨,始态:25℃,P 等温等压(25℃,P°),放热92.4KJ 在绝热容器中进行,Q0,T终态很高 不能对每个反应都实际测量 必须对反应条件进行规定: 反应在等T时吸收或放出的热量 反应热
3 2. 化学反应的热效应 由于反应条件不同,种类繁多,有些反 应难控制,每个化学反应的热效应都不同 例:合成氨,始态:25℃,P° 在绝热容器中进行,Q=0,T 终态很高 不能对每个反应都实际测量 必须对反应条件进行规定: 反应在等 T 时吸收或放出的热量——反应热 1)定义: 等温等压(25℃,P°),放热 92.4KJ

规定反应温度:T始态T终态 不包括反应物和产物的状态变化 定义:当反应发生之后,使产物的T又恢复 到反应物原来的起始T时所吸收或放出的热 量一一反应热或反映的热效应 4
4 规定反应温度:T 始态=T 终态 不包括反应物和产物的状态变化 定义:当反应发生之后,使产物的 T 又恢复 到反应物原来的起始 T 时所吸收或放出的热 量——反应热或反映的热效应

说明:a)讨论的反应,W”=0 b)化学反应一般在等T,P或T,V下发生 c)常见的热效应:Qv,Qr 2)热效应的测量 氧弹量热器 氧弹:合金钢,耐压,传热好,内充氧 水和容器的比热已知 5
5 说明:a)讨论的反应,W’=0 b)化学反应一般在等 T, P 或 T, V 下发生 c)常见的热效应: QV, QP 2)热效应的测量 氧弹量热器 氧弹:合金钢,耐压,传热好,内充氧 水和容器的比热已知
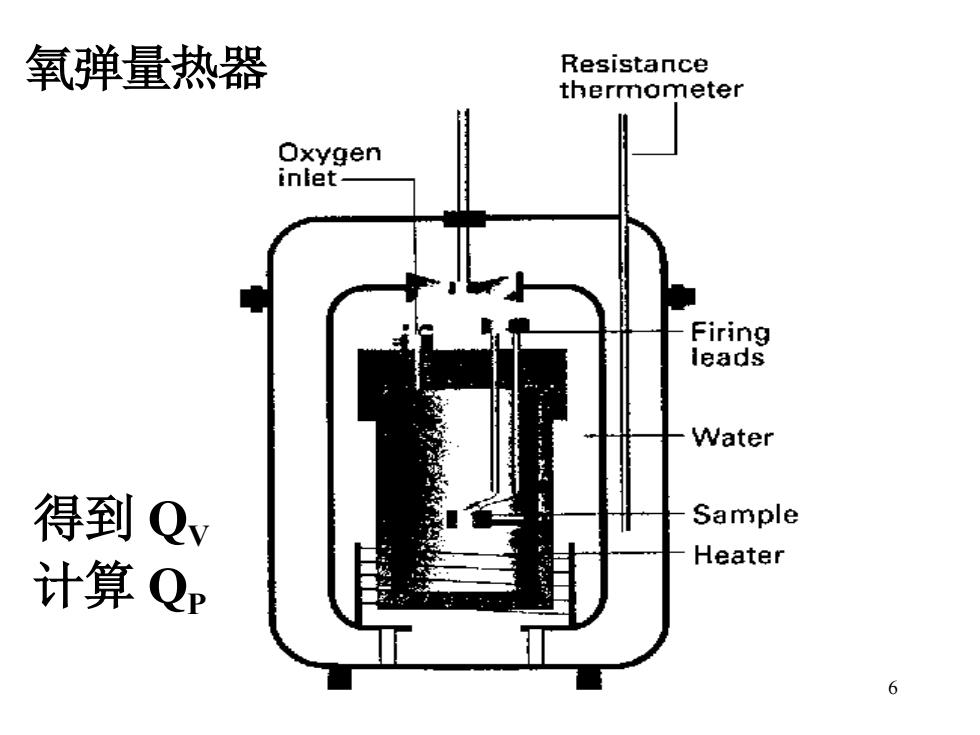
氧弹量热器 Resistance thermometer Oxygen inlet- Firing leads Water 得到 Qv Sample Heater 计算Qp 6
6 氧弹量热器 得到 QV 计算 QP

3)Qp与Qv的关系 等T,P,W=0, △H=Qp 等T,V,W=0, △U=Qy △H=△U+A(PV) 反应物(TP1V1) T,P,△,Hm1→产物(TP1V2) AU TY ①7A,U3 产畅(TP21) Q,=△H=A,U1+P(V2-V1) =△U2+△,U3+PV2V)
7 3)QP与 QV的关系 等 T,P, W`=0, Δ rH=Qp 等 T,V, W`=0, Δ rU=QV Δ rH=Δ r U+Δ(PV) Qp =Δ r H1 =Δ r U1 +P1 (V2 -V1 ) 反应物 ( T1 P1 V1 )⎯T ⎯,P, ⎯r H ⎯m , 1 → 产物(T1 P1 V2 ) Δr U2 T V T Δr U3 产物(T1 P2 V1 ) =Δ r U2 +Δ r U3 + P1 (V2 -V1 )

Q=Qy+P1V2V)+△U3 说明:a)气相反应: 理气:Q,=Qy+△nRT △U3=0 实气:Q,=Qy+△nRT △U3≠0,很小,略 b)凝聚态:只有液和固 Qp=Qv △U30,很小,略 c)复相反应:气、液和固都有 Qp=Qy+AnRT △n:气体mol数差值
8 Qp = QV + P1 (V2 - V1 ) +Δ r U3 说明:a)气相反应: 理气:Qp = QV +ΔnRT 实气:Qp = QV +ΔnRT b) 凝聚态:只有液和固 QP = QV c)复相反应:气、液和固都有 Δ r U3 =0 Δ r U3 0,很小,略 Δ r U3 0,很小,略 Qp = QV +ΔnRT Δn:气体 mol 数差值

3.热化学式 热化学方程式一一表示化学反应与热效应关 系的方程式 a) 注明反应条件:等T,P,等T,V; 298,KP0可略。 b) 反应物和产物的物态和浓度: 物态g,1,S;浓度C,m,x c)要注明反应热效应的数值 m$0g内)+20sePr) 298K →S03(gP) △Hm(28K)=.98.29K灯·m01
9 热化学方程式——表示化学反应与热效应关 系的方程式 a) 注明反应条件:等 T,P,等 T,V; 298,K P0可略。 b) 反应物和产物的物态和浓度: 物态 g,l,s; 浓度 C,m,x c)要注明反应热效应的数值 例:SO2 (g, Pθ) + 2 1 O2 (g, Pθ) ⎯⎯ ⎯→ 298K,P S O3 (g, Pθ) Δr H° m( 298K )= - 98.29 KJ·mol-1 3. 热化学式

4.化学反应进度(飞) 反应热与发生了多少反应有关 化学反应:0=∑ysB B:反应物或产物 VB:化学计量系数(反为"",产"+") 任意化学反应:aA+dD→gG+hH 0=gG hH -aA -dD 10
10 4. 化学反应进度() 反应热与发生了多少反应有关 化学反应: B B 0 = B B:反应物或产物 B :化学计量系数(反为"-",产"+") 任意化学反应:aA + dD → gG + hH 0=gG + hH -aA -dD