
第一章热力学第一定律 §1-1 热力学概论 概论 1.热力学是物理学的一个分支 共有三条基本定律。第一定律能量转化过程 中的数量守恒;第二定律能量转化过程中进 行的方向和限度;第三定律低温下物质运动 状态,并为各种物质的热力学函数的计算提 供科学方法
1 共有三条基本定律。第一定律能量转化过程 中的数量守恒;第二定律能量转化过程中进 行的方向和限度;第三定律低温下物质运动 状态,并为各种物质的热力学函数的计算提 供科学方法。 第一章 热力学第一定律 1. 热力学是物理学的一个分支 §1-1 热力学概论 一 . 概论

2.热力学应用于研究化学一一化学热力学 把热力学中的基本原理用来研究化学现象 及与化学有关的物理现象 化学热力学。 。化学变化中的能量的转变,反应的热效应 热力学第一定律的应用。 化学变化的方向和限度一一热力学第二定 律的应用
2 2. 热力学应用于研究化学——化学热力学 ⚫ 化学变化中的能量的转变,反应的热效应 ——热力学第一定律的应用。 ⚫ 化学变化的方向和限度——热力学第二定 律的应用。 把热力学中的基本原理用来研究化学现象 及与化学有关的物理现象——化学热力学

3.典型事例,说明化学热力学的应用 a.熔炉炼铁:FeO4+4C0→3Fe+4C02 b.人造金刚石:C(石墨)→C(金刚石) 由热力学知道P>15000P°时,才有可能; 今天已实现了这个转变(60000P°,1000℃, 催化剂) 二.热力学研究方法的特点和局限性 3
3 3. 典型事例,说明化学热力学的应用 b. 人造金刚石: C(石墨)→C(金刚石) 由热力学知道 P>15000P° 时,才有可能; 今天已实现了这个转变(60000P° ,1000℃, 催化剂) 二. 热力学研究方法的特点和局限性 a. 熔炉炼铁:Fe3O4 + 4CO → 3Fe + 4CO2

1.热力学方法的特点 研究大量粒子的宏观体系的宏观性质之间的 关系及变化规律, 。不考虑微观粒子的微观结构 。不涉及反应的速度和机理
4 1. 热力学方法的特点 ⚫ 研究大量粒子的宏观体系的宏观性质之间的 关系及变化规律, ⚫ 不考虑微观粒子的微观结构 ⚫ 不涉及反应的速度和机理

2.优点和局限性 1)热力学只研究体系的始终态 根据始终态的性质而得到可靠的结果;不 考虑变化中的细节;不考虑物质内部的结构 因素 2)不考虑时间因素 3)不考虑粒子的个别行为 5
5 2. 优点和局限性 1) 热力学只研究体系的始终态 根据始终态的性质而得到可靠的结果;不 考虑变化中的细节;不考虑物质内部的结构 因素 3)不考虑粒子的个别行为 2)不考虑时间因素

§1-2 基本概念和术语 1.体系和环境 1)定义: 体系:研究的对象,它包括一部分的物质 或空间 特点: a)是宏观体系 b)体系要占有空间 )体系是多种多样的,可以是气液固及多个 相的体系
6 §1-2 基本概念和术语 特点: a)是宏观体系 1 )定义: 体系:研究的对象,它包括一部分的物质 或空间 b)体系要占有空间 1. 体系和环境 c)体系是多种多样的,可以是气液固及多个 相的体系

环境:指体系以外与体系密切相关的部分。 特点: a)体系与环境之间有确定的界面 b)这种界面可以是真实的,也可以是虚构的 c)体系与环境的划分不是固定不变的 7
7 环境:指体系以外与体系密切相关的部分。 特点: a) 体系与环境之间有确定的界面 b)这种界面可以是真实的,也可以是虚构的 c)体系与环境的划分不是固定不变的
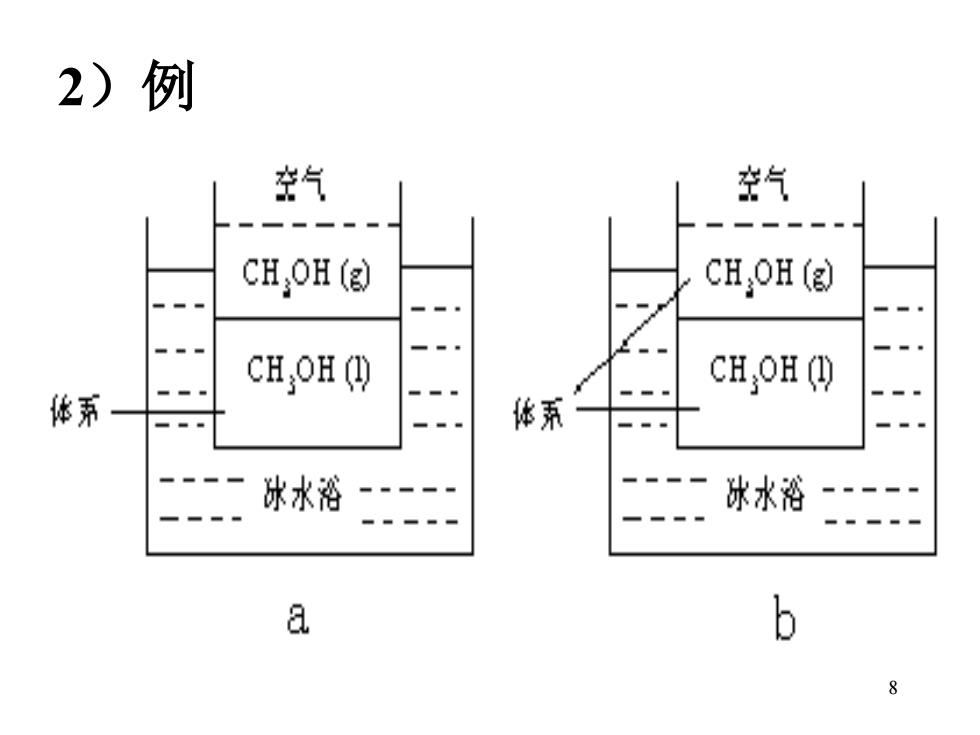
2)例 空气 空气 CHOH (g) CHH(g) CHH ( CHH ( 体系 体系 冰水裕 冰水浴 a b 8
8 2)例
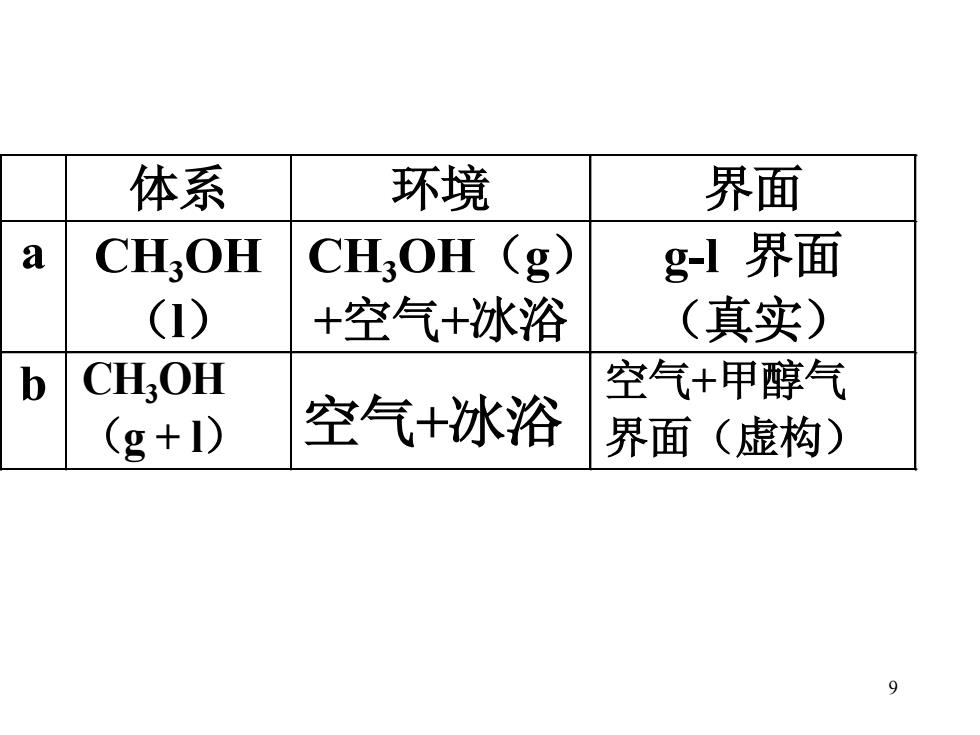
体系 环境 界面 a CH,OH CH,OH (g g-l界面 (1) +空气+冰浴 (真实) b CHOH 空气+甲醇气 (g+I) 空气+冰浴 界面(虚构) 9
9 体系 环境 界面 a CH3 OH (l) CH3 OH(g) +空气+冰浴 g-l 界面 (真实) b CH3OH (g + l) 空气+冰浴 空气+甲醇气 界面(虚构)

3)分类: 敞开体系:体系与环境间即有物质交换,又 有能量交换 封闭体系:体系与环境间没有物质交换,只 有能量交换 孤立体系:体系与环境间既无物质交换,又 无能量交换 10
10 3)分类: 敞开体系:体系与环境间即有物质交换,又 有能量交换 封闭体系:体系与环境间没有物质交换,只 有能量交换 孤立体系:体系与环境间既无物质交换,又 无能量交换