
第二部分生物化学基本实验 这部分内容为配合生物化学基本技术和技能训练,验证理论教学所设计的基本实验:内容 安排上以生物化学的理论系统为顺序,每个实验包括基本原理、 试剂、主要器材、操作步骤、结果、计算及正常值等,使学生能在实验前对实验有概括性的了解。 试剂部分介绍实验中所需用的全部试剂及配制保管方法,水溶液仅注明浓度,非水溶液均有注解。 在配制方法中所列出的量仅表示在配制过程中的数量关系,而非实验的实际需要量,实际的需要 量需按参加实验的人数,并考虑一定的耗损比例,按配制方法另行计算。器材部分仅列出需在实 验室配备和临时分发的主要器材设备,常用的仪器已在仪器单中列出,器材项内不再包括。操作 部分介绍进行实验的过程,计算方法。注意事项中所讨论的内容应在实验过程中随时注意,使实 验能顺利进行。 实验1铜的比色测定 原理」 氢氧化铵作为显色剂与Cu2*结合成深蓝色的铜氨络离子CuNH)HP,其颜色的深浅与Cu2+ 浓度呈正比关系,与同样处理的标准液进行比色,可求得待测液中C*的含量。 试剂 1.氢氧化铵溶液(氨水溶液):2mo/L 2.标准Cu2*溶液(100mg%):称取3.927g化学纯CuS045H0置于100ml容量瓶中,加40ml 水溶解,再加入5ml浓HSO:防止铜盐水解,最后加水至刻度并充分混匀。 [主要器材 1.试管及试管架 2.刻度吸量管 3.721型分光光度计 [操作步骤剽
第二部分 生物化学基本实验 这部分内容为配合生物化学基本技术和技能训练,验证理论教学所设计的基本实验;内容 安排上以生物化学的理论系统为顺序,每个实验包括基本原理、 试剂、主要器材、操作步骤、结果、计算及正常值等,使学生能在实验前对实验有概括性的了解。 试剂部分介绍实验中所需用的全部试剂及配制保管方法,水溶液仅注明浓度,非水溶液均有注解。 在配制方法中所列出的量仅表示在配制过程中的数量关系,而非实验的实际需要量,实际的需要 量需按参加实验的人数,并考虑一定的耗损比例,按配制方法另行计算。器材部分仅列出需在实 验室配备和临时分发的主要器材设备,常用的仪器已在仪器单中列出,器材项内不再包括。操作 部分介绍进行实验的过程,计算方法。注意事项中所讨论的内容应在实验过程中随时注意,使实 验能顺利进行。 实验 1 铜的比色测定 [原理] 氢氧化铵作为显色剂与 Cu2+结合成深蓝色的铜氨络离子[Cu(NH3)4] 2+,其颜色的深浅与 Cu2+ 浓度呈正比关系,与同样处理的标准液进行比色,可求得待测液中 Cu2+的含量。 [试剂] 1. 氢氧化铵溶液(氨水溶液): 2mol/L 2.标准 Cu2+溶液(100mg%):称取 3.927g 化学纯 CuSO4 .5H2O 置于 100ml 容量瓶中,加 40ml 水溶解,再加入 5ml 浓 H2SO4 防止铜盐水解,最后加水至刻度并充分混匀。 [主要器材] 1. 试管及试管架 2. 刻度吸量管 3.721 型分光光度计 [操作步骤]
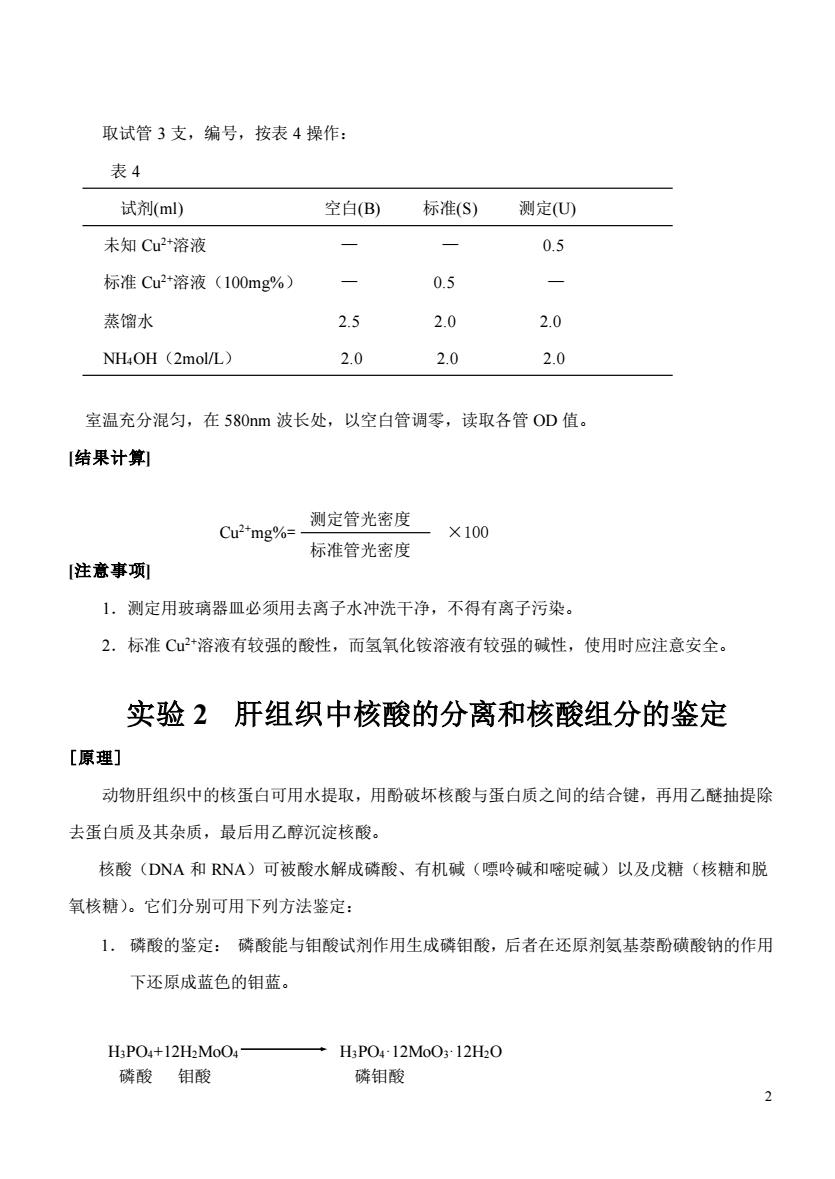
取试管3支,编号,按表4操作: 表4 试剂(ml) 空白(B)标准(S)测定(U 未知Cu2*溶液 0.5 标准Cu2*溶液(100mg%) 0.5 蒸馏水 2.5 2.0 2.0 NHOH (2mol/L) 2.0 2.0 2.0 室温充分混匀,在58Onm波长处,以空白管调零,读取各管OD值。 [结果计算 Cu2mg%测定管光密度 ×100 标准管光密度 [注意事项 1.测定用玻璃器皿必须用去离子水冲洗干净,不得有离子污染。 2.标准C+溶液有较强的酸性,而氢氧化铵溶液有较强的碱性,使用时应注意安全。 实验2肝组织中核酸的分离和核酸组分的鉴定 [原理] 动物肝组织中的核蛋白可用水提取,用酚破坏核酸与蛋白质之间的结合键,再用乙醚抽提除 去蛋白质及其杂质,最后用乙醇沉淀核酸。 核酸(DNA和RNA)可被酸水解成磷酸、有机碱(嘌呤碱和嘧啶碱)以及戊糖(核糖和脱 氧核糖)。它们分别可用下列方法鉴定: 1.磷酸的鉴定:磷酸能与钼酸试剂作用生成磷钼酸,后者在还原剂氨基茶酚磺酸钠的作用 下还原成蓝色的钼蓝。 H3PO4+12H2MoO4- 一HP04-12MoO312H20 磷酸钼酸 磷钼酸 2
2 取试管 3 支,编号,按表 4 操作: 表 4 试剂(ml) 空白(B) 标准(S) 测定(U) 未知 Cu2+溶液 — — 0.5 标准 Cu2+溶液(100mg%) — 0.5 — 蒸馏水 2.5 2.0 2.0 NH4OH(2mol/L) 2.0 2.0 2.0 室温充分混匀,在 580nm 波长处,以空白管调零,读取各管 OD 值。 [结果计算] Cu2+mg%= ×100 [注意事项] 1.测定用玻璃器皿必须用去离子水冲洗干净,不得有离子污染。 2.标准 Cu2+溶液有较强的酸性,而氢氧化铵溶液有较强的碱性,使用时应注意安全。 实验 2 肝组织中核酸的分离和核酸组分的鉴定 [原理] 动物肝组织中的核蛋白可用水提取,用酚破坏核酸与蛋白质之间的结合键,再用乙醚抽提除 去蛋白质及其杂质,最后用乙醇沉淀核酸。 核酸(DNA 和 RNA)可被酸水解成磷酸、有机碱(嘌呤碱和嘧啶碱)以及戊糖(核糖和脱 氧核糖)。它们分别可用下列方法鉴定: 1. 磷酸的鉴定: 磷酸能与钼酸试剂作用生成磷钼酸,后者在还原剂氨基萘酚磺酸钠的作用 下还原成蓝色的钼蓝。 H3PO4+12H2MoO4 H3PO4·12MoO3·12H2O 磷酸 钼酸 磷钼酸 标准管光密度 测定管光密度

6H+H3PO412MoO312H2O- -H3PO46MoO33MoOs-12H2O+3H2O 磷钼酸 还原剂 钼蓝 2.嘌吟碱的鉴定:嘌吟碱能与苦味酸作用形成针状结晶。 3.核糖的鉴定:核糖与强酸共热生成糠醛,后者与苔黑酚(3,5.-二羟甲苯,orcinol)反应, 缩合成绿色化合物 H -OH HO- 浓硫酸 0 H-C-HC +3H0 △ OH OH H 核糖 OH OH 糠醛 3,5-二羟甲苯 绿色化合物 4.脱氧核糖的鉴定脱氧核糖在强酸中加热可生成。-羟基-Y-酮基戊醛,后者与二苯胺 作用生成蓝色化合物。 CHO CHO CH2 CHOH 强酸 CH2 +H2O △ CHOH C-0 CH2OH CH2OH 脱氧核糖 @羟基-Y酮基戊醛
3 6H+H3PO4·12MoO3·12H2O H3PO4·6MoO3·3MoO5·12H2O+3H2O 磷钼酸 钼蓝 2.嘌呤碱的鉴定: 嘌呤碱能与苦味酸作用形成针状结晶。 3.核糖的鉴定: 核糖与强酸共热生成糠醛,后者与苔黑酚(3,5,-二羟甲苯,orcinol)反应, 缩合成绿色化合物。 4. 脱氧核糖的鉴定 脱氧核糖在强酸中加热可生成ω-羟基-γ-酮基戊醛,后者与二苯胺 作用生成蓝色化合物。 还原剂 OH CH3 H HO O O —C H3C OH O CH3 O —C 糠醛 3,5-二羟甲苯 绿色化合物 + CH2 CHO CHOH CHOH CH2OH CH2 CHO CH2 C=O CH2OH +H2O 强酸 脱氧核糖 -羟基--酮基戊醛 OH OH H H HO—C C—OH H—C—H C—C H 核糖 O 浓硫酸 H O O —C +3H2O 糠醛 H

CHO CH2 《NC →蓝色化合物 0-0 CH2OH -羟基-Y酮基戊醛 二苯胺 试剂 (一)90%苯酚溶液。 (二)乙醚。 (三)95%乙醇 (四)5%疏酸 (五)钼酸试剂钼酸铵5g溶于100ml蒸馏水中,再加入浓硫酸15ml,冷却后加蒸馏水至 1000ml。冷处保存(一个月内稳定)。 (六)氨基萘酚磺酸钠溶液1,2,4氨基萘酚磺酸钠0.5g溶于195ml15%亚硫酸氢钠与5ml 20%亚硫酸钠溶液中,加塞振摇助溶。贮存于棕色瓶中,冰箱保存(可用4周)用时取上清液。 (七)饱和苦味酸溶液苦味酸约13g溶于100ml蒸馏水中,静置过夜。临用前取上清液。 (八)Bial试剂苔黑酚1.5g加入浓盐酸500ml中,再加10%氯化高铁20-30滴。临用前配 制,冰箱保存。 (九)二苯胺试剂取二苯胺1g溶于100ml冰醋酸中,加入浓硫酸2.75ml,临用前配制, 贮于棕色瓶中。 [主要器材打 (一)离心机 (二)沸水浴 (三)研钵 [操作步骤] (一)肝组织中核酸的提取:按以下流程操作:
4 [试剂] (一)90%苯酚溶液。 (二)乙醚。 (三)95%乙醇。 (四)5%硫酸 (五)钼酸试剂 钼酸铵 5g 溶于 100ml 蒸馏水中,再加入浓硫酸 15ml,冷却后加蒸馏水至 1000ml。冷处保存(一个月内稳定)。 (六)氨基萘酚磺酸钠溶液 1,2,4-氨基萘酚磺酸钠 0.5g 溶于 195ml 15%亚硫酸氢钠与 5ml 20%亚硫酸钠溶液中,加塞振摇助溶。贮存于棕色瓶中,冰箱保存(可用 4 周)用时取上清液。 (七)饱和苦味酸溶液 苦味酸约 1.3g 溶于 100ml 蒸馏水中,静置过夜。临用前取上清液。 (八)Bial 试剂 苔黑酚 1.5g 加入浓盐酸 500ml 中,再加 10%氯化高铁 20~30 滴。临用前配 制,冰箱保存。 (九)二苯胺试剂 取二苯胺 1g 溶于 100ml 冰醋酸中,加入浓硫酸 2.75ml,临用前配制, 贮于棕色瓶中。 [主要器材] (一)离心机 (二)沸水浴 (三)研钵 [操作步骤] (一) 肝组织中核酸的提取:按以下流程操作: CH2 CHO CH2 C=O CH2OH N H -羟基--酮基戊醛 二苯胺 + 蓝色化合物
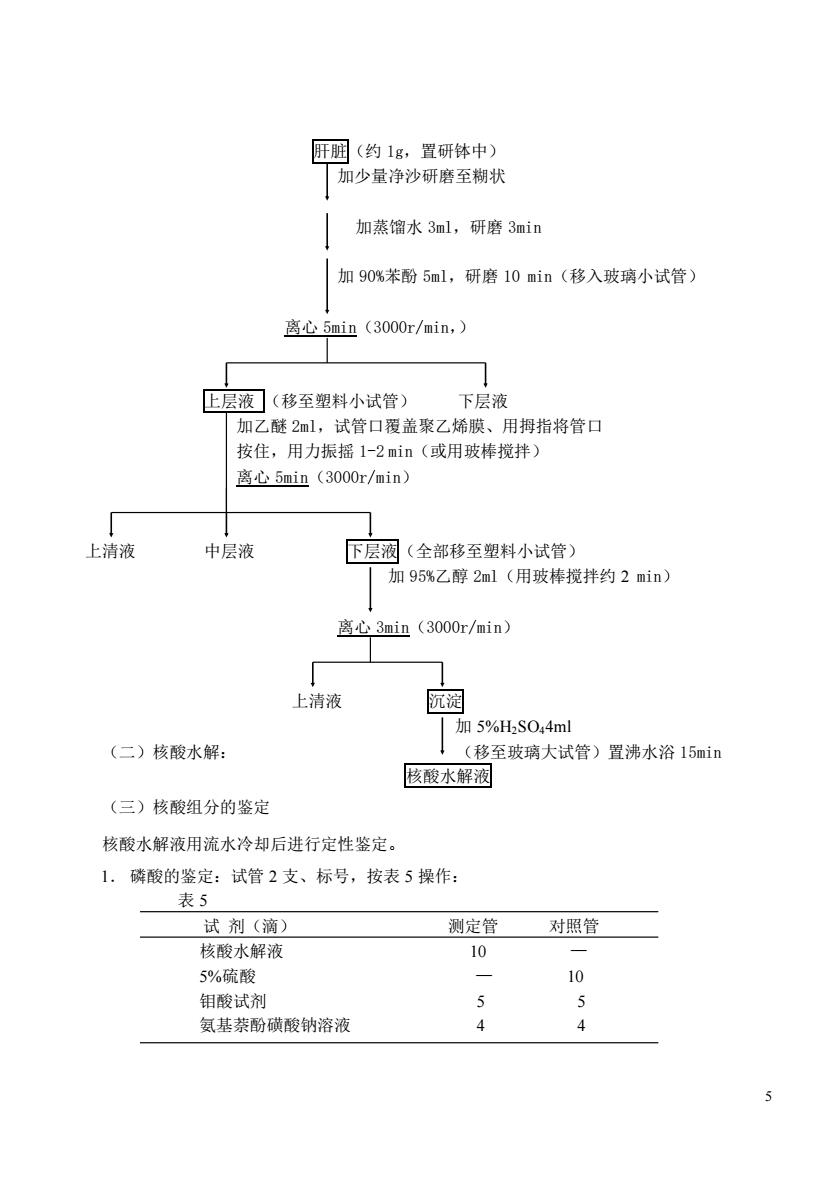
肝润(约1g,置研体中) 加少量净沙研磨至糊状 加蒸馏水3ml,研磨3min 加90%苯酚5ml,研磨10min(移入玻璃小试管) 离心5min(3000r/min,) 上层液(移至塑料小试管) 下层液 加乙酰2ml,试管口覆盖聚乙烯膜、用拇指将管口 按住,用力振摇1-2min(或用玻棒搅拌) 离心5min(3000r/min) 上清液 中层液 下层液(全部移至塑料小试管) 加95%乙醇2ml(用玻棒搅拌约2min) 离心3min(3000r/min) 上清液 阮淀 |加5%H2S044ml (二)核酸水解: !(移至玻璃大试管)置沸水浴15min 核酸水解液 (三)核酸组分的鉴定 核酸水解液用流水冷却后进行定性鉴定。 1.磷酸的鉴定:试管2支、标号,按表5操作: 表5 试剂(滴) 测定管对照管 核酸水解液 10 5%陆移 10 钼酸试剂 氨基萘酚磺酸钠溶液 4 4
5 肝脏(约 1g,置研钵中) 加少量净沙研磨至糊状 加蒸馏水 3ml,研磨 3min 加 90%苯酚 5ml,研磨 10 min(移入玻璃小试管) 离心 5min(3000r/min,) 上层液 (移至塑料小试管) 下层液 加乙醚 2ml,试管口覆盖聚乙烯膜、用拇指将管口 按住,用力振摇 1-2 min(或用玻棒搅拌) 离心 5min(3000r/min) 上清液 中层液 下层液(全部移至塑料小试管) 加 95%乙醇 2ml(用玻棒搅拌约 2 min) 离心 3min(3000r/min) 上清液 沉淀 加 5%H2SO44ml (二)核酸水解: (移至玻璃大试管)置沸水浴 15min 核酸水解液 (三)核酸组分的鉴定 核酸水解液用流水冷却后进行定性鉴定。 1. 磷酸的鉴定:试管 2 支、标号,按表 5 操作: 表 5 试 剂(滴) 测定管 对照管 核酸水解液 10 — 5%硫酸 — 10 钼酸试剂 5 5 氨基萘酚磺酸钠溶液 4 4
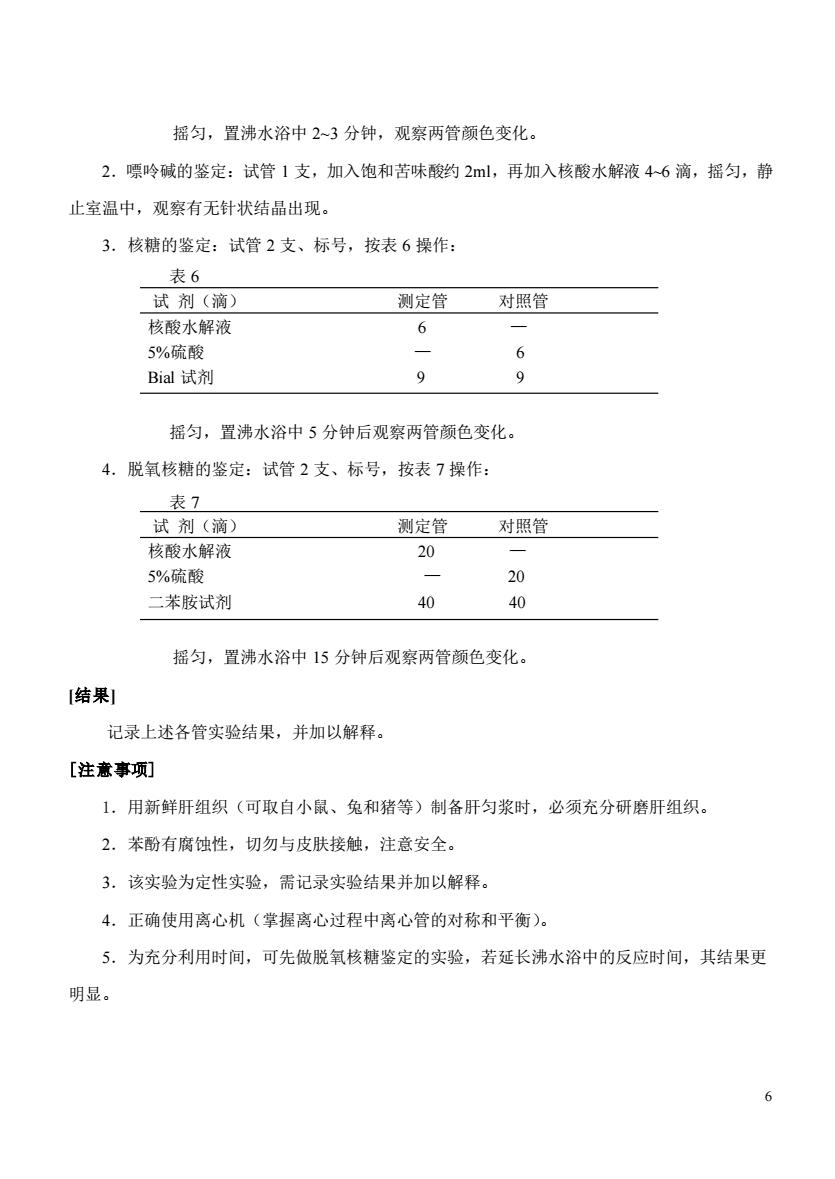
摇匀,置沸水浴中2~3分钟,观察两管颜色变化。 2.嘌呤碱的鉴定:试管1支,加入饱和苦味酸约2l,再加入核酸水解液46滴,摇匀,静 止室温中,观察有无针状结晶出现。 3.核糖的鉴定:试管2支、标号,按表6操作: 表6 试剂(滴) 测定管 对照管 核酸水解液 6 5%硫酸 6 Bial试剂 9 9 摇匀,置沸水浴中5分钟后观察两管颜色变化 4.脱氧核糖的鉴定:试管2支、标号,按表7操作: 老7 试剂(滴) 测定管对照管 核酸水解液 20 5%硫酸 20 二苯胺试剂 40 摇匀,置沸水浴中15分钟后观察两管颜色变化。 [结果 记录上述各管实验结果,并加以解释。 [注意事项] 1.用新鲜肝组织(可取自小鼠、兔和猪等)制备肝匀浆时,必须充分研磨肝组织。 2.苯酚有腐蚀性,切勿与皮肤接触,注意安全。 3.该实验为定性实验,需记录实验结果并加以解释。 4.正确使用离心机(掌握离心过程中离心管的对称和平衡)。 5.为充分利用时间,可先做脱氧核糖鉴定的实验,若延长沸水浴中的反应时间,其结果更 明显
6 摇匀,置沸水浴中 2~3 分钟,观察两管颜色变化。 2.嘌呤碱的鉴定:试管 1 支,加入饱和苦味酸约 2ml,再加入核酸水解液 4~6 滴,摇匀,静 止室温中,观察有无针状结晶出现。 3.核糖的鉴定:试管 2 支、标号,按表 6 操作: 表 6 试 剂(滴) 测定管 对照管 核酸水解液 6 — 5%硫酸 — 6 Bial 试剂 9 9 摇匀,置沸水浴中 5 分钟后观察两管颜色变化。 4.脱氧核糖的鉴定:试管 2 支、标号,按表 7 操作: 表 7 试 剂(滴) 测定管 对照管 核酸水解液 20 — 5%硫酸 — 20 二苯胺试剂 40 40 摇匀,置沸水浴中 15 分钟后观察两管颜色变化。 [结果] 记录上述各管实验结果,并加以解释。 [注意事项] 1.用新鲜肝组织(可取自小鼠、兔和猪等)制备肝匀浆时,必须充分研磨肝组织。 2.苯酚有腐蚀性,切勿与皮肤接触,注意安全。 3.该实验为定性实验,需记录实验结果并加以解释。 4.正确使用离心机(掌握离心过程中离心管的对称和平衡)。 5.为充分利用时间,可先做脱氧核糖鉴定的实验,若延长沸水浴中的反应时间,其结果更 明显
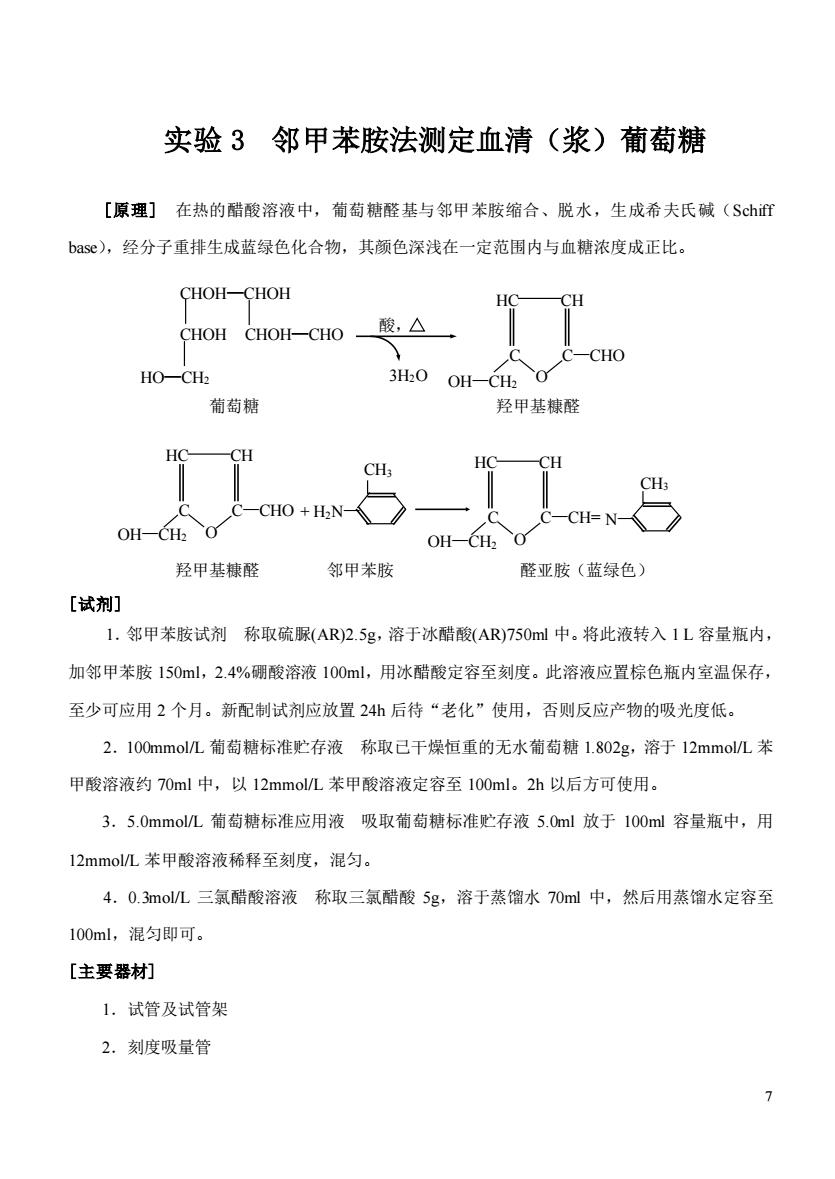
实验3邻甲苯胺法测定血清(浆)葡萄糖 [原理]在热的醋酸溶液中,葡萄糖醛基与邻甲苯胺缩合、脱水,生成希夫氏碱(Sch近 bas©),经分子重排生成蓝绿色化合物,其颜色深浅在一定范围内与血糖浓度成正比。 CHOH-CHOH ●H CHOH CHOH-CHO 酸,△ -CHO HO-CH2 3H2O OH-CH2 葡萄糖 甲基糠醛 CH HC -CH OH-CH2 O OH-CH2 O 羟甲基糠醛 邻甲苯胺 醛亚胺(蓝绿色) [试剂] 1.邻甲苯胺试剂称取硫脲(AR)2.5g,溶于冰醋酸(AR)750ml中。将此液转入1L容量瓶内, 加邻甲苯胺150ml,2.4%硼酸溶液100ml,用冰醋酸定容至刻度。此溶液应置棕色瓶内室温保存, 至少可应用2个月。新配制试剂应放置24h后待“老化”使用,否则反应产物的吸光度低。 2.100mmol/L葡萄糖标准贮存液称取已干燥恒重的无水葡萄糖1.802g,溶于12mmol/L苯 甲酸溶液约70ml中,以12mmol/L苯甲酸溶液定容至100ml。2h以后方可使用。 3.5.0mmol/L葡萄糖标准应用液吸取葡萄糖标准贮存液5.0ml放于100ml容量瓶中,用 12 nmol/L苯甲酸溶液稀释至刻度,混匀。 4.0.3molL三氯醋酸溶液称取三氯醋酸5g,溶于蒸馏水70ml中,然后用蒸馏水定容至 100ml,混匀即可。 [主要器材] 1,试管及试管架 2.刻度吸量管
7 实验 3 邻甲苯胺法测定血清(浆)葡萄糖 [原理] 在热的醋酸溶液中,葡萄糖醛基与邻甲苯胺缩合、脱水,生成希夫氏碱(Schiff base),经分子重排生成蓝绿色化合物,其颜色深浅在一定范围内与血糖浓度成正比。 [试剂] 1.邻甲苯胺试剂 称取硫脲(AR)2.5g,溶于冰醋酸(AR)750ml 中。将此液转入 1 L 容量瓶内, 加邻甲苯胺 150ml,2.4%硼酸溶液 100ml,用冰醋酸定容至刻度。此溶液应置棕色瓶内室温保存, 至少可应用 2 个月。新配制试剂应放置 24h 后待“老化”使用,否则反应产物的吸光度低。 2.100mmol/L 葡萄糖标准贮存液 称取已干燥恒重的无水葡萄糖 1.802g,溶于 12mmol/L 苯 甲酸溶液约 70ml 中,以 12mmol/L 苯甲酸溶液定容至 100ml。2h 以后方可使用。 3.5.0mmol/L 葡萄糖标准应用液 吸取葡萄糖标准贮存液 5.0ml 放于 100ml 容量瓶中,用 12mmol/L 苯甲酸溶液稀释至刻度,混匀。 4.0.3mol/L 三氯醋酸溶液 称取三氯醋酸 5g,溶于蒸馏水 70ml 中,然后用蒸馏水定容至 100ml,混匀即可。 [主要器材] 1.试管及试管架 2.刻度吸量管 CHOH—CHOH CHOH CHOH—CHO HO—CH2 葡萄糖 羟甲基糠醛 HC CH O C C—CHO OH—CH2 酸, 3H2O 羟甲基糠醛 邻甲苯胺 醛亚胺(蓝绿色) HC CH O C C—CHO OH—CH2 CH3 HC CH O C C—CH= OH—CH2 N— CH3 + H2N—
3.721型分光光度计 [操作步骤] 1.血清、血浆、脑脊液及清亮的胸腹水按表8操作。 表8 加入物(ml) 空白管 标准管测定管 蒸馏水 0.1 葡萄糖标准应用液(5.0mmol/L) 0.1 血清(血浆、脑脊液) 0.1 邻甲苯胺试剂 3.0 3.0 30 混匀,置沸水中煮沸12min,取出置冷水中冷却3min,在630nm处比色,以空白管调零 读取各管吸光度。 2.严重黄疸、溶血及乳糜样血清制备无蛋白血滤液:取血清0.2ml,加入0.3molL三氯醋 酸溶液l.8ml,混匀,静置5min,离心5min,取上清液按表9操作。 表9 加入物(ml)) 空白管标准管测定管 三氯醋酸溶液 1.0 0.9 葡萄糖标准应用液(5.0mmo1/L) 0.1 无蛋白血滤液 1.0 邻甲苯胺试剂 5.0 5.0 5.0 混匀,置沸水浴中煮沸12min,取出置自米水中冷却3min,在波长630nm处比色,以空白 管调零,读取各管吸光度。 [结果计算] 血糖浓度(mmol/L):测定管光密度 ×5.0 标准管光密度 1参考范围13.89~6.11 nmol/L [注意事项] 1.邻甲苯胺为浅黄色油状液体,易氧化。配制前宜重蒸馏,收集199~201℃的馏出部分 此部分馏出液应为无色或浅黄色,然后加入盐酸精胺(1gL)防止氧化,置棕色瓶密封避光保存
8 3.721 型分光光度计 [操作步骤] 1. 血清、血浆、脑脊液及清亮的胸腹水按表 8 操作。 表 8 加入物(ml) 空白管 标准管 测定管 蒸馏水 0.1 - - 葡萄糖标准应用液(5.0 mmol/L) - 0.1 - 血清(血浆、脑脊液) - - 0.1 邻甲苯胺试剂 3.0 3.0 3.0 混匀,置沸水中煮沸 12min,取出置冷水中冷却 3min,在 630nm 处比色,以空白管调零, 读取各管吸光度。 2. 严重黄疸、溶血及乳糜样血清制备无蛋白血滤液:取血清 0.2ml,加入 0.3mol/L 三氯醋 酸溶液 l.8ml,混匀,静置 5min,离心 5min,取上清液按表 9 操作。 表 9 加入物(ml) 空白管 标准管 测定管 三氯醋酸溶液 1.0 0.9 - 葡萄糖标准应用液(5.0 mmol/L) - 0.1 - 无蛋白血滤液 - - 1.0 邻甲苯胺试剂 5.0 5.0 5.0 混匀,置沸水浴中煮沸 12min,取出置自来水中冷却 3min,在波长 630nm 处比色,以空白 管调零,读取各管吸光度。 [结果计算] 血糖浓度(mmol/L)= ×5.0 [参考范围] 3.89 ~6.11mmol/L [注意事项] 1.邻甲苯胺为浅黄色油状液体,易氧化。配制前宜重蒸馏,收集 199~201℃的馏出部分, 此部分馏出液应为无色或浅黄色,然后加入盐酸精胺(1g/L)防止氧化,置棕色瓶密封避光保存。 测定管光密度 标准管光密度

2.邻甲苯胺在冰醋酸中并不十分稳定,易氧化产生棕色物质而干扰比色,故在邻甲苯胺试 剂中加入硫脲,使试剂有抗氧化作用,减少棕色干扰,增加试剂的稳定性,降低空白管的吸光度, 并有一定的增色效应 3.硼酸与ā一葡萄糖的羟基结合,能促进葡萄糖转变醛式构型,增加反应的活性。 4.沸水浴时沸水一定要盖过管内的液面,否则温度不均匀,影响显色。 5.此法受煮沸时间、比色时间、试剂存放时间等因素的影响。一般不宜以校正曲线法进行 计算,故每次应同时作标准管。 6.最终反应液偶尔会产生混浊,最常见原因是高脂血症:此时,可向显色液3ml中加入异 丙醇1.5ml,充分混匀:溶解脂质可消除混浊,所测吸光度乘以1.5。注射右旋糖酐时,由于右 旋糖酐不溶于邻甲苯胺试剂而产生混浊:冷水浴太冷时亦会出现混浊。 实验4酪氨酸酶的催化作用 原理」 酪氨酸酶是一种以铜为辅基的结合蛋白酶,这种氧化酶可直接作用于底物多巴生成多巴醌, 然后经过一系列的反应,最终生成黑色素。在多巴转变为多巴醌的反应中,酪氨酸酶使多巴中的 氢原子的两个电子传递给分子氧,使后者转变为氧离子,游离在溶液中的两个质子与氧离子化合 生成水。其催化的主要反应及电子传递过程如下: CH:CHCOOH CH2CHCOOH ,NH酪氨酸羟化酶 NH2 酪氨酸码 NH2 [O](黑色素细胞) OH (2e OH 0 OH 2Cu 2C 酪氨酸 多巴 2H 多巴醒 1/20 黑色素 H2O
9 2.邻甲苯胺在冰醋酸中并不十分稳定,易氧化产生棕色物质而干扰比色,故在邻甲苯胺试 剂中加入硫脲,使试剂有抗氧化作用,减少棕色干扰,增加试剂的稳定性,降低空白管的吸光度, 并有一定的增色效应。 3.硼酸与α-葡萄糖的羟基结合,能促进葡萄糖转变醛式构型,增加反应的活性。 4.沸水浴时沸水一定要盖过管内的液面,否则温度不均匀,影响显色。 5.此法受煮沸时间、比色时间、试剂存放时间等因素的影响。一般不宜以校正曲线法进行 计算,故每次应同时作标准管。 6.最终反应液偶尔会产生混浊,最常见原因是高脂血症;此时,可向显色液 3ml 中加入异 丙醇 1.5ml,充分混匀;溶解脂质可消除混浊,所测吸光度乘以 1.5 。注射右旋糖酐时,由于右 旋糖酐不溶于邻甲苯胺试剂而产生混浊;冷水浴太冷时亦会出现混浊。 实验 4 酪氨酸酶的催化作用 [原理] 酪氨酸酶是一种以铜为辅基的结合蛋白酶,这种氧化酶可直接作用于底物多巴生成多巴醌, 然后经过一系列的反应,最终生成黑色素。在多巴转变为多巴醌的反应中,酪氨酸酶使多巴中的 氢原子的两个电子传递给分子氧,使后者转变为氧离子,游离在溶液中的两个质子与氧离子化合 生成水。其催化的主要反应及电子传递过程如下: 酪氨酸羟化酶 [O](黑色素细胞) OH CH2CHCOOH NH2 O CH2CHCOOH NH2 酪氨酸 OH CH2CHCOOH NH2 OH 酪氨酸酶 2H+ 2e 2H O 1/2O2 2- H2O 多巴 多巴醌 聚 合 黑色素 2Cu2+ 2Cu+ O

酪氨酸是甲状腺素、肾上腺素和黑色素的前体。人类皮肤、毛发和眼睛虹膜的黑色素是酪氨 酸在酪氨酸羟化酶催化作用下生成了3,4二羟苯丙氨酸(简称多巴,DOPA),后者在酪氨酸酶的 作用下生成多巴醌,而后经过一系列中间反应,最后聚合成黑色素。白化病(albunism)是一种 表现为皮肤、毛发和虹膜变白,因为缺乏酪氨酸酶而不能合成黑色素的先天性代谢缺陷性疾病。 酪氨酸酶也广泛分布于植物界,例如新鲜蘑菇、马铃薯(外层含量尤多)和谷物等。 试剂 1.酪氨酸溶液0.1g酪氨酸溶于100ml0.1%碳酸钠溶液中。 2.马铃薯抽提液切碎马铃薯约6g置于研体中,加少量净砂,研成匀浆,再加蒸馏水10ml 充分研磨;最后通过棉花过滤,即可获得含有酪氨酸酶的马铃薯抽提液。 3.煮沸过的马铃薯滤液取2ml试剂2于试管内,在酒精灯上加热至沸以破坏酶的活性。 4.液体石蜡 【主要器材 研体、恒温水浴箱 [操作步骤 取试管3支按表10进行操作 表10 试剂(滴) 3 者沸过的马铃薯液 20 马铃薯抽提液 20 20 酪氨酸液 20 20 20 充分混匀各管 液体石蜡 5 置35℃~40℃水浴约30分钟,观察并记录各管颜色,试解释所得的结果。 注意事项 1.煮沸马铃薯液时,小心勿使液体溅出。 2,加液体石蜡时宜斜执试管,沿管壁缓缓加入,不要产生气泡:加入的液体石蜡必需完全 覆盖液面,以隔绝空气
10 酪氨酸是甲状腺素、肾上腺素和黑色素的前体。人类皮肤、毛发和眼睛虹膜的黑色素是酪氨 酸在酪氨酸羟化酶催化作用下生成了 3,4-二羟苯丙氨酸(简称多巴,DOPA),后者在酪氨酸酶的 作用下生成多巴醌,而后经过一系列中间反应,最后聚合成黑色素。白化病(albunism)是一种 表现为皮肤、毛发和虹膜变白,因为缺乏酪氨酸酶而不能合成黑色素的先天性代谢缺陷性疾病。 酪氨酸酶也广泛分布于植物界,例如新鲜蘑菇、马铃薯(外层含量尤多)和谷物等。 [试剂] 1.酪氨酸溶液 0.1g 酪氨酸溶于 100ml 0.1%碳酸钠溶液中。 2.马铃薯抽提液 切碎马铃薯约 6g 置于研钵中,加少量净砂,研成匀浆,再加蒸馏水 l0ml 充分研磨;最后通过棉花过滤,即可获得含有酪氨酸酶的马铃薯抽提液。 3.煮沸过的马铃薯滤液 取 2ml 试剂 2 于试管内,在酒精灯上加热至沸以破坏酶的活性。 4.液体石蜡 [主要器材] 研钵、恒温水浴箱 [操作步骤] 取试管 3 支按表 10 进行操作 表 10 试剂(滴) 1 2 3 煮沸过的马铃薯液 20 — — 马铃薯抽提液 — 20 20 酪氨酸液 20 20 20 充分混匀各管 液体石蜡 — — 5 置 35℃~40℃水浴约 30 分钟,观察并记录各管颜色,试解释所得的结果。 [注意事项] 1.煮沸马铃薯液时,小心勿使液体溅出。 2.加液体石蜡时宜斜执试管,沿管壁缓缓加入,不要产生气泡;加入的液体石蜡必需完全 覆盖液面,以隔绝空气