
第八章生物氧化与氧化磷酸化 第一节生物氧化概述 一切生物都靠能量维持生存,生物体所需的能量大都来自体内糖、脂肪、蛋白质等有机 物的氧化。生物体内的氧化和生物体外的燃烧在化学本质上虽然最终产物都是水和CO2, 所释放的能量也完全相等,但二者所进行的方式却大不相同。糖、脂肪、蛋白质在生物体 内彻底氧化之前,都先经过分解代谢,在不同的分解代谢过程中都伴有代谢物的脱氢过程 和辅酶NAD或FAD的还原。这些携带着氢离子和电子的还原型辅酶,在最终将氢离子 和电子传递给氧时,都经历一段相同的过程,即生物氧化过程。 一、生物氧化的概念 人们把有机分子在体内氧化分解成CO2和H2O并释放出能量的过程称为生物氧化 (biological oxidation)。生物氧化实际上是需氧细胞呼吸作用中的一系列氧化一还原反应, 是在细胞或组织中发生的,所以又称为细胞氧化或细胞呼吸,有时也称为组织呼吸。 二、生物氧化的特点 生物氧化是发生在生物体内的氧化一还原反应,它具有自然界物质发生氧化一还原反 应的共同特征,这主要表现在被氧化的物质总是失去电子,而被还原的物质总是得到电子, 并且物质被氧化时,总伴随能量的释放。有机物在生物体内完全氧化和在体外燃烧而被彻 底氧化,在化学本质上是相同的。例如1ol的葡萄糖在体内氧化和在体外燃烧都是产生 C02和H20,放出的总能量都是2867.5kJ。这并不奇怪,因为氧化作用释放的能量等于这 一物质所含化学能与其氧化产物所含的化学能差,放出的总能量的多少与该物质氧化的途 径无关,只要在氧化后所生成的产物相同,放出的总能量必然相同。但是,由于生物氧化 是在活细胞内进行的,故它与有机物在体外燃烧有许多不同之处,即生物氧化有它本身的 特点: (1)有机物在空气中燃烧时,C02和H20的生成是空气中氧直接与碳、氢原子结合的 产物。而有机物在细胞中氧化时,CO,是在代谢过程中经脱羧反应释放出来的,H,O的生 成则是通过更复杂的过程完成的。 (2)生物氧化是在一系列酶的催化下、在恒温恒压下进行的反应,而有机分子在体外 燃烧时需要高温。 (3)生物氧化所产生的能量是逐步发生、分次释放的。这种逐步分次的放能方式,不 会引起体温的突然升高,而且可使放出的能量得到最有效的利用。与此相反,有机物在体 外燃烧产生大量的光和热,且能量是骤然放出的。 (4)生物氧化过程中产生的能量一般都贮存于一些特殊的化合物主要是腺三磷(ATP)] 中。电子由还原型辅酶传递到氧的过程中形成大量的AP,占全部生物氧化产生能量的绝 大部分。例如,1个葡萄糖分子氧化时生成36个ATP分子,其中32个是还原型辅酶氧化 时得到的。 177
177 第八章 生物氧化与氧化磷酸化 第一节 生物氧化概述 一切生物都靠能量维持生存,生物体所需的能量大都来自体内糖、脂肪、蛋白质等有机 物的氧化。生物体内的氧化和生物体外的燃烧在化学本质上虽然最终产物都是水和 CO2, 所释放的能量也完全相等,但二者所进行的方式却大不相同。糖、脂肪、蛋白质在生物体 内彻底氧化之前,都先经过分解代谢,在不同的分解代谢过程中都伴有代谢物的脱氢过程 和辅酶 NAD+或 FAD 的还原。这些携带着氢离子和电子的还原型辅酶,在最终将氢离子 和电子传递给氧时,都经历一段相同的过程,即生物氧化过程。 一、生物氧化的概念 人们把有机分子在体内氧化分解成 CO2和 H2O 并释放出能量的过程称为生物氧化 (biological oxidation)。生物氧化实际上是需氧细胞呼吸作用中的一系列氧化-还原反应, 是在细胞或组织中发生的,所以又称为细胞氧化或细胞呼吸,有时也称为组织呼吸。 二、生物氧化的特点 生物氧化是发生在生物体内的氧化-还原反应,它具有自然界物质发生氧化-还原反 应的共同特征,这主要表现在被氧化的物质总是失去电子,而被还原的物质总是得到电子, 并且物质被氧化时,总伴随能量的释放。有机物在生物体内完全氧化和在体外燃烧而被彻 底氧化,在化学本质上是相同的。例如 1mol 的葡萄糖在体内氧化和在体外燃烧都是产生 CO2和 H2O,放出的总能量都是 2 867.5kJ。这并不奇怪,因为氧化作用释放的能量等于这 一物质所含化学能与其氧化产物所含的化学能差,放出的总能量的多少与该物质氧化的途 径无关,只要在氧化后所生成的产物相同,放出的总能量必然相同。但是,由于生物氧化 是在活细胞内进行的,故它与有机物在体外燃烧有许多不同之处,即生物氧化有它本身的 特点: (1)有机物在空气中燃烧时,CO2和 H2O 的生成是空气中氧直接与碳、氢原子结合的 产物。而有机物在细胞中氧化时,CO2是在代谢过程中经脱羧反应释放出来的,H2O 的生 成则是通过更复杂的过程完成的。 (2)生物氧化是在一系列酶的催化下、在恒温恒压下进行的反应,而有机分子在体外 燃烧时需要高温。 (3)生物氧化所产生的能量是逐步发生、分次释放的。这种逐步分次的放能方式,不 会引起体温的突然升高,而且可使放出的能量得到最有效的利用。与此相反,有机物在体 外燃烧产生大量的光和热,且能量是骤然放出的。 (4)生物氧化过程中产生的能量一般都贮存于一些特殊的化合物[主要是腺三磷(ATP)] 中。电子由还原型辅酶传递到氧的过程中形成大量的 ATP,占全部生物氧化产生能量的绝 大部分。例如,1个葡萄糖分子氧化时生成36 个 ATP 分子,其中 32 个是还原型辅酶氧化 时得到的

三、生物氧化的基本过程 需氧生物细胞内糖、脂肪、氨基酸等分子所途经的各自分解过程,将在有关章、节中 叙述。这些有机物在氧化分解途径中所形成的还原型辅酶,包括NADH和FADH:,通过 电子传递途径,使其再重新氧化。在这个过程中,还原型辅酶上的氢以质子形式脱下,其 电子沿着一系列的电子传递体转移(称为电子传递链),最终转移到分子氧,使氧激活, 质子和离子型氧(激活后的氧)结合生成水。在电子传递过程中释放的能量则使ADP和 无机磷结合形成ATP。ATP是生物体内最重要的高能中间物,参与体内众多的需能反应。 第二节生物氧化过程中的某些能量问题 一、自由能的概念 在热力学概念中对生物化学特别有用的是自由能。自由能是一个化合物分子结构中所 固有的能量,是一种能在恒温怛压下做功的能量。一种物质A自由能的含量是不能用实验 方法测得的。但是在一个化学反应中,当A转化为B时 A≥B (7.1) 其自由能的变化(△G),即A转化为B时所得到的最大的可利用的能量是可以测定的。 如果产物B自由能的含量(G)比反应物A自由能的含量(G)小,则4G为负值,即: △G=G一GA=负值(当GA>G时) 当△G为负值时,便意味者反应进行时自由能降低。同样,当B逆转为A时,自由能 则增加,亦即△G为正值。实验证明:当自由能降低(即△G为负)时反应能自发地进行: 反之,则必须采取某种方式供给能量才能推动反应进行。△G为负值的反应称为“放能反 应”(exogonic reaction),而△G为正值的反应则称为“吸能反应”(endogonic reaction) 实验还证明,虽然在某一过程中△G为负值,但与反应的速率无关。例如,葡萄糖可 被0,氧化成C0,和H,0,其方程式如下: C.H,0。+60 →6C02+6H,0 (7.2) 此反应的△G是一个很大的负值(约为2870J/mo),但是这一相当大的△G与反应速率没 有关系。当葡萄糖在一弹式量热计bomb calorimeter)中有催化剂存在时,它可在几秒钟内 发生氧化。在大多数生物体中,上述反应可在数分钟到数小时内完成,但是把葡萄糖放在 玻璃瓶中,即使有空气也可以存放数年而不氧化。 现在的化学理论认为,决定一个反应的反应速率的因子是这一过程的活化能(activation energy)。反应(7.1I)进行时必须经过一个中间物或活化的复合物即A):而由A转化为 A*必须消耗能量,如果所需的能量不大,即此反应具有较低的活化能,则反应容易进行。 如果所需的能量很大,则只有少量A能转化为B。必须供给足够的能量以克服此反应的能 量障碍,才能使反应顺利进行。催化剂包括酶在内)的作用就是降低其活化能而使反应能 够进行 反应(7.1)的自由能变化△G可表示如下: 178
178 三、生物氧化的基本过程 需氧生物细胞内糖、脂肪、氨基酸等分子所途经的各自分解过程,将在有关章、节中 叙述。这些有机物在氧化分解途径中所形成的还原型辅酶,包括 NADH 和 FADH2,通过 电子传递途径,使其再重新氧化。在这个过程中,还原型辅酶上的氢以质子形式脱下,其 电子沿着一系列的电子传递体转移(称为电子传递链),最终转移到分子氧,使氧激活, 质子和离子型氧(激活后的氧)结合生成水。在电子传递过程中释放的能量则使 ADP 和 无机磷结合形成 ATP。ATP 是生物体内最重要的高能中间物,参与体内众多的需能反应。 第二节 生物氧化过程中的某些能量问题 一、自由能的概念 在热力学概念中对生物化学特别有用的是自由能。自由能是一个化合物分子结构中所 固有的能量,是一种能在恒温怛压下做功的能量。一种物质 A 自由能的含量是不能用实验 方法测得的。但是在一个化学反应中,当 A 转化为 B 时 A B (7.1) 其自由能的变化(ΔG),即 A 转化为 B 时所得到的最大的可利用的能量是可以测定的。 如果产物 B 自由能的含量(GB)比反应物 A 自由能的含量(GA)小,则ΔG 为负值,即: ΔG = GB 一 GA = 负值 (当 GA>GB时) 当ΔG 为负值时,便意味着反应进行时自由能降低。同样,当 B 逆转为 A 时,自由能 则增加,亦即ΔG 为正值。实验证明:当自由能降低(即ΔG 为负)时反应能自发地进行; 反之,则必须采取某种方式供给能量才能推动反应进行。ΔG 为负值的反应称为“放能反 应”(exogonic reaction),而ΔG 为正值的反应则称为“吸能反应”(endogonic reaction)。 实验还证明,虽然在某一过程中ΔG为负值,但与反应的速率无关。例如,葡萄糖可 被 O2氧化成 CO2和 H2O,其方程式如下: C6H12O6+6O2 6CO2+6H2O (7.2) 此反应的ΔG 是一个很大的负值(约为 2870kJ/mol),但是这一相当大的ΔG 与反应速率没 有关系。当葡萄糖在一弹式量热计(bomb calorimeter)中有催化剂存在时,它可在几秒钟内 发生氧化。在大多数生物体中,上述反应可在数分钟到数小时内完成,但是把葡萄糖放在 玻璃瓶中,即使有空气也可以存放数年而不氧化。 现在的化学理论认为,决定一个反应的反应速率的因子是这—过程的活化能(activation energy)。反应(7.1)进行时必须经过一个中间物或活化的复合物(即 A*);而由 A 转化为 A*必须消耗能量,如果所需的能量不大,即此反应具有较低的活化能,则反应容易进行。 如果所需的能量很大,则只有少量 A 能转化为 B。必须供给足够的能量以克服此反应的能 量障碍,才能使反应顺利进行。催化剂(包括酶在内)的作用就是降低其活化能而使反应能 够进行。 反应(7.1)的自由能变化ΔG 可表示如下:

aGAc+RTn周 (7.3) 式中的△G表示标准自由能变化:R为气体常数:T为绝对温度:[4小、B份别为A 及B的浓度,单位为(mol/L) 由方程式(7.3)可见,反应的△G是反应物和产物浓度的函数,也是标准自由能变化 △G的函数。从平衡时的△G可计算出△G。在平衡时,A、B间的净变化为零,因此 自由能的变化△G亦为零。我们知道[B对A]的比值是平衡时的比值,即其平衡常数K 将这些数值代入方程式门.3),可得: 0=△G:+RTnK'a (7.4) △G0'=-RTInK'oq 式中的常数R=8.3J/mol·K,在25℃时,T=298:1nr=23031gx。方程式7.4)即为(25 ℃时)的G: G0=-8314X298X23031g”=-57061 7.5) 方程式7.5)对测定某一反应的G°值是非常有用的。如果能测出平衡时反应物和产物两者 的浓度,就可以计算出其反应的?和G。当然,如果K极大或极小时,用这个方法 来测定△G就没有什么价值了,因为这时反应物或产物的平衡浓度将小到无法测定。表 7-1表示从0.001到1000的一系列K范南内的△G”。 从表7-1可以看出,如果反应的Kg大于1,则自由能降低。在方程式(7.1)中, 假设其K=1000亦即[B/[A]为1000),则反应趋向形成B的方向。如果反应(7.1)的Kg 为0.001(亦即[B]/[A]=0.00I),则只要0.1%的A转化为B时反应就能达到平衡。如果A] =B,即反应物和产物浓度都处于单位浓度时,也可求出△G,据方程式7.3) △G=△G9+RTnl/1=△G 因此△G的定义应为当反应物和产物均为单位浓度时或更广泛地说,在“标准状态” 下的自由能变化。溶液中溶质的标准状态为单位克分子浓度,若为气体,则为101.325kPa。 当作为反应物或产物出现时,其标准状态的浓度仍然规定为1.0mo/(即pH值=0), 此时几乎所有的酶(在pH=0时)都已变性,因此就没有反应可研究了。为此,生化学家又 规定了一种修正的标准条件,除H之外,其他反应物和产物的浓度仍规定为1.0moL,pH 值规定为7.0。细胞中的反应大都发生在pH值7.0左右,除pH值=0之外,其他任何pH 值时的标准自由能变化可用△G表示,但必须说明△G的pH值。当然,如果反应中既没 有形成也没有消耗氢离子的话,则△G与pH值无关,此时△G等于△G'。在pH=7.0 的条件下所测得的自由能变化用△G表示。 表7-1K和△G间的关系 K'eg LgK'g △G(kJ/mol) 0.001 -3 17.1 0.01 11.4 01 57 1.0 0 0.0 0 57 179
179 [B] [A] Δ G G 0 =Δ , + RTln (7.3) 式中的 G 0’表示标准自由能变化;R 为气体常数;T 为绝对温度;[A]、[B]分别为 A 及 B 的浓度,单位为(mol/L)。 由方程式(7.3)可见,反应的 G 是反应物和产物浓度的函数,也是标准自由能变化 0 G 的函数。从平衡时的 G 可计算出 0 G 。在平衡时,A、 B 间的净变化为零,因此 自由能的变化 G 亦为零。我们知道[B]对[A]的比值是平衡时的比值,即其平衡常数 K’eq 将这些数值代入方程式(7.3),可得: 0=ΔG0 ’ + RTlnK’eq (7.4) ΔG0 ’= -RTlnK’eq 式中的常数 R=8.3J/mol·K,在25℃时,T=298;1nx=2.3031gx。方程式(7.4)即为(25 ℃时)的 G0 ’: G0 ’= -8.314×298×2.3031gK’eq= -5706lgK’eq (7.5) 方程式(7.5)对测定某一反应的 G0 ’值是非常有用的。如果能测出平衡时反应物和产物两者 的浓度,就可以计算出其反应的 K’eq和 G0 ’。当然,如果 K’eq极大或极小时,用这个方法 来测定ΔG0 ’就没有什么价值了,因为这时反应物或产物的平衡浓度将小到无法测定。表 7-l 表示从 0.001 到 1 000 的一系列 K’eq 范围内的ΔG0 ’。 从表 7-1 可以看出,如果反应的 K’eq大于 1,则自由能降低。在方程式(7.1)中, 假设其 K’eq=1000(亦即[B]/[A]为 1000),则反应趋向形成 B 的方向。如果反应(7.1)的 K’eq 为 0.001(亦即[B]/[A]=0.001),则只要0.1%的 A转化为 B 时反应就能达到平衡。如果[A] =[B],即反应物和产物浓度都处于单位浓度时,也可求出ΔG0 ’,据方程式(7.3) ΔG=ΔG0 ’ + RTln1/1=ΔG0 ’ 因此ΔG0 ’的定义应为当反应物和产物均为单位浓度时或更广泛地说,在“标准状态” 下的自由能变化。溶液中溶质的标准状态为单位克分子浓度,若为气体,则为 101 .325 kPa。 当 H+作为反应物或产物出现时,其标准状态的浓度仍然规定为 1.0mol/L(即 pH 值=0), 此时几乎所有的酶(在 pH=0 时)都已变性,因此就没有反应可研究了。为此,生化学家又 规定了一种修正的标准条件,除 H+之外,其他反应物和产物的浓度仍规定为1.0mol/L,pH 值规定为7.0 。细胞中的反应大都发生在pH 值 7.0 左右,除pH 值=0 之外,其他任何 pH 值时的标准自由能变化可用ΔG’表示,但必须说明ΔG’的 pH 值。当然,如果反应中既没 有形成也没有消耗氢离子的话,则ΔG’与 pH 值无关,此时ΔG0 ’ 等于ΔG’。在 pH=7.0 的条件下所测得的自由能变化用ΔG0 ’表示。 表 7-1 Keq和ΔG 0 间的关系 K’eq LgK’eq ΔG 0 ’(kJ/mol) 0.001 -3 17.1 0.01 -2 11.4 0.1 -1 5.7 1.0 0 0.0 10 1 -5.7

100 1000 -17.1 二、氧化还原电位和自由能变化 在氧化磷酸化作用中,NADH和FADH,的电子转移能(electron transfer Potential)能 够转化成ATP中磷酸基团的转移势能(Phosphate group transfer potential)。磷酸基团的转移 势能可以用磷酸化合物水解时的△G表示。而电子转移势能可用E:(即氧化还原电位)表 示。如果一种物质存在氧化态(y和还原态X),这X和X就称为氧还对(redox couple)。所 以负氧化还原电位表示一种物质对电子的亲合力比H低,而正氧化还原电位则表示一种物 质与电子的亲合力比Hz高,这种比较是在标准状态(即mol的氧化剂,lmol的还原剂 lmol的H和101.325kPa的Hz)下进行的。所以一种强还原剂如NADH有一个负的氧化 还原电位,而一种强氧化剂如0,)有一个正的氧化还原电位。表-2为生物中一些重要氧 还对的氧化还原电位。从反应物的氧化还原电位E可以计算出一个氧化还原反应的自由 能变化(△G)。 例如,丙酮酸被NADH还原的反应如下: (a)丙酮酸+NADH+H 乳酸+NAD 其中NAD:NADH+H对的氧化还原电位为0.32V,而丙酮酸:乳酸对的氧化还原电位为 0.19V,可写成: (b)丙酮酸+2H+2e一一→乳酸 E0'=-0.19V (c)NAD*+2H+2e- 一→NADH+H E=-0.32V 由(b)减(c)即可得反应(a)的E°'=-0.19-(-0.32)=+0.13V 表7-2 一些反应的标准氧化还原电位 还原剂 氧化剂 E9,(V) 琥珀酸+C0 a-酮戊 二酸 -0.67 -0.60 铁氧还蛋白(还原韵 铁氧还蛋白(氧化态) -0.43 H 2 2 -0.4 NADH+H 2 -0.3 NADPH+H NADP 2 -0.32 硫辛酸(还原态) 硫辛酸(氧化态) 、3 -0.29 乙醇 乙醛 -0.20 到酸 丙酮酸 -0.1g 球珀酸 延胡索酸 3 细胞色素b(Fe2) 细胞色素b(Fe) 2o> 抗坏血酸 脱氢抗坏血酸 2 0.08 醒(氧化态 010 细胞色素CFe 1/20+2 谷胱甘肽(还原态) 谷胱甘肽(氧化态) -0.23 180
180 100 2 -11.4 1000 3 -17.1 二、氧化还原电位和自由能变化 在氧化磷酸化作用中,NADH 和 FADH2的电子转移能( electron transfer PotentiaI)能 够转化成 ATP中磷酸基团的转移势能(Phosphate group transfer potentiaI)。磷酸基团的转移 势能可以用磷酸化合物水解时的ΔG0 ’表示。而电子转移势能可用E 0 (即氧化还原电位)表 示。如果一种物质存在氧化态(X)和还原态(X- ),这 X 和 X-就称为氧还对(redox couple)。所 以负氧化还原电位表示一种物质对电子的亲合力比 H2低,而正氧化还原电位则表示一种物 质与电子的亲合力比H2高,这种比较是在标准状态(即 lmol 的氧化剂, lmol 的还原剂, lmol 的 H+和 101.325kPa 的 H2)下进行的。所以一种强还原剂(如 NADH)有一个负的氧化 还原电位,而一种强氧化剂(如 O2)有一个正的氧化还原电位。表 7-2 为生物中一些重要氧 还对的氧化还原电位。从反应物的氧化还原电位 E 0 可以计算出一个氧化还原反应的自由 能变化(ΔG) 。 例如,丙酮酸被 NADH 还原的反应如下: (a) 丙酮酸 + NADH + H+ 乳酸+NAD+ 其中 NAD+∶NADH+H+ 对的氧化还原电位为 0.32V,而丙酮酸∶乳酸对的氧化还原电位为 0.19V,可写成: (b) 丙酮酸+2H++2e—──→乳酸 E 0 =-0.19V (c) NAD++2H++2e—──→NADH+H+ E 0 =-0.32V 由(b)减(c)即可得反应(a)的 E 0′=-0.19-(-0.32)= +0.13V 表 7-2 一些反应的标准氧化还原电位 还原剂 氧化剂 n E 0′(V) 琥珀酸+CO2 α-酮戊二酸 2 -0.67 乙醛 乙酸 2 -0.60 铁氧还蛋白(还原态) 铁氧还蛋白(氧化态) 1 -0.43 H2 2H+ 2 -0.42 NADH+H+ NAD+ 2 -0.32 NADPH+H+ NADP+ 2 -0.32 硫辛酸(还原态) 硫辛酸(氧化态) 2 -0.29 乙醇 乙醛 2 -0.20 乳酸 丙酮酸 2 -0.19 琥珀酸 延胡索酸 2 0.03 细胞色素 b(Fe2+) 细胞色素 b(Fe3+) 1 0.07 抗坏血酸 脱氢抗坏血酸 2 0.08 泛醌(还原态) 泛醌(氧化态) 2 0.10 细胞色素 C(Fe2+) 细胞色素 C(Fe3+ ) 1 0.22 H2O 1/2O2+2H+ 2 0.82 谷胱甘肽(还原态) 谷胱甘肽(氧化态) 2 -0.23

△G·与氧化还原电位E的关系如下: △G0'=-FE1 (7. 这样,我们就可以计算出丙酮酸被NADH还原时的△G,即标准自由能的变化。公式(7.6) 中n表示转移的电子数,F为法拉第的卡当量96.4/(Vmo,△G的单位为V,△的 单位为kd/mol。丙酮酸还原时的n=2,所以 △G9=-2×96.40×0.13 -25.06kJ/rnol 从公式(7.6)可看出,E为正值时,△G为负值,表示为放能反应。 另一个例子是NADH的氧化并生成H,O,其反应如下: a)1/20,+2Ht+2e-=H,0 E'=+0.82V (b)NAD'+2H+2e ≥NADH+H E"=-0.32V 以(a)-(b)即得(c: (e)1/20:+NADH+H*H:O+NAD E=1.14V 此反应的自由能变化为: AGO=-nFE =-2×96.40×1.14 =-219.79J/mol 所以说呼吸链全部的氧化还原电位的变化为114V,相当于△G为219.79/mol。 三、高能磷酸化合物 1.高能磷酸化合物的概念 生物体内磷酸化合物很多,并不是所有的磷酸化合物都是高能的,只有那些磷酸基团水 解时能释放出大量自由能的化合物称为高能磷酸化合物,这种能量称为磷酸键能。腺三磷 就是这类化合物的典型代表 腺三磷结构中的两个磷酸基团(B,Y)可从Y端依次移去而生成腺二磷(ADP)和腺一 磷(AMP)。ATP的前两个磷酸基团水解时各释放出30.5kmol能量,第三个磷酸基团(a)》 OH 三磷 “一”代表水解时产生高能的键 水解时释放出14.2水Jmol能量。一般将水解时释放出20.9k/ml以上自由能的化合物称为 高能化合物,含有高能的键称为高能键,常用“一”符号表示。这里的高能键必须与物理 化学上的高能键区别开来。在物理化学上,键能是断裂一个键所需要的能量,断键输入的 能量越多键就越稳定:而在生物化学上,高能键是指水解反应或基团转移反应中的标准自 181
181 ΔG0 ’与氧化还原电位 E 0 的关系如下: ΔG0 ’=-nF E0 (7.6) 这样,我们就可以计算出丙酮酸被 NADH 还原时的ΔG0 ’,即标准自由能的变化。公式(7.6) 中 n 表示转移的电子数,F 为法拉第的卡当量[96.4kJ/(V·mol)],ΔG0 ’的单位为 V,Δ的 单位为 kJ/mol。丙酮酸还原时的 n=2,所以 ΔG0 ’=-2×96.40×0.13 =-25.06kJ/rnol 从公式(7.6)可看出,E 0 为正值时,ΔG0 ’为负值,表示为放能反应。 另一个例子是 NADH 的氧化并生成 H2O,其反应如下: (a) 1/2O2+2H++2e— H2O E 0 =+0.82V (b) NAD++2H++2e— NADH+H+ E 0 ′=-0.32V 以(a)-(b)即得(c): (c) 1/2O2+NADH+H+ H2O+NAD+ E 0 =1.14V 此反应的自由能变化为: ΔG0 ’=-nF E0 =-2×96.40×1.14 =-219.79kJ/mol 所以说呼吸链全部的氧化还原电位的变化为 1.14V,相当于ΔG0 ’为 219.79kJ/mol。 三、高能磷酸化合物 1.高能磷酸化合物的概念 生物体内磷酸化合物很多,并不是所有的磷酸化合物都是高能的,只有那些磷酸基团水 解时能释放出大量自由能的化合物称为高能磷酸化合物,这种能量称为磷酸键能。腺三磷 就是这类化合物的典型代表。 腺三磷结构中的两个磷酸基团(β ,γ)可从γ端依次移去而生成腺二磷(ADP)和腺一 磷(AMP)。ATP 的前两个磷酸基团水解时各释放出 30.5kJ/mol能量,第三个磷酸基团(a) N N N N NH2 O OH OH H H H H O P O O O - ~ O P ~ O O - P -O O O - γ β α 腺三磷 “~” 代表水解时产生高能的键 水解时释放出 14.2kJ/mol能量。一般将水解时释放出 20.9kJ/mol 以上自由能的化合物称为 高能化合物,含有高能的键称为高能键,常用“~”符号表示。这里的高能键必须与物理 化学上的高能键区别开来。在物理化学上,键能是断裂一个键所需要的能量,断键输入的 能量越多键就越稳定;而在生物化学上,高能键是指水解反应或基团转移反应中的标准自
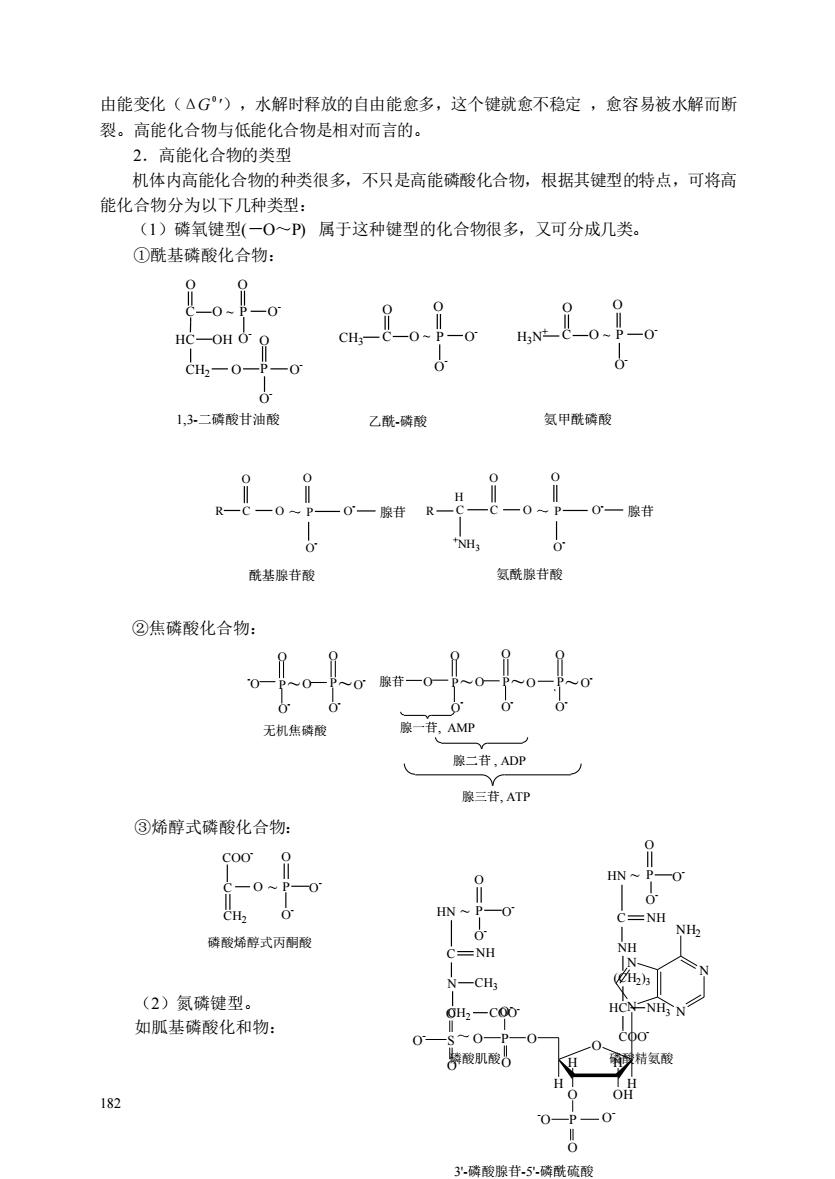
由能变化(△G),水解时释放的自由能愈多,这个键就愈不稳定,愈容易被水解而断 裂。高能化合物与低能化合物是相对而言的。 2.高能化合物的类型 机体内高能化合物的种类很多,不只是高能磷酸化合物,根据其键型的特点,可将高 能化合物分为以下几种类型: (1)磷氧键型(一0~P)属于这种键型的化合物很多,又可分成几类。 ①酰基磷酸化合物: 0 C-OH CH2一0 1,3.二磷酸甘油酸 乙酰磷酸 氨甲酰磷酸 一0一 ,一0一 NH. 酰基腺苷酸 氨酰腺酸 ②焦磷酸化合物: 0腺苷 无机焦磷 腺二苷,ADP 腺三苷,ATP ③烯醇式磷酸化合物: C00 -0 磷酸烯醇式丙酮酸 (2)氮磷键型。 如肌基磷酸化和物: 182 3.硫酸腺苷.磷酰硫酸
182 由能变化(ΔG 0 ),水解时释放的自由能愈多,这个键就愈不稳定 ,愈容易被水解而断 裂。高能化合物与低能化合物是相对而言的。 2.高能化合物的类型 机体内高能化合物的种类很多,不只是高能磷酸化合物,根据其键型的特点,可将高 能化合物分为以下几种类型: (1)磷氧键型(-O~P) 属于这种键型的化合物很多,又可分成几类。 ①酰基磷酸化合物: C CH3 CH2 OH O O O O O - O O - P HC P O - ~ C O O O O - ~ P O - H3N + C O O O O - ~ P O - 1,3-二磷酸甘油酸 乙酰-磷酸 氨甲酰磷酸 O - R C O P O - O - O ~ O 腺苷 酰基腺苷酸 C O P O - O - O ~ O 腺苷 氨酰腺苷酸 C H +NH3 R ②焦磷酸化合物: O - -O O P O O - O O - P O - O O P O O - O P O O - O O - ~ P ~ ` ~ ~ ~ 无机焦磷酸 腺一苷, AMP 腺二苷 , ADP 腺三苷, ATP 腺苷 ③烯醇式磷酸化合物: O O - O O - C P COO - CH2 磷酸烯醇式丙酮酸 ~ (2)氮磷键型。 如胍基磷酸化和物: O - O O - HN P C N CH2 NH CH3 COO - 磷酸肌酸 O O - HN P C NH (CH2 )3 NH COO - HC NH3 磷酸精氨酸 ~ ~ O - N N N N NH2 O O OH H H H H O P O O O - O - S~ O O P -O O O - 3'-磷酸腺苷-5'-磷酰硫酸
(3)硫酯键型。如活性硫酸基: (4)甲硫键型如活性甲硫氨酸 以上高能化合物中,含有磷酸基团的占绝大多数,但并不是所有含磷酸基团的化合物 都属于高能磷酸化合物。例如,葡萄糖6磷酸,甘油磷脂等化合物,水解时每摩尔只能释 放出12.54kJ的能量,属于低能磷酸化合物。 3.ATP的特殊作用 ATP在一切生物的生命活动中都起着重要作用,在细胞的细胞核、细胞质和线粒体中 都有ATP存在。 细胞中的磷酸化合物根据其水解时释放自由能的多少分为高能磷酸化合物和低能磷酸 化合物。但在不同的磷酸化合物之间,△G,的大小并没有明显的高能和低能的界限,从 表7-3中可以看出△G:值是逐步下降的。ATP所释放的自由能值正处在中间位置。在ATP 以上的任何一种磷酸化合物都倾向于将它的磷酸基团转移给在它以下的磷酸受体分子。例 如,ADP能接受在ATP以上的磷酸基团。同样,ATP倾向于将其磷酸基团转移给在它以 下的受体,如葡萄糖6-磷酸。表7-3清晰表明了不同磷酸化合物其磷酸基团转移的热力学 趋势或转移势能的大小(一般用无方向的正值表示)。 表7-3某些磷酸化合物水解的标准自由能变化 化合物 G (kJ/mol) 磷酸基团转移势能△G(h1) 磷酸烯醇式丙酮酸 -61.9 61.9 3磷酸甘油酸磷酸 -49.3 40.3 磷酸肌酸 -43.1 81 乙能磷 -42.3 423 磷酸精氨酸 -32.2 322 ATP(一ADP4Pi) -30.5 30.5 ADP(→AMP+Pi) -30.5 30.5 A(一聚+Pi) -14.2 14.2 葡萄糖-1磷酸 -20.9 20.9 果糖-心酸 -15.9 159 葡萄糖-6薛酸 -13.8 13.8 甘油1酸 ATP在磷酸化合物中所处的位置具有重要的意义,它在细胞的酶促磷酸基团转移中是 一个“共同中间体”。ADP可以接受表73中在它以上的化合物的磷酸基团,所形成的 ATP可将磷酸基团转移给其他的受体,形成在ATP以下的磷酸化合物。ATP作为磷酸基 团共同中间传递体的作用可用图7表示。由图7-】可以看出,AP是能量的携带者和转 运者,但并不是能量的贮存者。起贮存能量作用的物质称为磷酸原,在脊推动物中是磷酸
183 (3)硫酯键型。如活性硫酸基: (4)甲硫键型 如活性甲硫氨酸 以上高能化合物中,含有磷酸基团的占绝大多数,但并不是所有含磷酸基团的化合物 都属于高能磷酸化合物。例如,葡萄糖-6-磷酸,甘油磷脂等化合物,水解时每摩尔只能释 放出 12.54kJ 的能量,属于低能磷酸化合物。 3.ATP 的特殊作用 ATP 在一切生物的生命活动中都起着重要作用,在细胞的细胞核、细胞质和线粒体中 都有 ATP 存在。 细胞中的磷酸化合物根据其水解时释放自由能的多少分为高能磷酸化合物和低能磷酸 化合物。但在不同的磷酸化合物之间,ΔG 0 的大小并没有明显的高能和低能的界限,从 表 7-3 中可以看出ΔG 0 值是逐步下降的。ATP 所释放的自由能值正处在中间位置。在 ATP 以上的任何一种磷酸化合物都倾向于将它的磷酸基团转移给在它以下的磷酸受体分子。例 如,ADP能接受在 ATP以上的磷酸基团。同样,ATP倾向于将其磷酸基团转移给在它以 下的受体,如葡萄糖-6-磷酸。表 7-3 清晰表明了不同磷酸化合物其磷酸基团转移的热力学 趋势或转移势能的大小(一般用无方向的正值表示)。 表 7-3 某些磷酸化合物水解的标准自由能变化 化合物 ΔG 0 ′ (kJ/mol) 磷酸基团转移势能ΔG 0 ′(kJ/mol) 磷酸烯醇式丙酮酸 -61.9 61.9 3-磷酸甘油酸磷酸 -49.3 49.3 磷酸肌酸 -43.1 43.1 乙酰磷酸 -42.3 42.3 磷酸精氨酸 -32.2 32.2 ATP(→ADP+Pi) -30.5 30.5 ADP(→AMP+Pi) -30.5 30.5 AMP(→腺苷+Pi) -14.2 14.2 葡萄糖-1-磷酸 -20.9 20.9 果糖-6-磷酸 -15.9 15.9 葡萄糖-6-磷酸 -13.8 13.8 甘油-1-磷酸 -9.2 9.2 ATP 在磷酸化合物中所处的位置具有重要的意义,它在细胞的酶促磷酸基团转移中是 一个“共同中间体”。 ADP 可以接受表 7-3 中在它以上的化合物的磷酸基团,所形成的 ATP 可将磷酸基团转移给其他的受体,形成在 ATP 以下的磷酸化合物。ATP 作为磷酸基 团共同中间传递体的作用可用图 7-l 表示。由图 7-1 可以看出,ATP 是能量的携带者和转 运者,但并不是能量的贮存者。起贮存能量作用的物质称为磷酸原,在脊推动物中是磷酸
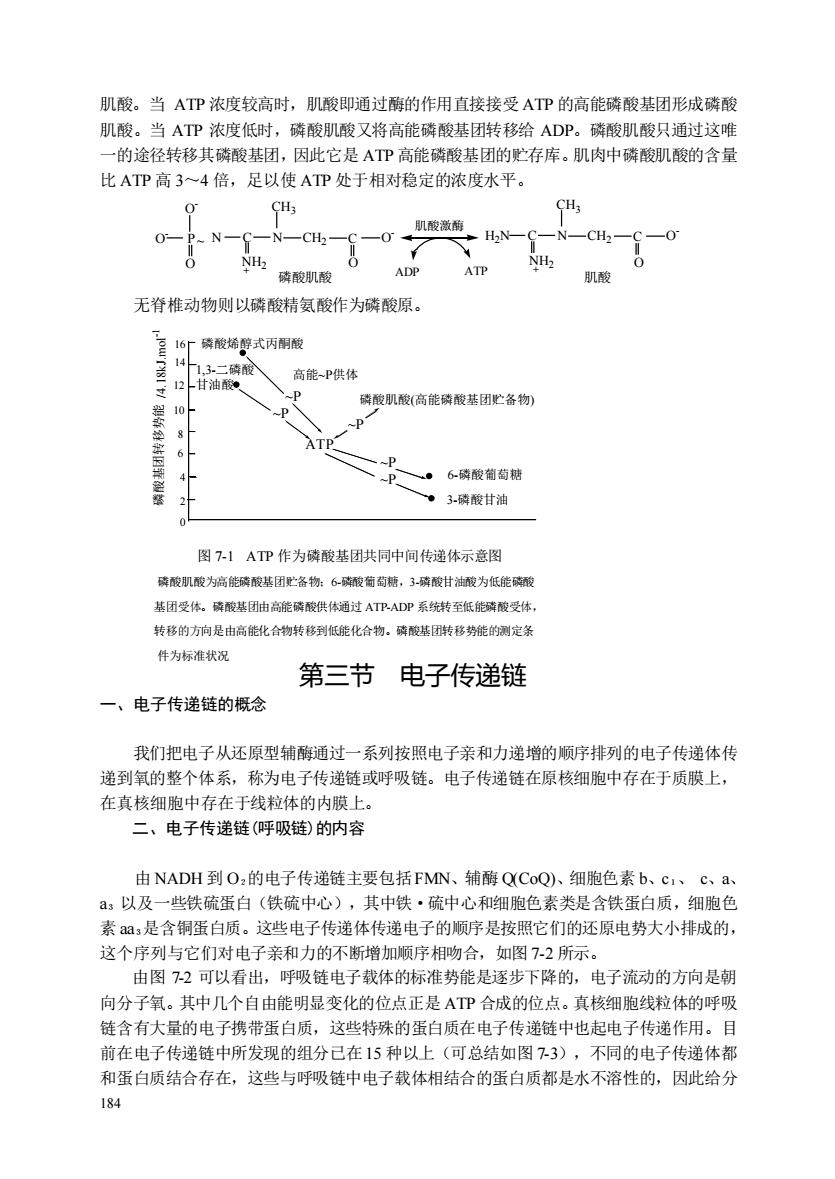
肌酸。当ATP浓度较高时,肌酸即通过酶的作用直接接受ATP的高能磷酸基团形成磷酸 肌酸。当ATP浓度低时,磷酸肌酸又将高能磷酸基团转移给ADP。磷酸肌酸只通过这唯 一的途径转移其磷酸基团,因此它是ATP高能磷酸基团的贮存库。肌肉中磷酸肌酸的含量 比ATP高34倍,足以使ATP处于相对稳定的浓度水平。 CH O-P-N-G-N-CH一C一0 -0 0 NH2 0 磷酸肌酸 ADP ATP 无脊椎动物则以磷酸精氨酸作为磷酸原。 16厂磷酸烯醇式丙酮酸 高能P供体 磷酸肌酸(高能磷酸基团贮备物) p ATP P 。6-砖酸葡萄糖 3磷酸甘油 图7-!ATP作为磷酸基团共同中间传递体示意图 磷酸肌酸为高能破酸基团贮备物:6硫酸荷萄糖,3磷酸甘油酸为低能砖耐 基团受体。磷酸基团由高能磷酸供体通过ATPADP系统转至低能磷酸受体。 转移的方向是由高能化合物转移到低能化合物。磷酸基团转移势能的测定条 件为标准状况 第三节电子传递链 一、电子传递链的概念 我们把电子从还原型辅酶通过一系列按照电子亲和力递增的顺序排列的电子传递体传 递到氧的整个体系,称为电子传递链或呼吸链。电子传递链在原核细胞中存在于质膜上, 在真核细胞中存在于线粒体的内膜上。 二、 电子传递链(呼吸链)的内容 由NADH到O,的电子传递链主要包括FMN、辅酶QCoQ)、细胞色素b、c1、c、a、 :以及一些铁硫蛋白(铁硫中心),其中铁·硫中心和细胞色素类是含铁蛋白质,细胞色 素,是含铜蛋白质。这些电子传递体传递电子的顺序是按照它们的还原电势大小排成的, 这个序列与它们对电子亲和力的不断增加顺序相吻合,如图7-2所示。 由图-2可以看出,呼吸链电子载体的标准势能是逐步下降的,电子流动的方向是朝 向分子氧。其中几个自由能明显变化的位点正是AP合成的位点。真核细胞线粒体的呼吸 链含有大量的电子携带蛋白质,这些特殊的蛋白质在电子传递链中也起电子传递作用。目 前在电子传递链中所发现的组分己在15种以上(可总结如图7-3),不同的电子传递体都 和蛋白质结合存在,这些与呼吸链中电子载体相结合的蛋白质都是水不溶性的,因此给分 184
184 肌酸。当 ATP 浓度较高时,肌酸即通过酶的作用直接接受 ATP 的高能磷酸基团形成磷酸 肌酸。当 ATP 浓度低时,磷酸肌酸又将高能磷酸基团转移给 ADP。磷酸肌酸只通过这唯 一的途径转移其磷酸基团,因此它是 ATP 高能磷酸基团的贮存库。肌肉中磷酸肌酸的含量 比 ATP 高 3~4 倍,足以使 ATP 处于相对稳定的浓度水平。 O - O - O - P 磷酸肌酸 N O C N CH3 NH2 CH2 C O O - H2N C N CH3 NH2 CH2 C O 肌酸 肌酸激酶 ADP ATP ~ + + 无脊椎动物则以磷酸精氨酸作为磷酸原。 2 4 6 8 10 12 14 16 0 ~P ~P ~P ~P ~P ATP 磷酸烯醇式丙酮酸 1,3-二磷酸 甘油酸 高能~P供体 磷酸肌酸(高能磷酸基团贮备物) 6-磷酸葡萄糖 磷 3-磷酸甘油 酸基团转移势能 /4.18kJ.mol -1 图 7-1 ATP 作为磷酸基团共同中间传递体示意图 磷酸肌酸为高能磷酸基团贮备物;6-磷酸葡萄糖,3-磷酸甘油酸为低能磷酸 基团受体。磷酸基团由高能磷酸供体通过 ATP-ADP 系统转至低能磷酸受体, 转移的方向是由高能化合物转移到低能化合物。磷酸基团转移势能的测定条 件为标准状况 第三节 电子传递链 一、电子传递链的概念 我们把电子从还原型辅酶通过一系列按照电子亲和力递增的顺序排列的电子传递体传 递到氧的整个体系,称为电子传递链或呼吸链。电子传递链在原核细胞中存在于质膜上, 在真核细胞中存在于线粒体的内膜上。 二、电子传递链(呼吸链)的内容 由 NADH 到 O2的电子传递链主要包括FMN、辅酶 Q(CoQ)、细胞色素 b、c1、 c、a、 a3 以及一些铁硫蛋白(铁硫中心),其中铁·硫中心和细胞色素类是含铁蛋白质,细胞色 素 aa3是含铜蛋白质。这些电子传递体传递电子的顺序是按照它们的还原电势大小排成的, 这个序列与它们对电子亲和力的不断增加顺序相吻合,如图 7-2 所示。 由图 7-2 可以看出,呼吸链电子载体的标准势能是逐步下降的,电子流动的方向是朝 向分子氧。其中几个自由能明显变化的位点正是 ATP 合成的位点。真核细胞线粒体的呼吸 链含有大量的电子携带蛋白质,这些特殊的蛋白质在电子传递链中也起电子传递作用。目 前在电子传递链中所发现的组分已在15 种以上(可总结如图 7-3),不同的电子传递体都 和蛋白质结合存在,这些与呼吸链中电子载体相结合的蛋白质都是水不溶性的,因此给分

离提取和研究这些蛋白质造成很多困难。这也正是当前研究工作者致力解决的问题。 0.4 NADH→EFMN -0.2 ATPFADH 00 Co ATP 4+0.2 aa +0.4 +0.6 -ATP 02 电子流动方向 图7-2电子传递次序 电子传递体从NAD州(一O32V)到氧(+0.82V按照还原性电势大小的排列顺学 -NAD-E-FMN CoQ-bs62一bs66-Fe-S-C一C-a as CuA Cugl-02 第I组(setI) 第Ⅱ组(set) 第Ⅲ组(set) 图7-3呼吸链的全部电子载体组合 三、与呼吸链有关的酶和电子载体 1.吡啶核苷酸类 许多代谢中间物的脱氢都是通过脱氢酶的作用,这些不同的脱氢酶都以NAD或 NADP作为电子受体。这类酶催化的反应如下: 还原形底物+NAD 氧化形底物+NADH+H 不原形底物+NADP+ 氧化形底物+NADPH+H 大多数脱氢酶都以NAD为辅酶,有的以NADP*为辅酶,如6磷酸葡萄糖脱氢酶就是以 NADP作为电子受体。极少数的酶能用NAD或NADP两种辅酶,如谷氨酸脱氢酶。 这类酶与NAD(P)相关的脱氢酶,有些分布在胞液中,有些分布在线粒体中,也有些 既存在于胞液也存在于粒体中。这类髓的脱氢机制如下式 脱氢酶脱掉底物上的两个氢原子,其中一个氢原子以氢阴离子(:H)的形式转移到 NAD或NADP*上,另一个则以氢离子H)形式游离到溶液中。每一个氢阴离子(:H) 携带着2个电子,其中1个电子使氢以原子形式结合到啶环的第四位C原子上,另一个 电子与吡啶环的氮原子结合,使氮原子从5价变为3价。 185
185 离提取和研究这些蛋白质造成很多困难。这也正是当前研究工作者致力解决的问题。 NADH CoQ C1 C O2 ATP FADH2 +0.8 +0.6 +0.4 +0.2 0.0 -0.2 -0.4 E-FMN b a a3 ATP ATP E 0' (volts) 电子流动方向 图 7-2 电子传递次序 电子传递体从 NADH(-0.32V)到氧(+0.82V)按照还原性电势大小的排列顺序 NAD E-FMN FeS1 Fes2 FeS5 FeS4 FeS3 CoQ b562 b566 Fe S C1 C O2 [a a3 CuA CuB] 第Ⅰ组 (setⅠ) 第Ⅱ组 (setⅡ) 第Ⅲ组 (setⅢ) 化 底 物 待 氧 图 7-3 呼吸链的全部电子载体组合 第Ⅰ组中至少含有 5 种铁硫中心;第Ⅱ组中含有 2 种不同的细胞色素 b 和 l 种与组合Ⅰ不同的铁硫中心; 第Ⅲ组中除细胞色素 a、 a3外还含有两个铜离子,这些氧化一还原中心的确切序列和功能尚未弄清。 三、与呼吸链有关的酶和电子载体 1.吡啶核苷酸类 许多代谢中间物的脱氢都是通过脱氢酶的作用,这些不同的脱氢酶都以 NAD+或 NADP+作为电子受体。这类酶催化的反应如下: 还原形底物+NAD+ 氧化形底物+NADH+H+ 还原形底物+NADP+ 氧化形底物+NADPH+H+ 大多数脱氢酶都以 NAD+为辅酶,有的以 NADP+为辅酶,如 6-磷酸葡萄糖脱氢酶就是以 NADP+作为电子受体。极少数的酶能用 NAD+或 NADP+两种辅酶,如谷氨酸脱氢酶。 这类酶与 NAD+(P +)相关的脱氢酶,有些分布在胞液中,有些分布在线粒体中,也有些 既存在于胞液也存在于线粒体中。这类酶的脱氢机制如下式。 脱氢酶脱掉底物上的两个氢原子,其中一个氢原子以氢阴离子(﹕H - )的形式转移到 NAD+或 NADP+上,另一个则以氢离子(H+ )形式游离到溶液中。每一个氢阴离子(﹕H - ) 携带着 2 个电子,其中 1 个电子使氢以原子形式结合到吡啶环的第四位 C 原子上,另一个 电子与吡啶环的氮原子结合,使氮原子从 5 价变为 3 价
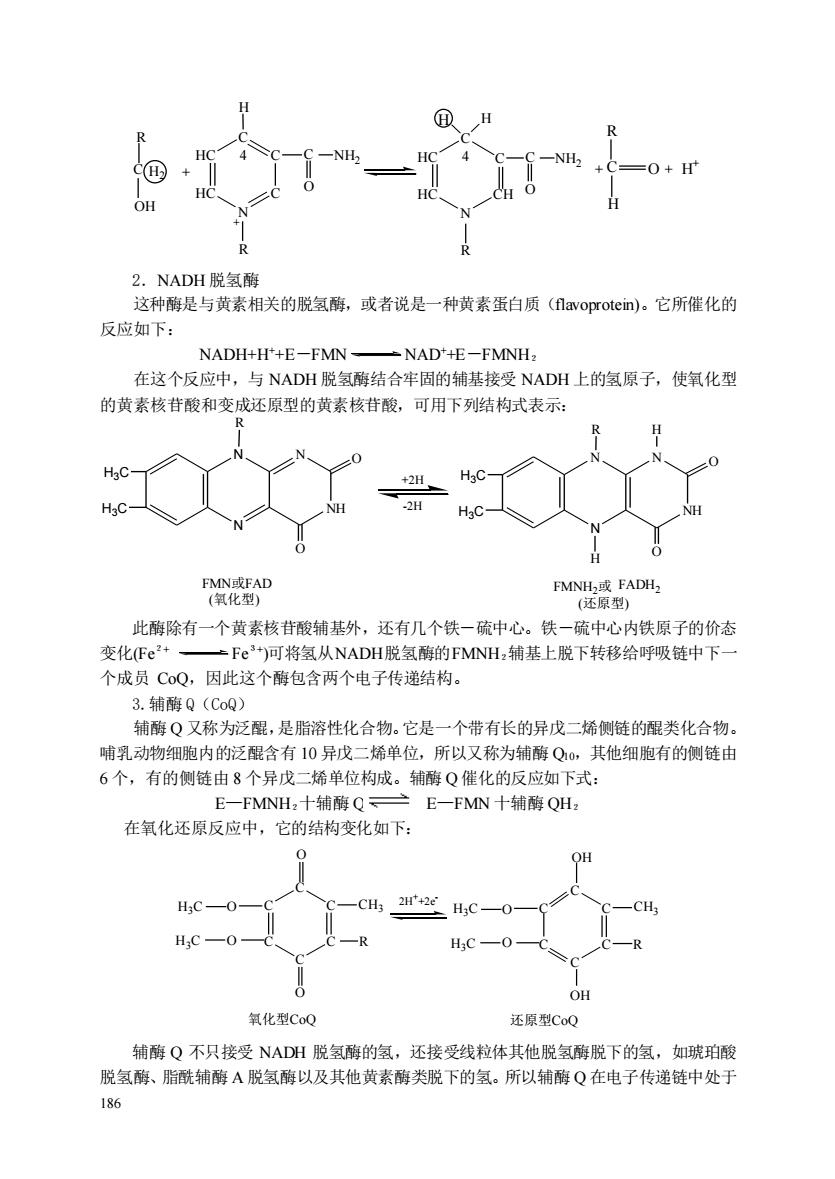
2.NADH脱氢 这种酶是与黄素相关的脱氢酶,或者说是一种黄素蛋白质(1 lavoprotein)。它所催化的 反应如下: NADH+H'+E-FMN- NADt+E一FMNH, 在这个反应中,与NADH脱氢酶结合牢固的辅基接受NADH上的氢原子,使氧化型 的黄素核苷酸和变成还原型的黄素核苷酸,可用下列结构式表示: FMNH或FADH2 (还原型) 此酶除有一个黄素核苷酸辅基外,还有几个铁一硫中心。铁一硫中心内铁原子的价态 变化Fe2+一 二Fe3)可将氢从NADH脱氢酶的FMNH,辅基上脱下转移给呼吸链中下 个成员C0Q,因此这个酶包含两个电子传递结构。 3.辅酶Q(CoQ) 辅酶Q又称为泛醒,是脂溶性化合物。它是一个带有长的异戊二烯侧链的醌类化合物。 哺乳动物细胞内的泛醌含有10异戊二烯单位,所以又称为辅酶Q,其他细胞有的侧链由 6个,有的侧链由8个异戊二烯单位构成。辅酶Q催化的反应如下式: E一FMNH,十辅酶Q一 :E一FMN十辅酶QHz 在氧化还原反应中,它的结构变化如下 0 OH HC—0 -CH3 H3C CH H;C-0 H,C—0 OH 氧化型CoQ 还原型CoQ 辅酶Q不只接受NADH脱氢酶的氢,还接受线粒体其他脱氢酶脱下的氢,如琥珀酸 脱氢酶、脂酰辅酶A脱氢酶以及其他黄素酶类脱下的氢。所以辅酶Q在电子传递链中处于 186
186 HC HC N C C C C O NH2 H R + 4 HC HC N CH C C C O NH2 R 4 H H R C OH H2 + + R C O H H + + 2.NADH 脱氢酶 这种酶是与黄素相关的脱氢酶,或者说是一种黄素蛋白质(flavoprotein)。它所催化的 反应如下: NADH+H++E-FMN NAD++E-FMNH2 在这个反应中,与 NADH 脱氢酶结合牢固的辅基接受 NADH 上的氢原子,使氧化型 的黄素核苷酸和变成还原型的黄素核苷酸,可用下列结构式表示: NH N N N O R H3C H3C O NH N N N O R H3C H3C O H H +2H -2H FMN或FAD (氧化型) FMNH2或 (还原型) FADH2 此酶除有一个黄素核苷酸辅基外,还有几个铁-硫中心。铁-硫中心内铁原子的价态 变化(Fe2+ Fe3+ )可将氢从NADH脱氢酶的FMNH2辅基上脱下转移给呼吸链中下一 个成员 CoQ,因此这个酶包含两个电子传递结构。 3.辅酶 Q(CoQ) 辅酶 Q 又称为泛醌,是脂溶性化合物。它是一个带有长的异戊二烯侧链的醌类化合物。 哺乳动物细胞内的泛醌含有 10 异戊二烯单位,所以又称为辅酶 Q10,其他细胞有的侧链由 6 个,有的侧链由 8 个异戊二烯单位构成。辅酶 Q 催化的反应如下式: E—FMNH2十辅酶 Q E—FMN 十辅酶 QH2 在氧化还原反应中,它的结构变化如下: C C C C C C CH3 O O H3C H3C O O C C C C C C CH3 OH OH H3C H3C O R O R 2H ++2e - 氧化型CoQ 还原型CoQ 辅酶 Q 不只接受 NADH 脱氢酶的氢,还接受线粒体其他脱氢酶脱下的氢,如琥珀酸 脱氢酶、脂酰辅酶 A 脱氢酶以及其他黄素酶类脱下的氢。所以辅酶 Q 在电子传递链中处于