
Chapter 5 Redox titration (Oxidimetry) Lecture 1
1 Chapter 5 Redox titration (Oxidimetry) Lecture 1

第五章 氧化还原滴定法 Redox titration 一、 氧化还原反应平衡Redox equilibrium 二、氧化还原反应进行的程度Reaction completeness 三、氧化还原反应的速率与影响因素 Rate of reaction and influencing factors 四、氧化还原滴定指示剂Redox indicators 五、氧化还原滴定原理Oxidimetric principle 六、氧化还原滴定前的预处理Pretreatment 七、常用的氧化还原滴定法Common used titration 2
2 第五章 氧化还原滴定法 Redox titration 一、氧化还原反应平衡 Redox equilibrium 二、氧化还原反应进行的程度 Reaction completeness 三、氧化还原反应的速率与影响因素 Rate of reaction and influencing factors 四、氧化还原滴定指示剂 Redox indicators 五、氧化还原滴定原理 Oxidimetric principle 六、氧化还原滴定前的预处理 Pretreatment 七、常用的氧化还原滴定法 Common used titration

A brief introduction 1、氧化还原滴定: 以氧化还原反应为基础的滴定分析方法 2、实质:电子转移 3、特点:)机理复杂、多步反应 2)有的程度虽高但速度缓慢 3)有的伴有副反应而无明确计量关系 4、分类:碘量法、高锰酸钾法、重铬酸钾法、 亚硝酸钠法、溴量法、铈量法 5、应用:广泛,直接或间接测定无机物、有机物
3 A brief introduction 1、氧化还原滴定: 以氧化还原反应为基础的滴定分析方法 2、实质:电子转移 3、特点:1)机理复杂、多步反应 2)有的程度虽高但速度缓慢 3)有的伴有副反应而无明确计量关系 4、分类:碘量法、高锰酸钾法、重铬酸钾法、 亚硝酸钠法、溴量法、铈量法 5、应用:广泛,直接或间接测定无机物、有机物

氧化还原反应平衡 Redox equilibrium 氧化还原反应一电子的转移 Ox1 Red2 Red1+Ox2 由电对电位FOx/Red的高低判断反应方向 4
4 一、 氧化还原反应平衡 Redox equilibrium 氧化还原反应—电子的转移 Ox1 + Red2 = Red1 + Ox2 由电对电位 EOx/ Red 的高低判断反应方向
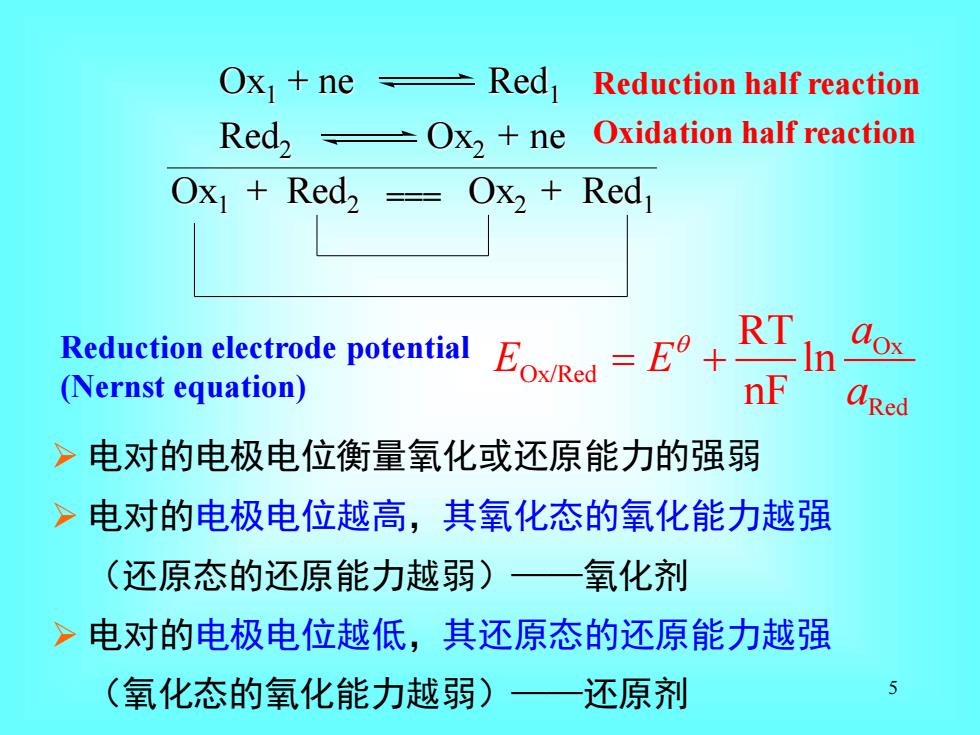
Ox1+ne±Red1 Reduction half reaction Red,Ox2 ne Oxidation half reaction Ox Red2 -Ox2 Red Redction trode potential E RT (Nernst equation) nF aRed >电对的电极电位衡量氧化或还原能力的强弱 >电对的电极电位越高,其氧化态的氧化能力越强 (还原态的还原能力越弱) 氧化剂 >电对的电极电位越低,其还原态的还原能力越强 (氧化态的氧化能力越弱)》 还原剂
5 ➢ 电对的电极电位衡量氧化或还原能力的强弱 ➢ 电对的电极电位越高,其氧化态的氧化能力越强 (还原态的还原能力越弱)——氧化剂 ➢ 电对的电极电位越低,其还原态的还原能力越强 (氧化态的氧化能力越弱)——还原剂 Ox1 + ne Red1 Red2 Ox2 + ne Ox1 + Red2 Ox2 + Red1 Oxidation half reaction Reduction half reaction Ox Ox/Red Red RT ln nF a E E a = + Reduction electrode potential (Nernst equation) ===

电对与化学反应 电对的标准电势越大,氧化态的氧化性越强; 标准电势越小,还原态的还原性越强。 以下两个半反应 Ox+neRed1,E8x1/Red Ox2+n2e←→Red2, EOxz/Red2 如果E8x1/Red,>E8x2/Red2,化学反应即为 Ox1+Red2←→Ox2+Red1 Eox1/Red1逐渐减小;Eox2/Red2逐渐增大。化学反应至 Eox1/Red1=Eox2/Redz时停止(达到平衡)
电对与化学反应 电对的标准电势越大,氧化态的氧化性越强; 标准电势越小,还原态的还原性越强。 以下两个半反应 Ox1 + n1e ↔ Red1 , Ox2 + n2e ↔ Red2 , 如果 > ,化学反应即为 Ox1 + Red2 ↔ Ox2 + Red1 逐渐减小; 逐渐增大。化学反应至 = 时停止(达到平衡)

(一)电极电位的Nernst表示式 Nernst representative expressions of electrode potential 7
7 (一)电极电位的Nernst表示式 Nernst representative expressions of electrode potential

1.活度表示式 Activity expression dox nF ARed Ba-E+00591g (25C) n aged 2.浓度表示式Concentration expression .dox=Yox[Ox],aRed =YRed[Red] →Bna=E°+00591g[0N n YRea[Red] =E9+0059, 0.059。[0x] g n YRed n [Red] 8
8 1. 活度表示式 Activity expression Ox Ox/Red Red RT ln nF a E E a = + Ox 0 Ox/Red Red 0.059 lg (25 C) n a E E a = + Ox Ox Red Red a a = = [Ox] [Red] , Ox Ox/Red Red Ox Red 0.059 [Ox] lg [Red] 0.059 0.059 [Ox] lg lg [Red] E E n E n n = + = + + 2. 浓度表示式 Concentration expression

3.分析浓度表示式Formal expression [Ox]=Cox,[Red]=CRad CRed →ER=E°+00591g2ma n YRedOOxCRed -E0+0059 goaa+0059 g Cox n YRedOx n Red (二)标准电极电位Standard electrode potential E→标准电极电位 n→半反应中的电子转移数 当aox=akaa=lmol/L时→ERad=E(附表6.13,P206) 影响因素:常数,仅与电对本身性质和温度有关
9 3.分析浓度表示式 Formal expression (二)标准电极电位 Standard electrode potential n → 半 反 应 中 的 电 子 转 移 数 影响因素:常数,仅与电对本身性质和温度有关 Ox Red Ox Red [Ox] [Red] c c = = , Ox Red Ox Ox/Red Red Ox Red Ox Red Ox Red Ox Red 0.059 lg n 0.059 0.059 lg lg n n c E E c c E c = + = + + E →标准电极电位 Ox Red Ox/Red a a E E 1mol / L 当 = = = 时 (附表6.13, P206 )

可逆电对:Reversible redox couple 在反应的任一瞬间,都能建立起平衡,符 合能斯特公式。 Fe3+/Fe2+,I/I-,Fe(CN)3-/Fe(CN)4 不可逆电对:Irreversible redox couple 不能在反应的任一瞬间建立起平衡,实际 电位与理论电位相差较大。以能斯特公式计算 所得的结果,仅作参考。 Mn0+Mn2+,Cr,0,2/Cr3+,S4062-1S2032
10 可逆电对:Reversible redox couple 在反应的任一瞬间,都能建立起平衡,符 合能斯特公式。 Fe3+ /Fe2+ , I2 /I-, Fe(CN)6 3- /Fe(CN)6 4- 不可逆电对:Irreversible redox couple 不能在反应的任一瞬间建立起平衡,实际 电位与理论电位相差较大。以能斯特公式计算 所得的结果,仅作参考。 MnO4- /Mn2+ ,Cr2O7 2- /Cr3+ ,S4O6 2- /S2O3 2-