
第1章 无机材料组成 内容提要 同任何材料一样,无机材料学科研究的是无机材料组成(结构) 制备与合成(工艺过程)、性质(性能)和使用能效四要素之间的内在 联系与制约规律。其中无机材料的组成与结构是无机材料的基本表征。 组成是指无机材料的构成物质单元(分子、原子或离子等质点)及其占 有比率;结构则为质点在空间的排列结合方式与相互作用关系。组成是 无机材料工艺学的重要研究对象之一。 本章在叙述陶瓷、玻璃、水泥、耐火材料四种典型无机材料有关组 成的基本内容,包括组成表示方法、组成中各组分的作用或组成设计等 的基础上,重点介绍传统陶瓷、玻璃、水泥、耐火材料及其相应新材料 的组成,为进一步了解和掌握无机材料组成与结构-工艺过程-性能之 间的依从关系,指导预期性质的新材料品种的开发提供必要的知识。 1.1玻璃组成 玻璃组成是决定玻璃物理化学性质的主要因素。 1.1.1玻璃组成演变与发展 自然界存在的天然玻璃包括: (1)由于火山活动使地下岩浆变为熔岩喷出,待急冷后形成的玻 璃质,称为嘿曜石 (2)陨石坠落地球表面时急热急冷变为玻璃质,称为冲击岩玻 璃 (3)月球玻璃。 中国古代多采用Na2O-BaO-PbO-SiO2系统,而古埃及玻璃则属 Na2O-CaO-SiO2系统。 最广泛采用的工业玻璃组成是以SiO2为主要网络形成体的硅酸盐 玻璃。根据玻璃中主要成分的种类可将硅酸盐玻璃分为五大类,其组成 范围如表1-1所示,其中超过90%的玻璃制品属钠钙硅酸盐系统

表1常见硅酸盐玻璃的组成% 序号玻璃类型 SiO:B:O:Al:O:Cao Mgo Na:O K:o PbO As:O Sb:O 的钙硅酸盐玻璃(软 1 成璃用平 0 0-7 印硅酸盐玻璃。用于 3 仪器、封接玻璃 2-102-10 4 556 10-202-10 51051035-6网05 高新技术的飞速发展,对玻璃材料的性能提出了各种新的要求,由 此推动玻璃新系统、新品种的研究和开发,从而发展出各种具有优异性 能的特种玻璃。目前玻璃组成几乎涉及周期表所有元素。 1.1.2玻璃组成中主要氧化物作用 1.1.2.1驶璃结构中阳离子的分类 根据查哈里阿生关于玻璃无规则网络结构学说的观点,一般可按元 素与氧结合的单键强度(即化合物离解能与配位数之商)的大小和能否 生成玻璃,将氧化物分为网络形成体、网络改变体、和网络中间体三大 A网络形成体 能单独生成玻璃,如SiO2、B2O、PzO、GcO2、AsO等,在玻璃 中能形成各自特有的网络体系。下-0键(F代表网络生成离子)是共价、 离子混合键,F-0单键强度较大,一般>335kJ/mol。阳离子(P)的配 位数是3或4,阴离子0的配位数为2。配位多面体F0或下0, 一般以顶角相连 B网络改变体 也称网络外体,不能单独生成玻璃,一般处于网络之外。M0键 (M代表网络外离子),主要是离子键,电场强度较小,单键强度< 250k/mol。常见的网络外体离子有:Li、Na、K*、Mg、Ca2、Sr2 Ba等:。其中氧离子O2易于摆脱阳离子的束缚,是“游离氧的提供者, 起断网作用,但其阳离子(特别是高电荷的阳离子)又是断键的积聚者。 2

这一特性对玻璃的析晶有一定的作用。当阳离子M的电场强度较小时, 断网作用是主要方面:而当电场强度较大时,积聚作用是主要方面。 C网络中间体 般不能单独生成玻璃,其作用介于网络生成体和网络外体之间。 0(1代表中间体离子)键具有一定的共价性,但离子性占主要。单键 强度250-335 kJ/moI。.阳离子的配位数一般为6。但在夺取“游离氧”后配 位数可以变成4。当配位数26时,阳离子处于网络之外,与网络外体的 作用相似。当配位数为4时,能参加网络,起网络生成体的作用(又称 补网作用)。 常见的中间体氧化物有:B203、Mg0、Zn0、Ah03、Ga203、Ti0, 等。中间体氧化物同时存在夺取和给出“游离氧”的倾向。 1.12.2氧化物在我璃中的作用 (1)SiO2。是主要玻璃形成氧化物,以硅氧四面体[SO]为结构单 元形成不规则的连续网络,成为玻璃骨架。 在NaO-CaO-SiO2或称钠钙硅酸盐玻璃中,SiO2能降低玻璃的热 膨胀系数,提高玻璃的热稳定性、化学稳定性、软化温度、耐热性、使 度、机械强度、黏度、透紫外光和介电性能。但其含量较高时,需要较 高的熔制温度,而且可能引起析晶。 (2)B,05。是玻璃的形成氧化物,以刚氧三角体[BO]和硼氧四面 体BO]为结构单元,在硼硅酸盐玻璃中与硅氧四面体共同组成结构网 络。 氧化硼能降低玻璃的热膨胀系数,提高玻璃的热稳定性、化学稳定 性,增加玻璃的折射率,改善玻璃的光泽,提高玻璃的机械强度能降 低电导。当B,O,引入量过高时,由于BO]增多,玻璃的热膨胀系数反 而增大,发生“硼反常现象”。BO,在高温时能降低玻璃的黏度,而在 低温时则提高玻璃的黏度。黏度还与含量有关,在高于12%时黏度增 加。所以含B03较高时的玻璃,成型温度范围较狭窄,因此可以提高 机械拉引速度。B,O,还起助熔剂的作用,可加速玻璃液的澄清、同时 降低玻璃的结晶能力。B03常随水蒸气而挥发,硼硅酸盐玻璃的液面 因B,O,的挥发减少,会产生SO2的结晶料皮。BO,是耐热玻璃、化学 3

仪器玻璃、部分光学玻璃、电真空玻璃以及其他特种玻璃的重要组分, (3)P2O5。是玻璃形成氧化物,通常以磷氧四面体PO]形成磷酸 盐玻璃的结构网络。Pz0,提高玻璃的色散系数和通过紫外线的能力,但 会降低玻璃化学稳定性。单纯的磷酸盐玻璃极易水解。PO5常用于制造 光学玻璃和透紫外线玻璃。 (4)A1z03。属于中间体氧化物,当玻璃中的Na0与A1,O3的摩 尔比大于1时,形成铭氧四面体A1O]并与硅氧四面体SiO]组成连续 的网状结构。当Na20与A1O的摩尔比小于1时,则形成八面体A1O6] 以网络外体的形式处于硅氧结构网中的空穴中。 A1O能降低玻璃的结晶倾向和电导,提高玻璃的化学稳定性、热 稳定性、机械强度、硬度和折射率,减轻玻璃液对耐火材料的侵蚀,并 有利于氧化物的乳油。A1,O,会使玻璃的黏度提高。绝大多数玻璃引入 1%-3%,一般不超过8%-10%,特种玻璃有高达20%以上的 (5)Na,O。是玻璃网络外体氧化物,Na居于玻璃网络的空穴中。 NO能提供游离氧使玻璃结构中的O/Si比值增加,发生断键,从而使 玻璃黏度下降,以利于玻璃的熔融,是良好的助熔剂。但NO能增大 玻璃的热膨胀系数,降低玻璃的热稳定性、化学稳定性、机械强度和分 电常数,所以用量不能过多,一般不超过18%。 (6)Kz0。是玻璃结构中的网络外体氧化物,其作用与N20相似。 钾离子比钠离子半径大,钾玻璃黏度比钠玻璃大,能降低玻璃的折晶倾 向,增加玻璃的折射率和光泽等。K,O常用于制高级器器皿玻璃、晶质 玻璃、光学玻璃和技术玻璃。由于钾玻璃有较低的表血张力,硬化速度 较慢,操作范围较宽,在压制有花纹的玻璃制品中,也常用K,O。 (7)Li0。是网络外体氧化物。它在玻璃中的作用,比Na,O和 K,0特殊。玻璃配合料中加入少量含LO物质可降低玻璃的熔制温度, 提高玻璃的产量和质量。 (8)C0。是网络外体氧化物,在玻璃中的主要作用是稳定剂, 即增加玻璃的化学稳定性和机械强度:但含量较高时,能使玻璃的结晶 倾向增大,日易使玻璃发脆。Ca0在高温时,当含量10%~12%,提高玻璃黏 4

度。温度降低时,使玻璃的黏度增加得很快,使玻璃成型困难。但可提高 玻璃的成型速度。CO含量较高的玻璃,成型后要立即退火,否则易使玻 璃炸裂。 (9)Mg0。在钠钙硅酸盐玻璃中是网络外体氧化物,在很多方面 与氧化钙有类似作用。加入氧化镁对降低玻璃的高温黏度,提高化学稳 定性和机械强度,氧化镁能改善玻璃的析晶性能,使作业温度范围变宽, 氧化镁加入量太多会使玻璃的黏度和表面张力增加,使玻璃熔化和澄清 困难,制品质量变差。 (10)Ba0。是网络外体氧化物,能增加玻璃的折射率,密度、 光泽和化学稳定性:少量的Ba0(0.5%)能加速玻璃的熔化,但含量 过多澄清困难。含BaO的玻璃,吸收辐射线能力大,但对耐火材料侵 蚀较严重。Ba0常用于高级器皿玻璃、化学仪器、光学玻璃、防辐射玻 璃等。 (11)Zn0。是中间体氧化物。在一般情况下,以锌氧八面体[ZnOa] 存在于网络中。当玻璃中的游离氧足够时,可以形成锌氧四面体[ZO4] 而进入玻璃的结构网络,使玻璃的结构趋于更稳定。ZO能降低玻璃的 热膨胀系数,提高玻璃的化学稳定性、热稳定性和折射率。在氟乳浊玻 璃中,Zn0能增加乳白度和光洋。在铅玻璃中加入2%~5%的Zn0可以 消除其主要缺陷一条纹。用量过多会使玻璃析品,一般玻璃中含ZO 不超过5%-6%。 (12)Pb0。是中间体氧化物,在一般情况下为网络外体。当Pb0 含量高时,铅离子容易极化变形,或降低其配位数而居于玻璃的结构网 络中。PbO能增加玻璃的密度,提高玻璃的折射率,使玻璃具有特殊的 光洋和良好的电性能。铅玻璃的高温黏度小,熔制温度低,易于澄清。 铅玻璃的硬度小,便于研磨抛光,所以多用于生产光学玻璃。在熔制时, 必须在氧化条件下进行。为此,在配合料中必须加入一定量的硝酸盐作 为氧化剂。铅玻璃对耐火材料侵蚀比较严重,需要选用高质量的耐火材 料。铅玻璃的化学稳定性差,但吸收辐射线的能力很强。 (13)T02。是中间体氧化物。在硅酸盐玻璃中,一部分TO2以 钛氧四面体TO]进入结构网络,一部分以八面体TO]处于结构网络之

间。TO2可以提高玻璃的折射率和化学稳定性,增加吸收X射线和紫 外线能力。在含有A1,O、B,O、Mg0的硅酸盐玻璃中,TiO2在低温 时容易失透。TO2用以制造高折射率的光学玻璃,吸收X射线和紫外 线的防护玻璃,还可作微晶玻璃的成核剂。 (14)Zr02。是中间体氧化物。ZO2能提高玻璃的黏度、使度、 弹性、折射率、化学稳定性和降低玻璃的热膨胀系数。含ZO2的玻璃, 比较难熔,含量超过5%时,易析晶。ZO2用于制造良好化学稳定性、 热稳定性和时碱性良好的玻璃,也可用于高折射率光学玻璃和作微晶玻 璃的晶核剂等。 1.1.3玻璃组成设计 玻璃组成设计分为两种类型: A玻璃在物理-化学性质上有较大突破一设计新的组成如研制新型 玻璃时, B为改善玻璃某些方面性质一对组成作局部调整。 理论基础一玻璃科学理论为玻璃组成设计指出方向,必须反复通 过实践调整组成以获得符合预定要求的玻璃。要求通过一次性设计组 成,就能达到既定的玻璃物理化学性质和工艺性能方面的要求和指标。 1.1.3.1设计原则 在设计玻璃组成时应考虑以下原则: (1)根据组成、结构和性质之间的关系,使设计的玻璃能满足预 定的性能要求。 (2)根据玻璃形成图和相图,使设计的组成能够形成玻璃,析晶 倾向小(微品玻璃除外)。 (3)根据生产条件使设计的玻璃能适应熔制、成型、加工等工序 的工艺要求。 (4)所设计的玻璃应当价格低廉,原料易于获得。 设计玻璃组方法:, A先要依据玻璃所要求的性能选择适宜的氧化物系统,以确定玻璃 的主要组成,通常玻璃的主要组成氧化物为34种,它们的总量往往达 到90%。 6

B再引入其他改善性能的必要氧化物,拟定出玻璃的设计组成。 C为了使设计的玻璃析晶倾向小,可参考有关相图,在接近共熔点 或相界线处选择组成点。 D一般工业玻璃其组成氧化物在56以上。对于引入其他氧化物及 其含量,则主要考虑它们对玻璃性能的影响。 E有时可应用性能计算公式进行预算。 F最后还要添加适当的助熔剂和澄清剂,以使玻璃易于熔制 需要通过反复熔制实践和性能测定,对成分进行多次校正。在这过 程中,运用正交设计可节省探索时间。 1.1.32设计步聚 A列出设计玻璃的性能要求 B拟定玻璃组成 拟定出设计玻璃的最初组成(原始组成)。然后按有关玻璃性质的计 算公式,对设计玻璃的主要性质进行预算,如果不合要求,则应当进行 组成氧化物的增删和其引入量的调整,然后,再反复进行预算、调整。 直至初步符合要求时,即作为设计玻璃的试验组成。 C实验、测试、确定组成 按照拟定的玻璃试验组成,制备配合料,在实验室电炉中进行熔制 试验,并对熔好的玻璃进行有关性能的测试。通过试验和测试,对组成 逐次调整修改,直至设计的玻璃达到给定的性能要求和工艺要求。然后 在池炉中进行生产试验。在生产试验时对熔化、澄清、成型、退火等都 应取得数据。必要时,再对组成氧化物进行调整,最后即确定为新设计 玻璃的组成。 1.1.3.3设计工艺考虑 (1)杂质引入。 (2)挥发损失。 (3)耐火材料侵蚀。 1.1.4普通玻璃组成 普通玻璃指能够大规模生产的工业玻璃,包括平板玻璃、瓶罐玻璃、 器皿玻璃、仪器玻璃、光学玻璃和电真空玻璃等

1.1.4.1平板我璃组成 产量最大,用途最广,在各种玻璃制品中占有突出地位,并不断向 多品种及多功能方向发展。在确定平板玻璃化学组成时,要求易于熔化 和澄清,制品有良好的化学稳定性,保存与使用中不发霉,成型温度范 围析晶倾向性小,玻璃料性要短,有较快的硬化速度,以适应高速成型。 平板玻璃化学组成主要有SiO2、Al,03、Ca0、Mg0、Rz0,其质量 百分比随成型方法不同而略有差异: (1)浮法玻璃成型具有高速的特点,要求玻璃性短,硬化快,因此, 浮法玻璃采用高钙低碱成分。 (2)平拉法由于有自由液面成型和高速拉引的特点,而采用快硬的 短性玻璃,玻璃组成中CaO含量高,Na,O含量减少。 (3)有槽引上法由于利用槽子砖成型,对玻璃成分的析晶性能有更 严格限制。 (4)无槽引上法采用引砖成型,需硬化较快、料性短的玻璃组成, 即增加玻璃中CaO含量,降低Na,O含量。 1.1.4.2瓶皲璃组成 玻璃瓶罐一般可归纳为细颈瓶(小口瓶)和粗颈瓶(大口瓶)两大 类。对瓶罐玻璃的基本要求是熔化良好、均匀,尽可能避免各种玻璃缺 陷:玻璃要满足成型要求:具有一定的化学稳定性,避免与盛装物发生 作用:制品要有一定的热稳定性和一定的机械强度。除医药用瓶与化工 用瓶由于对化学稳定性有特殊要求需采用硼硅酸盐玻璃外,绝大多数瓶 罐玻璃以Na20-CaO-Si0,为基础,引入适量AlO、Mg0以改善玻璃 析品倾向,增强化学稳定性、机械强度和改善玻璃成型性质。 11.4.3器m波璃组成 器皿玻璃的组成必须满足下列要求:(1)具有制品使用时要求的热 稳定性和化学稳定性:(2)易于熔制和澄清:(3)符合成型方法要求的 黏度温度曲线:(4)生产过程中不易析晶。 1.1,4.4保温瓶我璃丝成 保温瓶的玻璃部分称为瓶胆,是一种双层或多层的薄壁容器。一般 保温瓶的容量越大,瓶口直径越小,瓶塞的导热和瓶口间隙的散热越小

保温效果越好。 小口保温瓶一直采用无硼或少硼的含镁铝的钠钙硅酸盐系统玻璃。 部分厂家引入少量的钡、锌等氧化物,使玻璃性能得到改善。 大口保温瓶玻璃多用于盛装冷物,个别可达-200℃以下,要求有优 良的热稳定性、化学稳定性和机械强度。中国采用的是半硬质硼硅酸盐 玻璃,以BO部分取代了RO(碱金属氧化物)、RO(碱土金属氧化 物),国外目前一般认为采用Si0270%左右,B2012%左右,其他18% 左右的硬质硼硅酸盐玻璃,但在熔制和成型技术方血都具有一定的难 度。 1.1.4.5仪器波璃组成 仪器玻璃包括实验室仪器玻璃、医用玻璃等。对仪器玻璃的基本要 求是有良好的化学稳定性,主要表现为对酸、碱和水的侵蚀抓抗性好: 要求玻璃抗热冲击性好,同时要求玻璃机械强度高,弹性好、脆性低、 硬度高,使用温度高,根据仪器玻璃的各种不同用途和制造工艺选择不 同成分,以满足不同的使用要求。 高硅氧玻璃(ycor glass)是含SiO2高达96%以上的玻璃,是利 用图11中玻璃组成的B区易于分相的特点来制造的。首先选取 NaO-B2O,-SiO2系统B区域中适当组成,按普通方法熔制成玻璃,而后 在600℃左右对其进行热处理,使其分相,成为富N20-B2O3相和富SiO2 相。分相后的玻璃经退火处理,再用3NHC1和5NH2SO4进行酸处理, 浸出富NaO-B,O3相,洗去反应生成物, 5i0 月声惠硅玻璃组戚区 成为富SiO2相的多孔质玻璃,再经1200℃ 分相区 左右的烧结,制成高硅氧玻璃制品。 高硅氧玻璃制造过程中要注意基础玻 璃成分的选择,保证经热处理后可以得到 符合分相要求的玻璃。其典型成分如表1-2 图1-lNa,0-B,0-Si02系统玻璃 所列。高硅氧玻璃可以代替石英玻璃 (quartz glass)制作耐热器皿、复杂形状的仪器、高压水银灯管和溴钨 灯等。 表12高硅氧波璃成分及退火温度 9
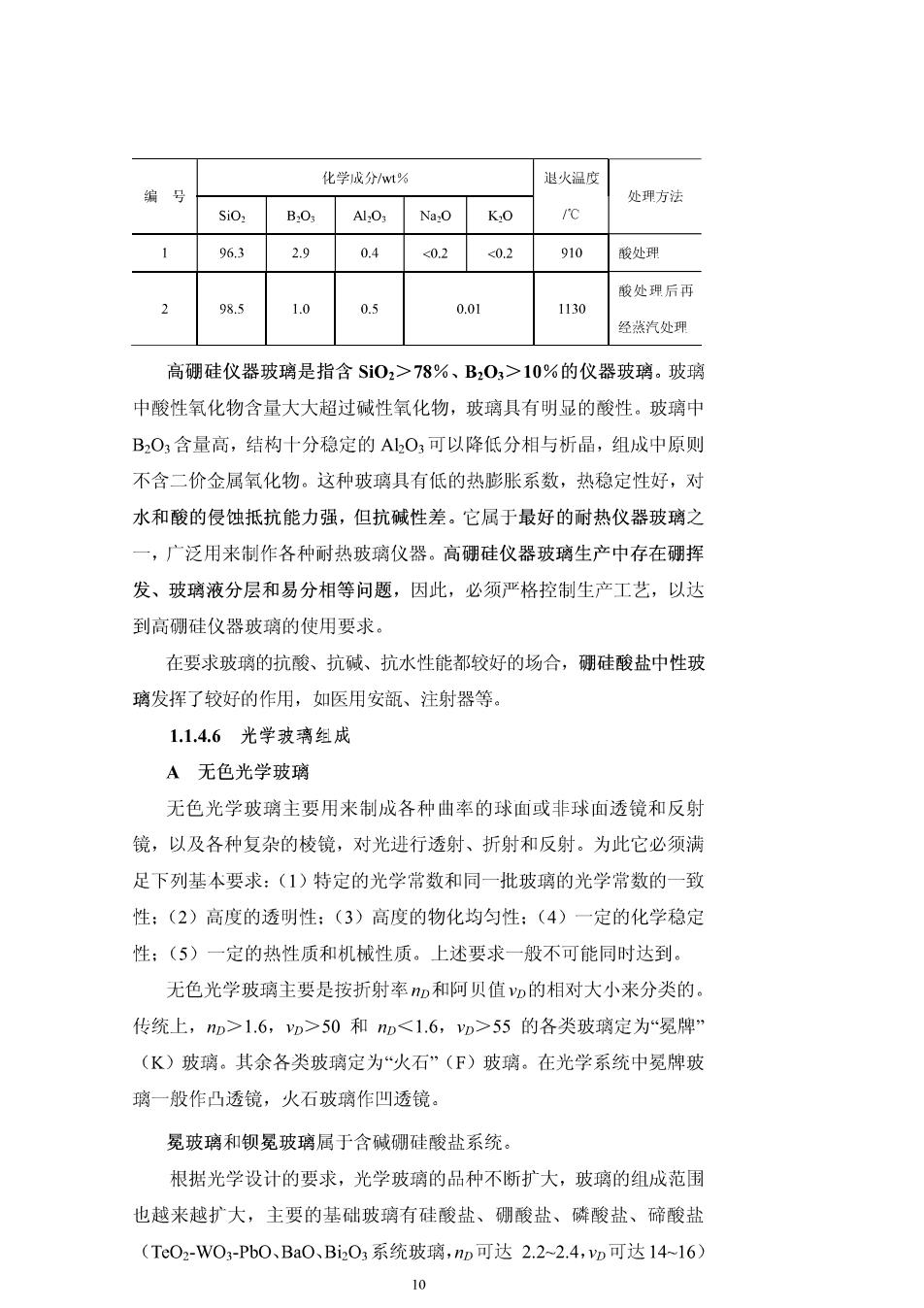
化学成分t% 退火温度 处方法 Si0:B.0 A,0Na,0K,0 96.3 2.9 0.4 ≤020.2 910 酸处理 酸处理后再 985 1.0 0.5 0.01 1130 经蒸汽处理 高硼硅仪器玻璃是指含Si02>78%、B,03>10%的仪器玻璃。玻璃 中酸性氧化物含量大大超过碱性氧化物,玻璃具有明显的酸性。玻璃中 B2O,含量高,结构十分稳定的Al2O,可以降低分相与析晶,组成中原则 不含二价金属氧化物。这种玻璃具有低的热膨胀系数,热稳定性好,对 水和酸的侵蚀抵抗能力强,但抗碱性差。它属于最好的耐热仪器玻璃之 一,广泛用来制作各种耐热玻璃仪器。高硬硅仪器玻璃生产中存在硼挥 发、玻璃液分层和易分相等问题,因此,必须严格控制生产工艺,以达 到高硼硅仪器玻璃的使用要求。 在要求玻璃的抗酸、抗碱、抗水性能都较好的场合,硼硅酸盐中性玻 璃发挥了较好的作用,如医用安瓿、注射器等。 1.1.4.6光学波璃组成 A无色光学玻璃 无色光学玻璃主要用来制成各种曲率的球血或非球血透镜和反射 镜,以及各种复杂的棱镜,对光进行透射、折射和反射。为此它必须满 足下列基本要求:(1)特定的光学常数和同一批玻璃的光学常数的一致 性:(2)高度的透明性:(3)高度的物化均匀性:(4)一定的化学稳定 性:(5)一定的热性质和机械性质。上述要求一般不可能同时达到。 无色光学玻璃主要是按折射率加和阿贝值D的相对大小来分类的。 传统上,mD>1.6,p>50和p55的各类玻璃定为“冕牌 (K)玻璃。其余各类玻璃定为“火石”(F)玻璃。在光学系统中冕牌玻 璃一般作凸透镜,火石玻璃作凹透镜。 冕玻璃和钡冕玻璃属于含碱硼硅酸盐系统。 根据光学设计的要求,光学玻璃的品种不断扩大,玻璃的组成范围 也越来越扩大,主要的基础玻璃有硅酸盐、硼酸盐、磷酸盐、碲酸盐 (Tc02-w0-Pb0、Ba0、Bi01系统玻璃,D可达2.2-2.4,yw可达14-16) 10