物理化学电子教案一第九章 可逆电池的电动势及其应用 EN (A) R 1.5 02 .o Fe3+ B Fe203 B 0.5 腐蚀区 Es.c 0 (D) Fe2+ (b) H20 -0.5 -1.0 (C) Fe (a) -1.5 H2 Ex 0 2 4 6 8 10 1214 2023/2/13 pH
2023/2/13 物理化学电子教案—第九章

第九章可逆电池的电动势及其应用 §9.1可逆电池和可逆电极 §9.2电动势的测定 §9.3可逆电池的书写方法及电动势的取号 §9.4可逆电池的热力学 §9.5电动势产生的机理 §9.6电极电势和电池的电动势 §9.7电动势测定的应用 §9.8内电位、外电位和电化学势 2023/2/13
2023/2/13 第九章 可逆电池的电动势及其应用 §9.1 可逆电池和可逆电极 §9.2 电动势的测定 §9.3 可逆电池的书写方法及电动势的取号 §9.4 可逆电池的热力学 §9.5 电动势产生的机理 §9.6 电极电势和电池的电动势 §9.7 电动势测定的应用 §9.8 内电位、外电位和电化学势

§9.1 可逆电池和可逆电极 可逆电池 可逆电极和电极反应
§9.1 可逆电池和可逆电极 可逆电池 可逆电极和电极反应
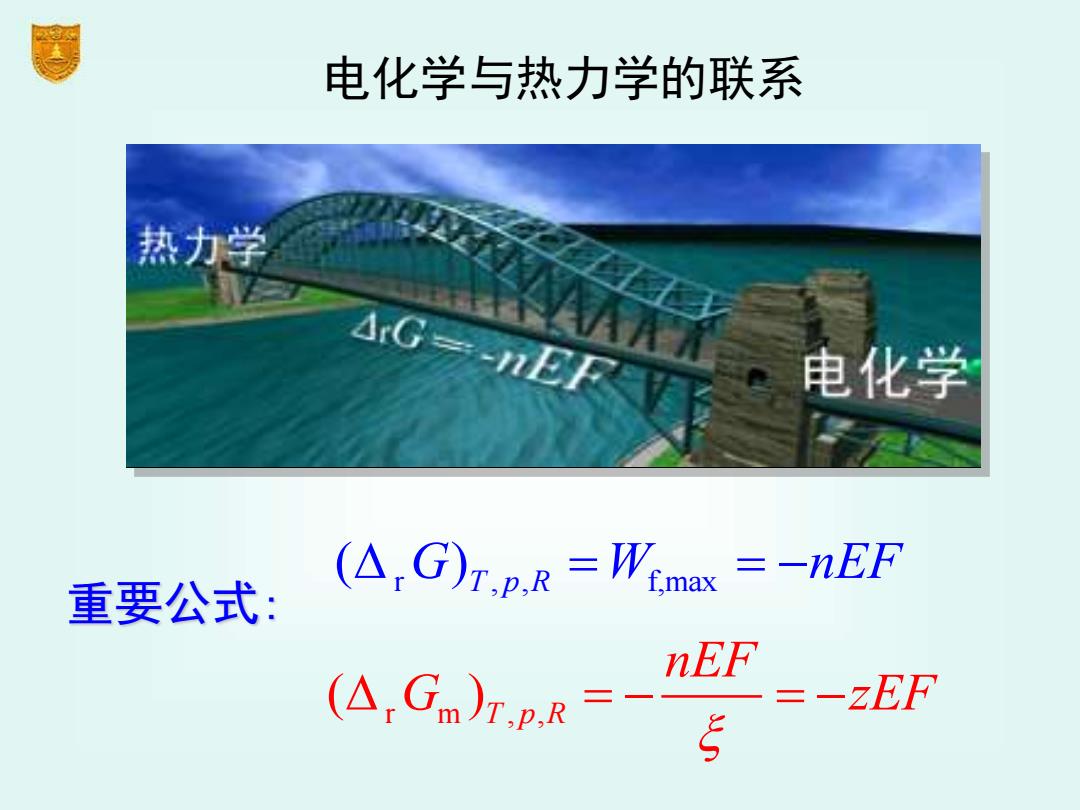
电化学与热力学的联系 热力学 AG=-ER 电化学 重要公式: (A:G)T.p.R=Wemax =-nEF (A G =-2EF 5
重要公式: r , , f,max ( ) = = − G W nEF T p R r m , , ( )T p R nEF G zEF = − = − 电化学与热力学的联系

如何把化学反应转变成电能? 1、该化学反应是氧化还原反应,或包含有氧化 还原的过程 2、有适当的装置,使化学反应分别通过在电极 上的反应来完成 3、有两个电极和与电极建立电化学平衡的相应 电解质 4、有其他附属设备,组成一个完整的电路
如何把化学反应转变成电能? 1、该化学反应是氧化还原反应,或包含有氧化 还原的过程 2、有适当的装置,使化学反应分别通过在电极 上的反应来完成 3、有两个电极和与电极建立电化学平衡的相应 电解质 4、有其他附属设备,组成一个完整的电路

switch voltmeter salt bridge Cu cathode Zn anode NO Za(s)→Zn2+(ag)+2e Cu2+(ag)+2e→Cu(s) 构成条件: 1、能设计成电池的反应,如氧化还原反应。 2、有适当的装置一电池:单液电池或双液电池
构成条件: 1、能设计成电池的反应,如氧化还原反应。 2、有适当的装置——电池:单液电池或双液电池
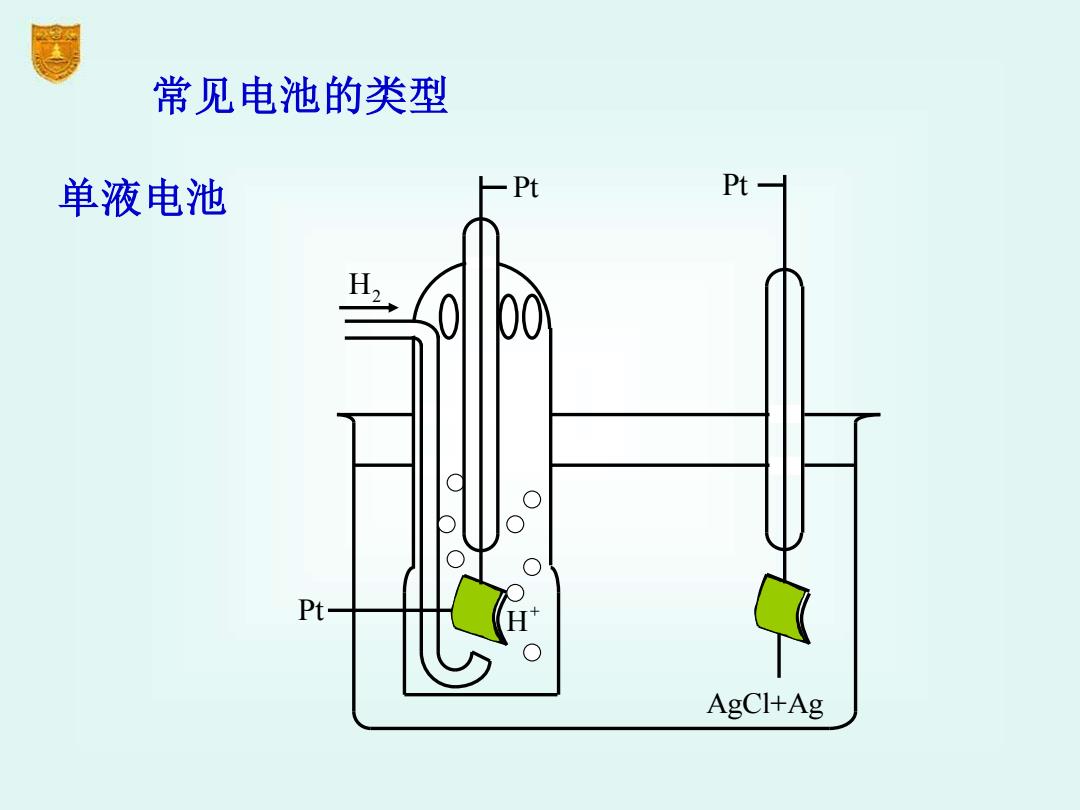
常见电池的类型 单液电池 人 Pt Pt- 0 00 Pt- AgCl+Ag
常见电池的类型 单液电池 H2 Pt+ H Pt Pt AgCl+Ag
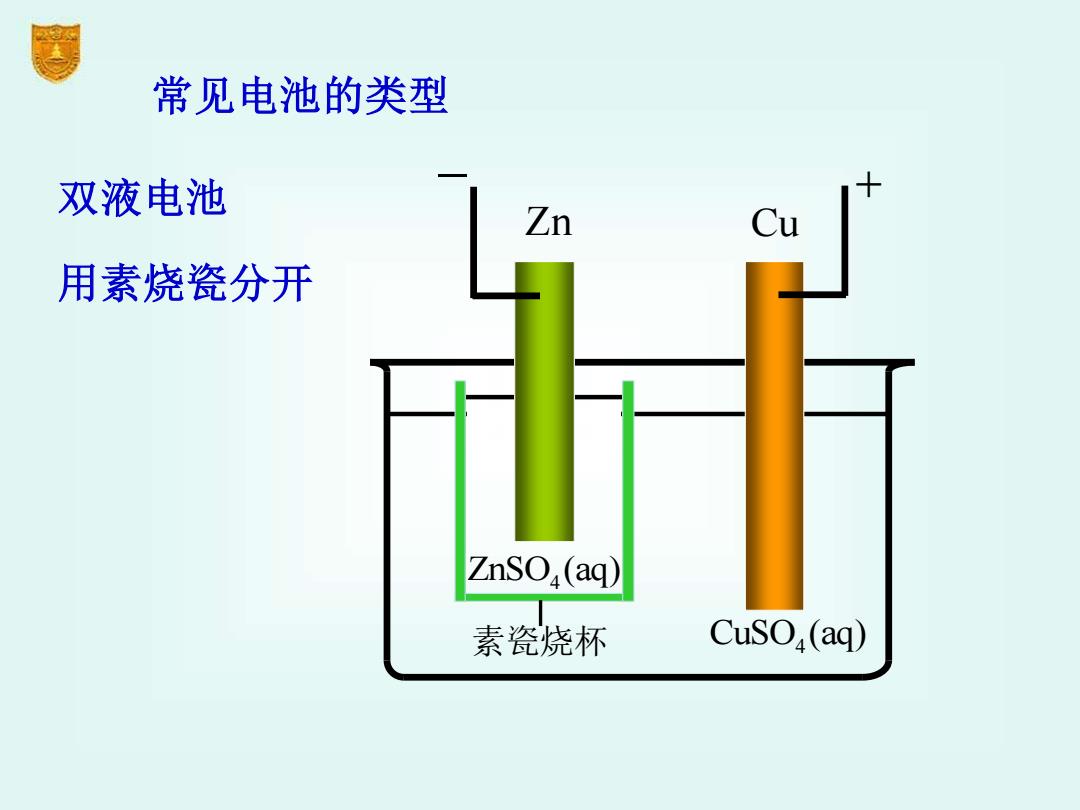
常见电池的类型 双液电池 Zn 用素烧瓷分开 ZnSO,(aq) 素瓷烧杯 CuSO(aq)
常见电池的类型 双液电池 用素烧瓷分开 Zn Cu − + CuSO (aq) 4 ZnSO (aq) 4 素瓷烧杯
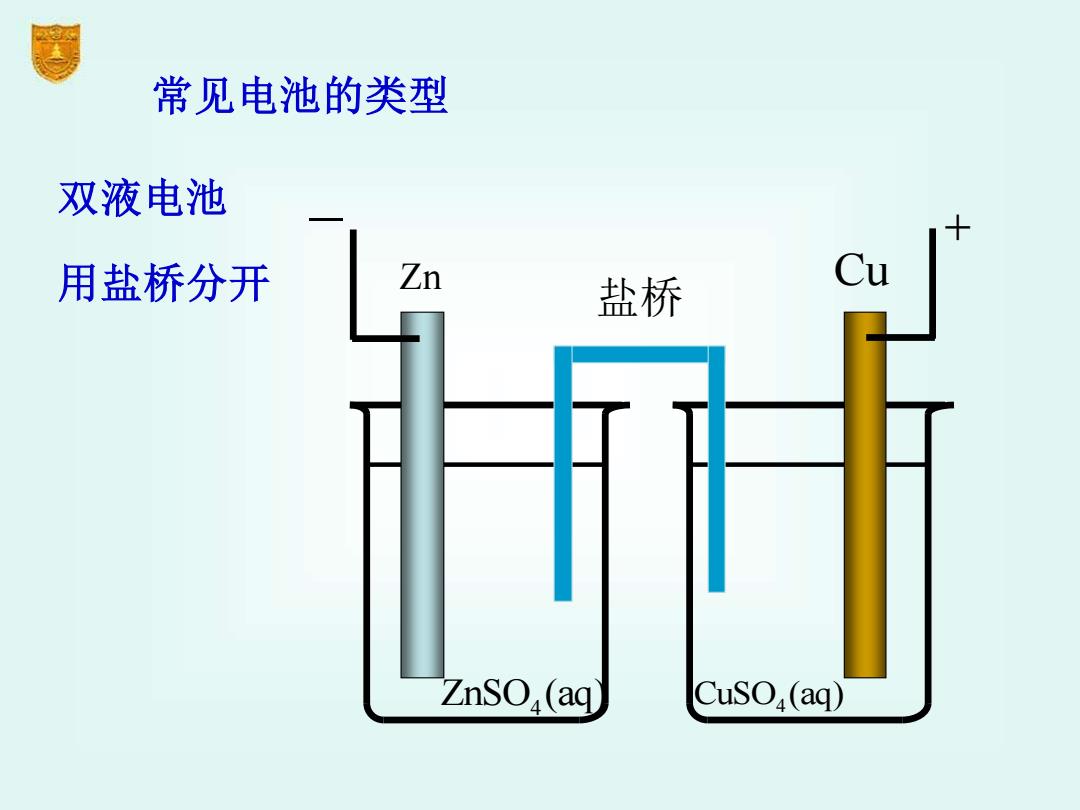
常见电池的类型 双液电池 用盐桥分开 Zn 盐桥 Cu ZnSO,(aq) CuSO(aq)
常见电池的类型 双液电池 用盐桥分开 ZnSO (aq) 4 CuSO (aq) 4 Zn Cu − + 盐桥
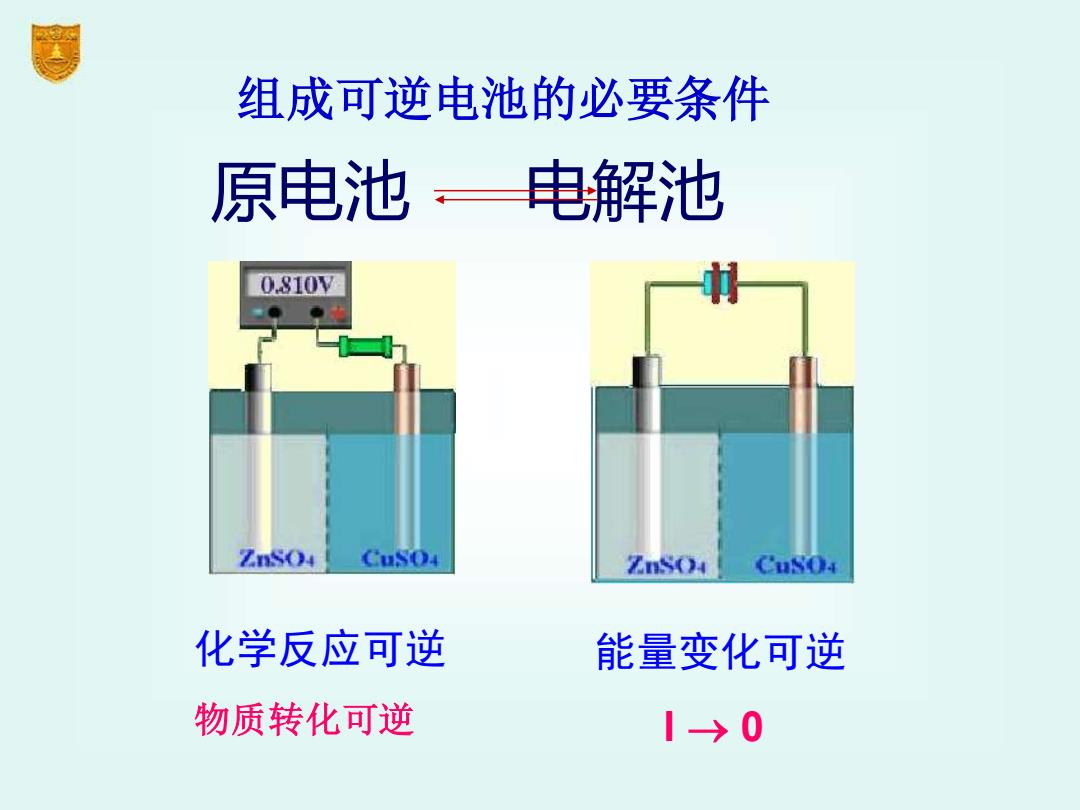
组成可逆电池的必要条件 原电池,电解池 0.810V ZnSO CuSO4 Z()4 CuSo 化学反应可逆 能量变化可逆 物质转化可逆 1→0
化学反应可逆 物质转化可逆 原电池 电解池 组成可逆电池的必要条件 能量变化可逆 I → 0