
延安大学精品课程…物理化学 ③返安女学: 化学与化工学院物理化学讲稿 第二章热力学第一定律 (12学时) 物理化学教研室 第1页共75页
延安大学精品课程 …… 物理化学 第 1 页 共 75 页 化学与化工学院物理化学讲稿 第二章 热力学第一定律 (12 学时) 物理化学教研室

延安大学精品课程…物理化学 物理化学款学方案 第二章 热力学第一定律 章节名称 备注 授课方式 理论课(√);实验课();实习() 教学时数 12 1、使学生了解热力学的一些基本概念,如系统、环境、功、热等。 2、使学生掌握热、功和内能这三者的区别与联系及其计算。 3、使学生充分理解状态函数的意义及数学特性。 4、 使学生明确热力学第一定律的叙述及数学表达式。 5、 使学生熟练理想气体在等温、等容、等压与绝热过程中△U、△H、 教学目的及要求 Q和W的计算。 6、1 使学生知道第一定律与Hess定律的关系,Kirchhoff定律的由来并熟 悉这两个定律的应用。 7、了解Carnot循环的意义以及理想气体在诸过程中的热、功的计算。 8、 明确热力学焓、标准摩尔生成焓、标准摩尔燃烧焓、标准摩尔反应 焓等概念及掌握其计算方法 教学内容提要 时间分配 第2页共75页
延安大学精品课程 …… 物理化学 第 2 页 共 75 页 物理化学教学方案 章节名称 第二章 热力学第一定律 备 注 授课方式 理论课(√);实验课( );实习( ) 教学时数 12 教 学 目 的 及 要 求 1、使学生了解热力学的一些基本概念,如系统、环境、功、热等。 2、使学生掌握热、功和内能这三者的区别与联系及其计算。 3、使学生充分理解状态函数的意义及数学特性。 4、使学生明确热力学第一定律的叙述及数学表达式。 5、使学生熟练理想气体在等温、等容、等压与绝热过程中 ΔU、ΔH、 Q 和 W 的计算。 6、使学生知道第一定律与 Hess 定律的关系,Kirchhoff 定律的由来并熟 悉这两个定律的应用。 7、了解 Carnot 循环的意义以及理想气体在诸过程中的热、功的计算。 8、明确热力学焓、标准摩尔生成焓、标准摩尔燃烧焓、标准摩尔反应 焓等概念及掌握其计算方法 教学内容提要 时间分配

延安大学精品课程…物理化学 2.1热力学概论 2.2热平衡和热力学第零定律—温度的概念 2.3热力学的一些基本概念 2.4热力学第一定律 0.5学时 0.5学时 2.5准静态过程与可逆过程 1学时 1学时 2.6焓 1学时 0.5学时 2.7热容 0.5学时 1学时 2.8热力学第一定律对理想气体的应用 1学时 1学时 2.9 Carnot循环 1.5学时 2.10焦耳一汤姆逊效应-实际气体的△U&△H 0.5学时 1学时 1学时 2.11热化学2.12Hess定律2.13几种热效应 2.14反应焓变与温度的关系-Kirhhoff定律 2.15绝热反应—非等温反应 2.16热力学第一定律的微观诠释 【重点】1、内能和焓。 2、热力学第一定律的数学表达式及△U、△H、Q、W的求算。 重点 3、可逆过程4、盖斯定律、基尔戈夫方程及应用。 难点 【难点】1、体积功与热的意义。 2、可逆过程。 第3页共75页
延安大学精品课程 …… 物理化学 第 3 页 共 75 页 2.1 热力学概论 2.2 热平衡和热力学第零定律——温度的概念 2.3 热力学的一些基本概念 2.4 热力学第一定律 2.5 准静态过程与可逆过程 2.6 焓 2.7 热容 2.8 热力学第一定律对理想气体的应用 2.9 Carnot 循环 2.10 焦耳一汤姆逊效应-实际气体的 ΔU&ΔH 2.11 热化学 2.12 Hess 定律 2.13 几种热效应 2.14 反应焓变与温度的关系-Kirhhoff 定律 2.15 绝热反应——非等温反应 2.16 热力学第一定律的微观诠释 0.5 学时 0.5 学时 1 学时 1 学时 1 学时 0.5 学时 0.5 学时 1 学时 1 学时 1 学时 1.5 学时 0.5 学时 1 学时 1 学时 重 点 难 点 【重点】1、内能和焓。 2、热力学第一定律的数学表达式及∆U、∆H、Q、W 的求算。 3、可逆过程 4、盖斯定律、基尔戈夫方程及应用。 【难点】1、体积功与热的意义。 2、可逆过程

延安大学精品课程…物理化学 【讨论题目】1、是否只有定容过程才有△U?定压过程才有△H? 2、盖斯定律与热力学第一定律的关系如何? 讨论 【思考题目】Q和W都不是系统的性质,其大小与过程有关,所以Q、 思考 W也应由过程决定。对吗?为什么? 作业 练习作业:习题:2、3、5、7、8、9、10、11、12、13、14、17、18、 20、22、23、26、28、30、31、32、33、35 教学手段 多媒体教学 第二章热力学第一定律及其应用 【本章思路】 首先介绍了学习热力学必须掌握的基本概念,接着分析了系统在状态一定和状态变化时所涉及 的能量因素,给出了热力学第一定律的表达式:随后几节分别讨论了不同过程中热和功的计算方法: 最后介绍了热力学第一定律的具体应用,简单介绍了热力学第一定律的微观解释。本章共分18小节, 主要内容及其联系见框图: 第4页共75页
延安大学精品课程 …… 物理化学 第 4 页 共 75 页 讨 论 思 考 作 业 【讨论题目】 1、是否只有定容过程才有∆U?定压过程才有∆H? 2、盖斯定律与热力学第一定律的关系如何? 【思考题目】Q 和 W 都不是系统的性质,其大小与过程有关,所以 Q、 W 也应由过程决定。对吗?为什么? 练习作业:习题:2、3、5、7、8、9、10、11、12、13、14、17、18、 20、22、23、26、28、30、31、32、33、35 教学手段 多媒体教学 第二章 热力学第一定律及其应用 【本章思路】 首先介绍了学习热力学必须掌握的基本概念,接着分析了系统在状态一定和状态变化时所涉及 的能量因素,给出了热力学第一定律的表达式;随后几节分别讨论了不同过程中热和功的计算方法; 最后介绍了热力学第一定律的具体应用,简单介绍了热力学第一定律的微观解释。本章共分 18 小节, 主要内容及其联系见框图:
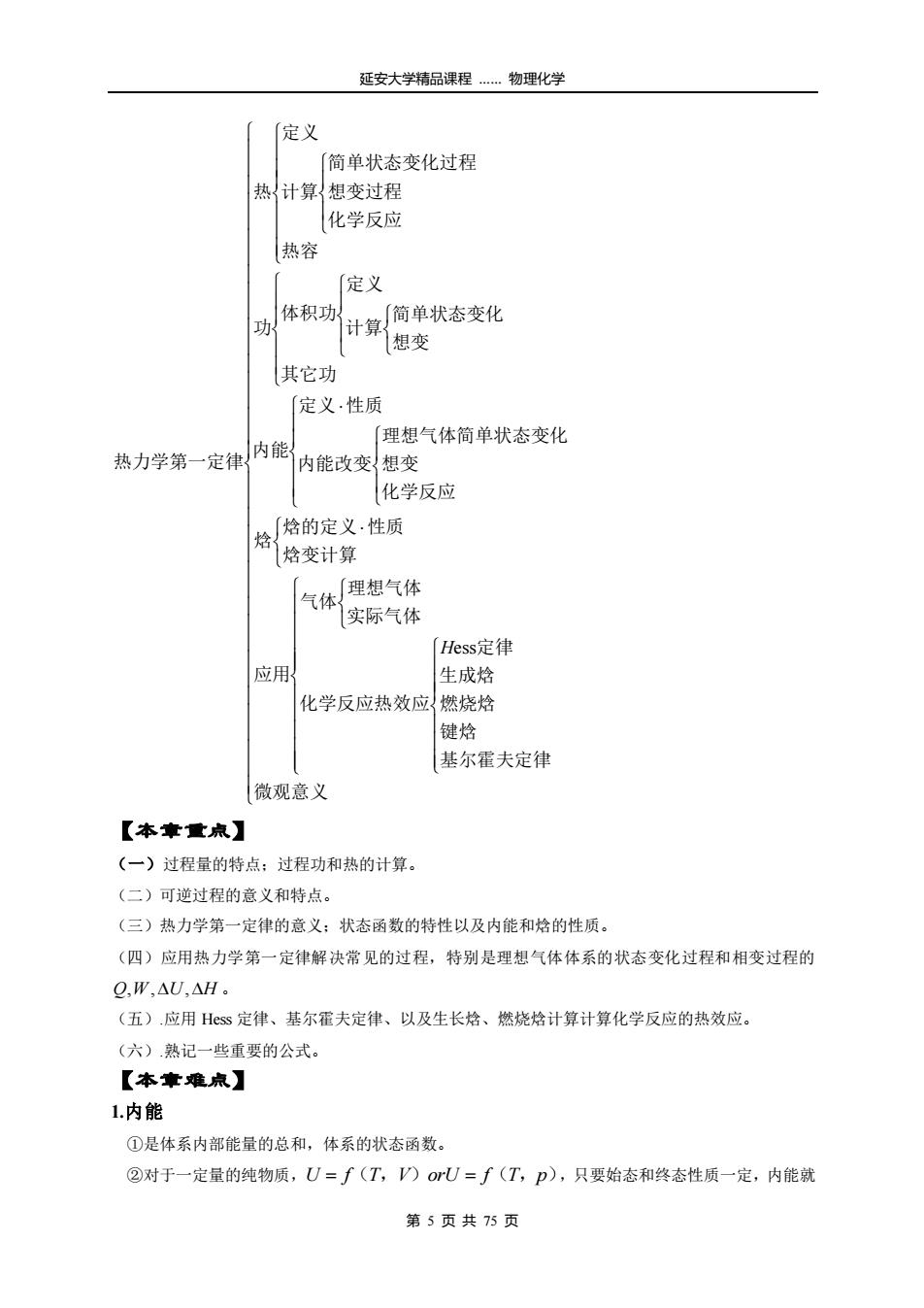
延安大学精品课程…物理化学 定义 「简单状态变化过程 热{计算想变过程 化学反应 热容 「定义 体积功 「简单状态变化 功 计算 想变 其它功 「定义性质 理想气体简单状态变化 热力学第一定律内能 内能改变想变 化学反应 「焓的定义·性质 焓 焓变计算 气体 [理想气体 实际气体 Hess定律 应用 生成焓 化学反应热效应!燃烧焓 键焓 基尔霍夫定律 微观意义 【本章重点】 (一)过程量的特点:过程功和热的计算。 (二)可逆过程的意义和特点。 (三)热力学第一定律的意义:状态函数的特性以及内能和焓的性质。 (四)应用热力学第一定律解决常见的过程,特别是理想气体体系的状态变化过程和相变过程的 Q,W,△U,△H。 (五).应用Hss定律、基尔霍夫定律、以及生长焓、燃烧焓计算计算化学反应的热效应。 (六).熟记一些重要的公式。 【本章难点】 1.内能 ①是体系内部能量的总和,体系的状态函数。 ②对于一定量的纯物质,U=f(T,)oU=f(T,p),只要始态和终态性质一定,内能就 第5页共75页
延安大学精品课程 …… 物理化学 第 5 页 共 75 页 微观意义 基尔霍夫定律 键焓 燃烧焓 生成焓 定律 化学反应热效应 实际气体 理想气体 气体 应用 焓变计算 焓的定义 性质 焓 化学反应 想变 理想气体简单状态变化 内能改变 定义 性质 内能 其它功 想变 简单状态变化 计算 定义 体积功 功 热容 化学反应 想变过程 简单状态变化过程 计算 定义 热 热力学第一定律 Hess 【本章重点】 (一)过程量的特点;过程功和热的计算。 (二)可逆过程的意义和特点。 (三)热力学第一定律的意义;状态函数的特性以及内能和焓的性质。 (四)应用热力学第一定律解决常见的过程,特别是理想气体体系的状态变化过程和相变过程的 Q,W,U,H 。 (五).应用 Hess 定律、基尔霍夫定律、以及生长焓、燃烧焓计算计算化学反应的热效应。 (六).熟记一些重要的公式。 【本章难点】 1.内能 ①是体系内部能量的总和,体系的状态函数。 ②对于一定量的纯物质, U = f(T,V)orU = f(T,p) ,只要始态和终态性质一定,内能就

延安大学精品课程…物理化学 有确定的变化量。理想气体的内能只是温度的单值函数,U=f(T),与体积和压力无关。而且,不 管体系发生什么样的简单状态变化,只要温度不变,△U=0 2.格 ①是状态函数,具有能量的单位,但焓不是体系的能量,没有确定的物理意义,仅是状态函数的 一种组合。 焓变:△H=△U+△(pV),适用于封闭体系的任何过程,式中的 △(pV)=P'-p,V=pAV+pAV≠p+pAV ②理想气体的焓变只是温度的单值函数,所以其值在任意简单状态变化过程中可直接用 △H=C。d厂计算,由于烩是状态函数,故该式也适用于非理想气体始态和终态的压力相同的 任意简单状态变化过程。 3.体积功 ①功和热一样是,对相同的始态和终态,过程进行的途径不同,功和热不同: ②体积功的定义:δW=-∫P.dW,体系状态变化时,不管外压多大,只要体系的体积不变(恒 容)体积功卫零:若外压为零,体积功也为零(如自由膨胀)。 ③注意:P。是外压,即环境的压力,而不是体系的压力P,只有对等压过程才有p。=P:对可 逆过程,P。=p士中≈p:如欲计算一有限可逆过程(如液体的在一定温度和压力下液化): W=p(V-?,Vg>>',,则W≈pVg=nRT ④一定量的理想气体,从统一初始状态分别经()R()。.R'()0.R膨胀,到达相同的终态, 体积功的比较:Wo,。之We。之W。R,要注意联系pV图。 【作业和例题】 1.典型例题:围绕各重点和难点,设置10余道例题。 2.作业:课后习题量的1/2~2/3左右 【授课内容】 2.1热力学概论 一、热力学的研究内容 1、热力学:研究热、功和其他形式能量(H,U,G,A等)之间的相互转换及其转换过程中所遵循的 基本规律。广义:研究系统宏观性质变化与系统性质变化之间关系的科学。 主要基础:热力学第一定律&热力学第二定律热力学。 2、化学热力学:用热力学中最基本的原理来研究化学现象以及和化学有关的物理现象。 3、研究内容: 第6页共75页
延安大学精品课程 …… 物理化学 第 6 页 共 75 页 有确定的变化量。理想气体的内能只是温度的单值函数, U = f(T),与体积和压力无关。而且,不 管体系发生什么样的简单状态变化,只要温度不变, U = 0 . 2.焓 ①是状态函数,具有能量的单位,但焓不是体系的能量,没有确定的物理意义,仅是状态函数的 一种组合。 焓变: H = U + (pV),适用于封闭体系的任何过程,式中的 (pV)= p2V2 − p1V1 = pV + pV Vp + pV ②理想气体的焓变只是温度的单值函数,所以其值在任意简单状态变化过程中可直接用 1 2 T p m T = H C dT , 计算,由于焓是状态函数,故该式也适用于非理想气体始态和终态的压力相同的 任意简单状态变化过程。 3.体积功 ①功和热一样是,对相同的始态和终态,过程进行的途径不同,功和热不同; ②体积功的定义: W p dV e = − ,体系状态变化时,不管外压多大,只要体系的体积不变(恒 容)体积功卫零;若外压为零,体积功也为零(如自由膨胀)。 ③注意: e p 是外压,即环境的压力,而不是体系的压力 i p ,只有对等压过程才有 pe = pi ;对可 逆过程, pe = p dp p ;如欲计算一有限可逆过程(如液体的在一定温度和压力下液化): W = p(Vg −Vl),Vg Vl ,则 W pV g = nRT ④一定量的理想气体,从统一初始状态分别经 ()T,R,()Q,R,()Q,IR 膨胀,到达相同的终态, 体积功的比较: T R Q R Q IR W W W () , () , () , , 要注意联系 pV 图。 【作业和例题】 1.典型例题:围绕各重点和难点,设置 10 余道例题。 2.作业:课后习题量的 1/2~2/3 左右。 【授课内容】 2.1 热力学概论 一、热力学的研究内容 1、热力学:研究热、功和其他形式能量(H, U, G, A 等)之间的相互转换及其转换过程中所遵循的 基本规律。广义:研究系统宏观性质变化与系统性质变化之间关系的科学。 主要基础:热力学第一定律&热力学第二定律热力学。 2、化学热力学:用热力学中最基本的原理来研究化学现象以及和化学有关的物理现象。 3、研究内容:

延安大学精品课程…物理化学 ①研究各种物理变化和化学变化过程中所发生的能量效应·(热力学第一定律)》 ②研究特定条件下化学变化的方向和限度-(热力学第二定律) ③解决温度零点的问题--·(热力学第零定律) 二、热力学方法和局限性 1、热力学方法 热力学方法是一种演绎的方法,结合经验所得的基本定律进行演绎推理,指明宏观对象的性质、 变化方向和限度。 热力学方法的特点: ①研究对象是大数量微粒组成的集合体,研究宏观性质,所得结论具有统计意义。 ②只考虑变化前后的净结果,不考虑物质的微观结构和反应机理。 ③能判断变化能否发生以及进行到什么程度,但不考虑变化所需要的时间。 2、局限性 无时间概念,不涉及反应的速率、机理和微观性质,只讲可能性,不讲现实性。 2.2热力学第零定律 一、温度的定义 1、定性描述:表示物体冷热程度的物理量。 2、科学定义:由热力学第零定律导出。 二、热力学第零定律 设想把A和B以绝热壁隔开,而两者分别以导热壁与A接触, 此时AB与C分别建立了热平衡:然后在AB间换上导热壁,A,B 与C之间换成绝缘壁,则观察不到A,B状态的变化,表明A,B 已经处于热力学平衡状态。 热平衡实验表明:如果连个系统分别和处于确定状态的第三个系统 达到了热平衡,则这两个系统彼此也将处于热平衡。这个规律成为 绝热 热平衡定律或热力学第零定律。 说明: ①热力学第零定律是在20世纪30年代由RH.Fower((弗勒)提出的,是大量实验事实的总结和概括。 ②第零定律的实质是指出了温度这个状态函数的存在,给出了比较温度的方法,即利用第三物体来 比较两个系统温度的高低,这个第三物体就是温度计。 2.3热力学基本概念 1、系统与环境 系统:热力学上被划定的研究对象称为系统,也称为物系或体系。 环境:体系以外的能影响到体系性质的物体或空间,称为环境。 第7页共75页
延安大学精品课程 …… 物理化学 第 7 页 共 75 页 ①研究各种物理变化和化学变化过程中所发生的能量效应------(热力学第一定律) ②研究特定条件下化学变化的方向和限度---(热力学第二定律) ③解决温度零点的问题----(热力学第零定律) 二、热力学方法和局限性 1、热力学方法 热力学方法是一种演绎的方法,结合经验所得的基本定律进行演绎推理,指明宏观对象的性质、 变化方向和限度。 热力学方法的特点: ①研究对象是大数量微粒组成的集合体,研究宏观性质,所得结论具有统计意义。 ②只考虑变化前后的净结果,不考虑物质的微观结构和反应机理。 ③能判断变化能否发生以及进行到什么程度,但不考虑变化所需要的时间。 2、局限性 无时间概念,不涉及反应的速率、机理和微观性质,只讲可能性,不讲现实性。 2.2 热力学第零定律 一、温度的定义 1、定性描述:表示物体冷热程度的物理量。 2、科学定义:由热力学第零定律导出。 二、热力学第零定律 设想把 A 和 B 以绝热壁隔开,而两者分别以导热壁与 A 接触, 此时 AB 与 C 分别建立了热平衡;然后在 AB 间换上导热壁,A,B 与 C 之间换成绝缘壁,则观察不到 A,B 状态的变化,表明 A,B 已经处于热力学平衡状态。 热平衡实验表明:如果连个系统分别和处于确定状态的第三个系统 达到了热平衡,则这两个系统彼此也将处于热平衡。这个规律成为 热平衡定律或热力学第零定律。 说明: ①热力学第零定律是在 20 世纪 30 年代由 R.H.Fower(弗勒)提出的,是大量实验事实的总结和概括。 ②第零定律的实质是指出了温度这个状态函数的存在,给出了比较温度的方法,即利用第三物体来 比较两个系统温度的高低,这个第三物体就是温度计。 2.3 热力学基本概念 1、系统与环境 系 统:热力学上被划定的研究对象称为系统,也称为物系或体系。 环 境:体系以外的能影响到体系性质的物体或空间,称为环境

延安大学精品课程…物理化学 说明:①系统与环境之间有一定的界面(可以是真实的,也可以是假设的:可以是静止的也可以是 运动的: ②系统的选择具有任意性。 ③根据系统与环境之间的关系,把系统分为三类:敞开系统、封闭系统和孤立系统。 体系的分类根据体系与环境之间的能量和物质交换关系,把体系分为三类: (1)敞开系统系统与环境之间既有物质交换,又有能量交换。 (2)封闭系统系统与环境之间无物质交换,但有能量交换。 (3)孤立系统(简写$0)系统与环境之间既无物质交换,又无能量交换,故又称为隔离系统。 有时把封闭体系和体系影响所及的环境一起作为孤立体系来考虑。 2.系统的性质: 用系统可测量的性质来表示,如体积、温度、压强等来描述系统的热力学状态,这些性质又称为热 力学变量,可分为两类: (1)广度性质 又称为容量性质,它的数值与体系的物质的量成正比,具有加和性。如U、H、m、Cv、Cp等。在 数学上是一次齐函数。 (2)强度性质数值取决于体系自身的特点,与体系的数量无关,不具有加和性,如T、p等。在 数学上是零次齐函数。指定了物质的量的容量性质即成为强度性质,如摩尔热容。 3.热力学平衡态 热力学平衡态当体系的诸性质不随时间而改变,则体系就处于热力学平衡态,它包括下列几个平 衡: ①热平衡体系各部分温度相等。 ②力学平衡体系各部的压力都相等,边界不再移动。如有刚壁存在,虽双方压力不等,但也能保 持力学平衡。 ③相平衡 多相共存时,各相的组成和数量不随时间而改变, ④化学平衡 反应体系中各物的数量不再随时间而改变, 4.状态函数 状态函数:(状态性质)体系的一些性质,其数值仅取决于体系所处的状态,而与体系的历史无关: 它的变化值仅取决于体系的始态和终态,而与变化的途径无关。具有这种特性的物理量称为状态函 数。 状态特性: ①状态函数的值只与状态有关,与历史和变化途径无关。 ②对均相体系,状态性质可用连续函数表示。 ③状态函数值,由双变量决定。U=f(T,V),H=∫(T,P。(n一定量的单组分均相系统) 状态函数的特性可描述为:异途同归,值变相等:周而复始,数值还原。 用数学语言表述:状态函数具有全微分性质,且其二阶导数与求导的先后次序无关。 第8页共75页
延安大学精品课程 …… 物理化学 第 8 页 共 75 页 说 明:①系统与环境之间有一定的界面(可以是真实的,也可以是假设的;可以是静止的也可以是 运动的; ②系统的选择具有任意性。 ③根据系统与环境之间的关系,把系统分为三类:敞开系统、封闭系统和孤立系统。 体系的分类 根据体系与环境之间的能量和物质交换关系,把体系分为三类: (1)敞开系统 系统与环境之间既有物质交换,又有能量交换。 (2)封闭系统 系统与环境之间无物质交换,但有能量交换。 (3)孤立系统(简写 iso) 系统与环境之间既无物质交换,又无能量交换,故又称为隔离系统。 有时把封闭体系和体系影响所及的环境一起作为孤立体系来考虑。 2. 系统的性质: 用系统可测量的性质来表示,如体积、温度、压强等来描述系统的热力学状态,这些性质又称为热 力学变量,可分为两类: (1)广度性质 又称为容量性质,它的数值与体系的物质的量成正比,具有加和性。如 U、H、m、Cv、Cp 等。在 数学上是一次齐函数。 (2)强度性质 数值取决于体系自身的特点,与体系的数量无关,不具有加和性,如 T、p 等。在 数学上是零次齐函数。指定了物质的量的容量性质即成为强度性质,如摩尔热容。 3.热力学平衡态 热力学平衡态 当体系的诸性质不随时间而改变,则体系就处于热力学平衡态,它包括下列几个平 衡: ①热平衡 体系各部分温度相等。 ②力学平衡 体系各部的压力都相等,边界不再移动。如有刚壁存在,虽双方压力不等,但也能保 持力学平衡。 ③相平衡 多相共存时,各相的组成和数量不随时间而改变, ④化学平衡 反应体系中各物的数量不再随时间而改变, 4.状态函数 状态函数:(状态性质)体系的一些性质,其数值仅取决于体系所处的状态,而与体系的历史无关; 它的变化值仅取决于体系的始态和终态,而与变化的途径无关。具有这种特性的物理量称为状态函 数。 状态特性: ①状态函数的值只与状态有关,与历史和变化途径无关。 ②对均相体系,状态性质可用连续函数表示。 ③状态函数值,由双变量决定。U=f(T,V),H=f(T,P)。(n 一定量的单组分均相系统) 状态函数的特性可描述为:异途同归,值变相等;周而复始,数值还原。 用数学语言表述:状态函数具有全微分性质,且其二阶导数与求导的先后次序无关

延安大学精品课程…物理化学 5.状态函数·过程方程 状态方程:体系状态函数之间的定量关系式称为状态方程。例:pV=nRT 对于一定量的单组分均匀体系,状态函数T,,V之间有一定量的联系。经验证明,只有两个是独立 的,它们的函数关系可表示为: T=f (p.V)p=f (T.V)V=f (p.T) 例如,理想气体的状态方程可表示为:pV=nRT 实际气体的状态方程:(P+品X化。-)=R7 m 过程方程联系体系不同状态的方程。 如:理想气体绝热过程方程:pV=k(常数) 6.过程和途径 过程:系统的状态随时间变化的经过称为过程: 途径:完成一个过程的具体步骤称为途径。完成一个过程可以经历不同的途径。 根据系统状态变化时条件的不同,分为: (1)等温过程系统由状态1变化到状态2,变化过程中始态和终态的温度不变,且等于环境的温 度。注意:等温和恒温的区别。 表示式:T-T2-T环 (2)等压过程:系统在变化过程中始态和终态的压力相等,且等于环境压力(外压)。 即:P1=P2=P环 注意:等压过程与恒外压过程的区别。 (3)等容过程:系统的体积部随时间的变化而变化的过程: 说明:①在刚性容器中发生的变化一般是等容过程: ②在等容过程中体系的体积功为零: ③符号的含义:()()、()p(),()xp (4)绝热过程:系统在变化过程中和环境没有热交换: 说明:若系统和环境之间有绝热壁存在,则系统的变化过程为绝热过程。对那些变化极快的过程, 如爆炸,快速燃烧,系统与环境来不及发生热交换,那个瞬间可近似作为绝热过程处理。 (5)环状过程(循环过程):指系统从始态出发,经过一系列变化又回到原状态所经历的整个过程。 特点:所有状态函数的变量为零:∮d亿=0 7.热和功 热:系统和环境之间因温差而传递的热量,称为热,是一过程量,非状态函数:热可以自发的由高 温点流向低温点。 表示:热用符号Q表示。Q的取号: 第9页共75页
延安大学精品课程 …… 物理化学 第 9 页 共 75 页 5.状态函数·过程方程 状态方程:体系状态函数之间的定量关系式称为状态方程。例:pV=nRT 对于一定量的单组分均匀体系,状态函数 T,p,V 之间有一定量的联系。经验证明,只有两个是独立 的,它们的函数关系可表示为: T=f(p,V) p=f(T,V) V=f(p,T) 例如,理想气体的状态方程可表示为:pV=nRT 实际气体的状态方程: 2 m m ( )( ) a p V b RT V + − = 过程方程 联系体系不同状态的方程。 如:理想气体绝热过程方程: pV = k (常数) 6. 过程和途径 过程:系统的状态随时间变化的经过称为过程; 途径:完成一个过程的具体步骤称为途径。完成一个过程可以经历不同的途径。 根据系统状态变化时条件的不同,分为: (1)等温过程 系统由状态 1 变化到状态 2,变化过程中始态和终态的温度不变,且等于环境的温 度。注意:等温和恒温的区别。 表示式: T1 = T2 = T环 (2)等压过程:系统在变化过程中始态和终态的压力相等,且等于环境压力(外压)。 即: p1 = p2 = p环 注意: 等压过程与恒外压过程的区别。 (3)等容过程:系统的体积部随时间的变化而变化的过程; 说明:①在刚性容器中发生的变化一般是等容过程; ②在等容过程中体系的体积功为零; ③符号的含义: ()T、()V、()p、()T,V、()T,p (4)绝热过程:系统在变化过程中和环境没有热交换; 说明:若系统和环境之间有绝热壁存在,则系统的变化过程为绝热过程。对那些变化极快的过程, 如爆炸,快速燃烧,系统与环境来不及发生热交换,那个瞬间可近似作为绝热过程处理。 (5)环状过程(循环过程):指系统从始态出发,经过一系列变化又回到原状态所经历的整个过程。 特点:所有状态函数的变量为零; dZ = 0 7.热和功 热:系统和环境之间因温差而传递的热量,称为热,是一过程量,非状态函数;热可以自发的由高 温点流向低温点。 表示:热用符号 Q 表示。 Q 的取号:

延安大学精品课程…物理化学 体系吸热,Q>0: 体系放热,Q<0。 分类:溶解热、潜热(想变热)、显热(温差存在而发生的热传递)、反应热。 功:体系与环境之间传递的除热以外的其他能量都称为功,用符号W表示。 W的取号:环境对体系作功,W0: 体系对环境作功,W<0。 特点:可以等当量的转化为环境中重物的升降。 说明:Q和W都不是状态函数,其数值与变化途径有关。 分类:功可分为膨胀功和非膨胀功两大类。 功分类:功可分为膨胀功和非膨胀功两大类。 膨胀功:由于系统体积的变化而做的功,也叫体积功,用W。表示。 如图所示,用活塞将气体密封在截面积为s的圆柱形桶内,气体发生一膨胀过程,外压为P,活塞 向上移动了d,则 m。=∫Fd=∫p外Sd=∫p外dW=∫p.d 注意几点: (1)P表示系统的外部压力,只有系统处于平衡态时P。=P: (2)体积功唯一的表达形式pdW,pV,不是体积功。 (3)对等压过程:W=p(V,-P=p△V (4)规定:体系体积膨胀,对外做功W<0,取”号:反之取“+” 号。 (5)由体积功的计算公式,不管外压多大,等容过程,体积功为零。 (6)符号书写: 微小变化dU,d旺,d”后的量为状态函数:8W,δQ,8”后的量为过程变量。 较大变化△U,△H,“△”后的量为状态函数:对于过程变量直接表示即可,W,Q等。 广义功: 广义功=广义的力(强度性质)×广义位移(广度性质) oW p.dv+(xdx ydy +.....=ow.oW 非体积功:W,,几种功的表示式见下表。 功的种类 强度因素 广义因素的改变 功的表示式6W 机械功 F(力) d(位移) Fdl 电功 E(外加电位) dQ(通过的电量) Edo 反抗地心引力的功 Mg(质量×重力加速度)dh(高度的变化) mgdh 膨胀功 P.(外压) dW(体积的变化) -Pdv 第10页共75页
延安大学精品课程 …… 物理化学 第 10 页 共 75 页 体系吸热,Q>0; 体系放热,Q0; 体系对环境作功,W<0 。 特点:可以等当量的转化为环境中重物的升降。 说明:Q 和 W 都不是状态函数,其数值与变化途径有关。 分类:功可分为膨胀功和非膨胀功两大类。 功分类:功可分为膨胀功和非膨胀功两大类。 膨胀功:由于系统体积的变化而做的功,也叫体积功,用 We 表示。 如图所示,用活塞将气体密封在截面积为 s 的圆柱形桶内,气体发生一膨胀过程,外压为 pe,活塞 向上移动了 dl,则 We = Fdl = p外 Sdl = p外dV = pedV 注意几点: (1)pe表示系统的外部压力,只有系统处于平衡态时 pe = pi (2)体积功唯一的表达形式 pedV ,pV,Vdp 不是体积功。 (3)对等压过程: W = p(V2 −V1)= pV (4)规定:体系体积膨胀,对外做功 W < 0,取“-”号;反 之取“+” 号。 (5)由体积功的计算公式,不管外压多大,等容过程,体积功为零。 (6)符号书写: 微小变化 dU, dH; “d” 后的量为状态函数;δW,δQ,“δ”后的量为过程变量。 较大变化 ΔU,ΔH,“Δ”后的量为状态函数;对于过程变量直接表示即可,W,Q 等。 广义功: 广义功 = 广义的力(强度性质) 广义位移(广度性质) W = pedV +(xdX + ydY +......) = We + Wf 非体积功: W f ,几种功的表示式见下表。 功的种类 强度因素 广义因素的改变 功的表示式 W 机械功 F(力) dl(位移) Fdl 电功 E(外加电位) dQ(通过的电量) EdQ 反抗地心引力的功 Mg(质量×重力加速度) dh(高度的变化) mgdh 膨胀功 Pe(外压) dV(体积的变化) - PedV dl 始 态 p